Clinical-anamnestic, laboratory-instrumental, structural and functional peculiarities of older age patients 6 months after myocardial infarction
Annotation
Acute myocardial infarction is one of the most studied diseases, however, despite many clinical studies, elderly patients remain an unexplored group of patients, since they are often a criterion for exclusion from clinical trials.Paper reveals clinical-anamnestic, laboratory-instrumental, structural and functional characteristics of patients, as well as the peculiarities of an increase in the concentration of markers of myocardial fibrosis in older age groups who have undergone acute coronary syndrome with ST-segment elevation, 6 months after underwent revascularization by percutaneous coronary intervention are considered. Data obtained from our own prospective, open, controlled study which lasted from the onset of myocardial infarction to 6 months after. Тhe text provides the characteristic features of patients of older age groups, their distinctive characteristics from middle-aged patients, and also explains these features based on the data obtained in the study. The paper also presents the results of the concentration of markers of myocardial damage (MMP-9), and the difference in the increase between elderly patients and younger groups is proved. The study proved a decrease in heart rate in middle-aged and elderly patients by 20–25 %, and an increase by 1.2 % in elderly patients 6 months after myocardial infarction. Regardless of the age of the patients, there is a deterioration in renal function due to an increase in blood creatinine concentration by 15–25 % (p < 0,05), which is associated with hypoperfusion of blood flow through the renal tissue due to a decrease in cardiac output. In middle-aged and elderly patients, an improvement in the systolic function of the left ventricular myocardium was determined due to an increase in the ejection fraction by 5–6 % to the values of the relative intact ejection fraction (50–60 %), however, in elderly patients there is no increase in the ejection fraction, which remains at the values borderline values (40–50 %) (p < 0,05). The preservation of high concentrations of MMP-9 in elderly patients 6 months after a heart attack was determined, exceeding the reference values by 50 %, with normalization in middle-aged and elderly patients (p < 0,05). All of the above indicates the need for an individual approach to the prescribed drug therapy, further treatment tactics in elderly patients, which indicates the need for an individual approach to prescribed drug therapy, further treatment tactics in elderly patients.
Keywords: myocardial infarction, myocardial remodeling, chronic heart failure, matrix metalloproteinases, elderly and senile patients
Unfortunately, the article is available only in Russian
Введение
С учетом роста общей продолжительности жизни в популяции увеличивается количество пациентов пожилого и старческого возраста, выживших после острого коронарного синдрома с подъемом сегмента ST (ОКСпST) [Осипова и др., 2020]. Благодаря достигнутому технологическому прогрессу, успешным методам реваскуляризации миокарда у пациентов ОКСпST старших возрастных увеличивается процент выживших пациентов и, как следствие, растет число больных с ремоделированным миокардом. Сложности в предполагаемых исходах ремоделирования миокарда левого желудочка (ЛЖ) у пациентов пожилого и старческого возраста, перенесших ОКСпST, первоначально связаны с тем, что количество исследований, определяющих отдаленные исходы (6 и более месяцев), у репрезентативных выборок больных крайне ограничено [Wojtkowska et al., 2017]. Остаются неизученными особенности клинико-анамнестических данных, лабораторно-инструментальных показателей, структурно-функциональных характеристик ремоделирования сердца, уровень повышения концентрации маркеров фиброза миокарда (ММП-9, ТИМП-1) у пациентов старших возрастных групп на модели ОКСпST, которая лежит в основе механизмов патогенеза хронической сердечной недостаточности (ХСН) [Han-Yang Chen et al., 2015].
Объекты и методы исследования
Исследование проводилось на базе отделения кардиологии № 2 ОГБУЗ БОКБ Святителя Иоасафа, г. Белгород. Поведено продольное, проспективное, когортное, рандомизированное исследование. В исследование включено 132 человека, из которых 132 человека больных ОКСпST в возрасте от 45 до 82 лет (средний возраст пациентов составил (65,9 ± 15,3) года). Больные распределены на 3 группы в зависимости от возраста (48 пациентов среднего возраста, 44 – пожилого, 40 – старческого).
Критерии включения в исследование: ОКСпST с успешной реваскуляризацией миокарда методом ЧКВ в первые сутки от начала заболевания.
Критерии исключения: ОКС без подъема сегмента ST, сопутствующие острые воспалительные, онкологические, хронические заболевания в стадии обострения; перенесенные оперативные вмешательства в последние полгода.
Артериальное давление (АД) измеряли трехкратно на обеих руках. Стандартная электрокардиограмма (ЭКГ) в 12-ти отведениях регистрировалась с помощью
12-канального электрокардиографа SCHILLER AT-1 (2004). На ЭКГ определялись: интервал QT (мс), частота сердечных сокращений (ЧСС), ширина комплекса QRS (мс). Эхокардиография выполнялась на эхокардиографе «PHILIPS Envisor C» (США, 2005) по общепринятой методике [Ertaş et al., 2016] . Определялись структурные характеристики: конечно-диастолический размер (КДР) ЛЖ конечно-систолический объем (КСО) ЛЖ, конечно-диастолический объем (КДО) ЛЖ. Функциональные характеристики: ударный объем (УО), фракция выброса (ФВ) ЛЖ. Диастолическая функция
ЛЖ изучалась по определению скорости раннего (Е) и предсердного (А) потока и их соотношения (Е/А), отношение максимальной скорости быстрого наполнения ЛЖ
к максимальной скорости движения латеральной части митрального кольца (Е/E’)
и времени замедления потока раннего диастолического наполнения DT. Коронароангиография проводилась на ангиографическом комплексе «Innova 3100» (General Electric Medical Systems, США). Критерием многососудистого поражения было поражение двух основных артерий свыше 70 % стеноза, либо одной основной и двух дополнительных ветвей. Определение концентрации ТИМП-1 и ММП-9 проводилось методом иммуноферментного анализа (ИФА) с использованием высокочувствительных наборов High sensetiviti tissue inhibitor of metalloproteinases 1 (H) (ELISA Kit, США), Human MMP-9 (ELISA Kit, США).
Результаты
Динамика клинико-анамнестичесхих показателей у пациентов разных возрастных групп за период от дебюта инфаркта до конца 6 месяцев после перенесенной реваскуляризации. В нашей работе мы оценивали динамику гемодинамических показателей (АД, ЧСС) у пациентов разных возрастных групп от момента развития ОКСпST к 6 месяцам после успешной реваскуляризации.
У пациентов среднего возраста наблюдается достоверно значимое снижение систолического АД [Pu et al., 2017] на 12,7 % – с 149,4 мм рт. ст. до 130 мм рт. ст. (р = 0,01), у пациентов пожилого возраста АД систолическое снизилось на 8,5 % – со 140,9 мм рт. ст. до 128 мм рт. ст., однако снижение оказалось недостоверным (р > 0,05), у пациентов старческого возраста АД систолическое снизилось на 12 % – с 150,2 мм рт. ст. до 132 мм рт. ст. (р = 0,01).
Уровень АД диастолического у пациентов среднего возраста снизился на 8,5 % – с 91 мм рт. ст. до 80 мм рт. ст. (р = 0,01), у пациентов пожилого возраста АД диастолическое снизилось на 1,2 % – с 81,3 мм рт. ст. до 80 мм рт. ст. (р > 0,05), у пациентов старческого возраста АД диастолическое снизилось на 2,3 % – с 87,6 мм рт. ст. до 85 мм рт. ст. (р > 0,05).
ЧСС у пациентов среднего возраста снизилась на 12,8 % – с 78,6 ударов/минуту до 68,0 ударов/минуту (р < 0,05), у пациентов пожилого возраста ЧСС снизилась на 9,5 % – с 73,7 ударов/минуту до 66 ударов/минуту (р < 0,05), у пациентов старческого возраста ЧСС, в отличие от пациентов пожилого и среднего возраста, повысилась на 2,56 % – с 78,5 ударов/минуту до 80 ударов/минуту, при этом в группе пациентов старческого возраста не происходит достижение целевых цифр ЧСС [Kotseva et al., 2016].
Динамика лабораторно-инструментальных изменений у пациентов разных возрастных групп за период от дебюта инфаркта до конца 6 месяцев после перенесенной реваскуляризации. Анализы динамики электрокардиограммы, лабораторных показателей позволяют судить о развитии миокардиального фиброза [Yong-Gang Sui et al 2019] почечной функции и оценивать изменения в липидном профиле [Yudi et al., 2016]. В нашей работе мы проанализировали динамику этих факторов.
Показатели воспаления, а именно лейкоциты, у пациентов среднего возраста снизились на 27,2 % – с 11,57 × 109 до 8,38 × 109 (р = 0,023), в то же время у пациентов пожилого возраста снижение составило 35,3 % – с 11,3 × 109 до 7,1 × 109 (р = 0,01), у пациентов старческого возраста снижение составило 34,2 % – с 11,0 × 109 до 7,23 × 109 (р = 0,03). Уровень креатинина как маркера почечной дисфункции [Deckers et al 2017] показал достоверно значимое увеличение в группе пациентов среднего возраста: на 25,3 % – с 71,2 мкмоль/л до 89,0 мкмоль/л (р = 0,005), пожилого: на 24,8 % – с 77,3 мкмоль/л до 96,1 мкмоль/л (р = 0,04) и старческого: на 25 % – с 80,6 мкмоль/л до 100,1 мкмоль/л (р = 0,01). Показатели липидограммы распределились следующим образом: значения общего холестерина показали положительную динамику во всех возрастах – у пациентов среднего возраста холестерин через 6 месяцев лечения снизился на 40 % (с 5,46 ммоль/л до 3,6 ммоль/л) (р = 0,006), у пожилых пациентов снижение холестерина составило 22,6 % (с 5,18 ммоль/л до 3,87 ммоль/л) (р = 0,01), а у пациентов старческого возраста снижение холестерина составило 14,7 % (с 4,89 до 4,17) (р < 0,05). Концентрация липопротеинов низкой плотности (ЛПНП) у пациентов среднего возраста снизилась на 30,3 % (с 3,52 ммоль/л до 2,09 ммоль/л) (р = 0,003). У пожилых пациентов снижение составило 25,3 % (с 3,39 ммоль/л до 2,24 ммоль/л) (р > 0,05), в то время как у пациентов старческого возраста показатель ЛПНП снизился на 18 % (с 3,28 ммоль/л до 2,46 ммоль/л) (р < 0,05). В то же время целевых значений ЛПНП (менее 1,7 ммоль/л) достигли 29,6 % пациентов средних лет, 27,2 % пожилых и 20,0 % пациентов старческого возраста. Динамика липопротеинов высокой плотности (ЛПВП) распределилась следующим образом: у пациентов среднего возраста ЛПВП снизились на 14,6 % (с 1,09 ммоль/л до 0,93 ммоль/л) (р < 0,005). У пациентов пожилого возраста ЛПНВ снизилось на 13,5 % (с 1,18 до 1,02 ммоль/л) (р = 0,006), у пациентов старческого возраста снижение составило 5,9 % (с 1,19 до 1,12 ммоль/л) (р > 0,05). [Levine et al., 2014]. У пациентов среднего и старческого возраста ширина комплекса QRS как показатель внутри-желудочковой проводимости не показала значимой динамики (р > 0,05), однако у пациентов пожилого возраста отмечает уменьшение ширины комплекса QRS на 15,1 % (р < 0,05) (рис. 1).
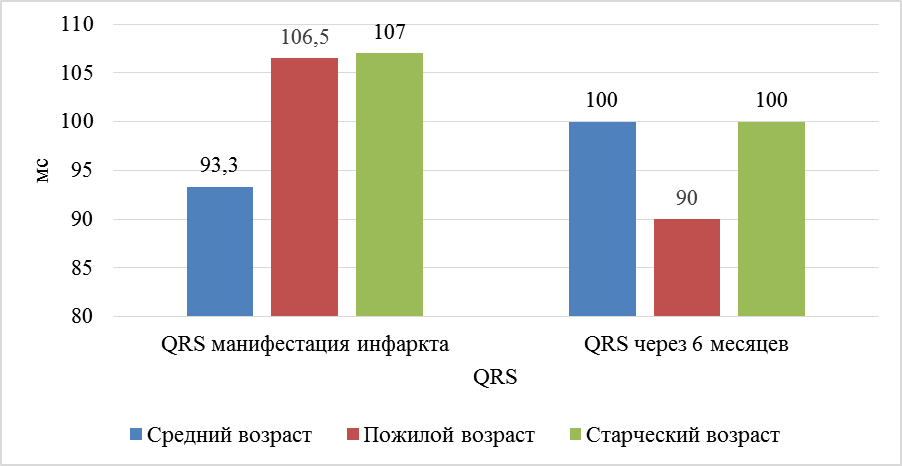
Рис. 1. Динамика QRS за период от начала развития ОКСпST до конца 6 месяцев после реваскуляризации у пациентов разных возрастных групп
Fig. 1. QRS dynamics for the period from the beginning of STEMI until the end of 6 months after revascularization in middle-aged, elderly and senile patients
Динамика структурно-функциональных изменений у пациентов разных возрастных групп в период от дебюта инфаркта до конца 6 месяцев после перенесенной реваскуляризации. Изменения показателей ультразвукового исследования сердца являются самыми важными критериями оценки структуры и функции сердца после перенесенного инфаркта [Gu et al., 2019]. В нашей работе мы провели анализ основных показателей. Динамика структурных показателей миокарда ЛЖ через 6 месяцев от перенесенного инфаркта представлена в таблице.
Динамика функциональных показателей ЭхоКГ за период от начала развития ОКСпST до полугода после реваскуляризации у пациентов разных возрастных групп Me (Q25 %, Q75 %)
Dynamics of functional parameters of echocardiography over the period from the onset of STEMI development to half a year after revascularization in patients of different age groups Me (Q25 %, Q75 %)
Возраст | Показатели | ОКСпST | 6 месяцев | % | р |
Средний | ФВ % | 48,3 [43,5; 51,5] | 52,0 [46,5; 56,0] | 7,5 | 0,01 |
УО мл | 57,2 [48,2; 64,8] | 65,5 [60,0; 72,0] | 14,3 | 0,001 | |
Е/А | 0,77 [0,51; 0,86] | 0,89 [0,7; 1,15] | 15,5 | 0,03 | |
DT мс | 212,1 [191,0; 244,0] | 204,0 [180,0; 228,0] | -3,8 | 0,3 | |
Е/е’ | 10,3 [10,3; 11,4] | 9,0 [7,6; 10,5] | -12,7 | 0,001 | |
Пожилой | ФВ % | 47,5 [43,8; 50,0] | 50,5 [43,5; 56,0] | 6,2 | 0,03 |
УО мл | 54,4 [48,0; 58,8] | 59,0 [52,0; 66,2] | 8,3 | 0,008 | |
Е/А | 0,72 [0,60; 0,76] | 0,77 [0,67; 0,88] | 6,9 | 0,01 | |
DT мс | 214,8 [190,0; 241,0] | 231,0 [187,0; 248,0] | 7,5 | 0,44 | |
Е/е’ | 9,7 [9,4; 11,4] | 8,9 [7,6; 11,5] | -7,6 | 0,01 | |
Старческий | ФВ % | 47,1 [46,2; 50,8] | 47,5 [44,0; 55,0] | 0,8 | 0,43 |
УО мл | 51,0 [41,2; 60,8] | 51,0 [41,8; 71,0] | 0 | 0,21 | |
Е/А | 0,84 [0,55; 0,72] | 0,62 [0,58; 0,70] | -26,1 | 0,008 | |
DT мс | 248,2 [216,0; 285,0] | 234,0 [183,0; 286,0] | -5,7 | 0,7 | |
Е/е’ | 9,7 [8,8; 11,5] | 8,0 [7,40; 9,10] | 16,7 | 0,003 |
Определено, что КДОлж показал значимый рост через 6 месяцев от инфаркта в группах среднего и пожилого возрастов (р < 0,05), однако в группе больных старческого роста динамика оказалась незначимой (р > 0,05). В группе среднего возраста КДОлж вырос на 16,01 % – с 115,5 мл до 134 мл, в группе пожилых пациентов КДОлж вырос на 11,01 % – с 114,4 мл до 127 мл, в группе больных старческого возраста КДОлж увеличился на 5,94 % – с 107,6 мл до 114 мл.
Через 6 месяцев после перенесенного ОКСпST у пациентов среднего и пожилого возраста установлен рост ФВ ЛЖ до значений сохранной ФВ (50,5 и 52 % соответственно), у пациентов среднего возраста ФВ ЛЖ выросла на 7,5 % (р = 0,01), у пожилых пациентов – на 6,2 % (р = 0,03), однако у пациентов старческого возраста ФВ ЛЖ осталась в пограничных значениях (47,5 %), практически не изменившись от момента дебюта ОКСпST (рост составил меньше 1 %) (рис. 2).
 Рис. 2. Динамика ФВ за период от начала развития ОКСпST до конца 6 месяцев после реваскуляризации у пациентов разных возрастных групп
Рис. 2. Динамика ФВ за период от начала развития ОКСпST до конца 6 месяцев после реваскуляризации у пациентов разных возрастных групп
Fig. 2. EF dynamics over the period from the onset of STEMI development until the end of 6 months after revascularization in middle-aged, elderly and senile patients
Важным представляется тот факт [Bagai et al., 2019], что у 30 % пациентов старческого возраста через 6 месяцев после перенесенного ОКСпST показатели ФВ ЛЖ достигли показателей сохранных значений (> 50 %), у 50 % показатели ФВ остались без динамики (40–50 %), а у 20 % выявилось падение инотропной функции ЛЖ в виде уменьшения ФВ ЛЖ (< 40 %); у пожилых пациентов сохранная ФВ ЛЖ через 6 месяцев от перенесенного ОКСпST оказалась у 54,5 %, промежуточная ФВ ЛЖ была у 27,2 %, а сниженная ФВ ЛЖ – у 19,8 %; у пациентов среднего возраста сохранная ФВ ЛЖ оказалась у 55,5 %, промежуточная – у 33,3 %, а сниженная – у 11,1 %.
Анализ динамики диастолической функции левого желудочка: у пациентов старческого возраста несколько понизилось отношение пика Е (период раннего наполнения ЛЖ) к пику А (систола предсердий, или период позднего наполнения ЛЖ), однако это снижение оказалось недостоверным. Напротив, у пожилых пациентов (р = 0,014) и у пациентов среднего возраста (р = 0,03) имело достоверное повышение отношения Е/А. Так, у пациентов среднего возраста отношение пика Е к пику А выросло на 15,5 % – с 0,77 к 0,89, у пожилых пациентов отношение выросло на 6,9 % с 0,72 на 0,77, у пациентов старческого возраста отношение пика Е к пику А снизилось на 26,1 % – с 0,84 к 0,62. Таким образом, у пациентов старческого возраста, в отличие от пациентов среднего и пожилого возраста, прослеживается тенденция к уменьшению влияния вклада систолы предсердий в общую сократимость миокарда ЛЖ вследствие увеличения жесткости последнего.
Динамика маркеров фиброза миокарда у пациентов разных возрастных групп за период от дебюта инфаркта до конца 6 месяцев после перенесенной реваскуляризации. ММП-9 и ТИМП-1 активируются в момент развития острой ишемии миокарда и их концентрация в крови резко увеличивается [Zhang et al., 2020], однако остается недостаточно изучено, насколько отличаются концентрации этих маркеров фиброза у различных возрастных групп в момент развития инфаркта миокарда в отдаленный период (6 месяцев) [Wang et al., 2018]. В нашей работе мы представили концентрацию ММП-9, ТИМП-1 и их соотношение во время развития инфаркта миокарда и их изменение спустя 6 месяцев у пациентов старческого, пожилого и среднего возрастов и проанализировали эти факторы.
ММП-9 показали значимую динамику снижения во всех возрастных группах. Так, у пациентов среднего возраста ММП-9 через 6 месяцев от перенесенного инфаркта миокарда снизились на 82,9 % с 141 нг/мл до 24 нг/мл (р < 0,001), у пациентов пожилого возраста снижение концентрации ММП-9 через 6 месяцев от перенесенного инфаркта миокарда составило 86,8 % – с 154 нг/мл до 20,3 нг/мл (р < 0,001), у пациентов старческого возраста показатели ММП-9 снизились на 30,4 % – с 240 нг/мл до 184 нг/мл (р < 0,001) (рис. 3).
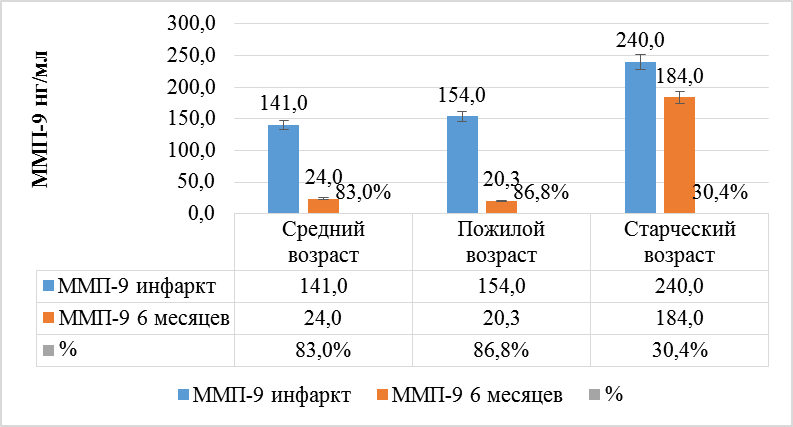
Рис. 3. Динамика ММП-9 за период от начала развития ОКСпST до конца 6 месяцев после реваскуляризации у пациентов разных возрастных групп
Fig. 3. Dynamics of MMP-9 over the period from the onset of ST-ACS development to the end of 6 months after revascularization in middle-aged, elderly and senile patients
Обсуждение
Мы установили, что у пациентов, независимо от возраста, через 6 месяцев после перенесенной реваскуляризации происходит улучшение гемодинамических показателей в виде достижения целевых цифр АД (снижение составляет 10–15 %). ЧСС также снижается у пациентов среднего и пожилого возраста (на 15–20 %), однако у пациентов старческого возраста происходит незначительный рост ЧСС через 6 месяцев после перенесенной реваскуляризации, что, вероятно, связано с высокой симпатической активностью в старческом возрасте [Kocayigit et al., 2019]. У пациентов пожилого возраста через 6 месяцев после перенесенной реваскуляризации отмечается уменьшение длины комплекса QRS электрокардиограммы (на 10 %), что отражает улучшение процессов внутри-желудочковой проводимости [Kalyuzhin et al., 2016], в то время как у пациентов старческого возраста комплекс QRS остается уширенным (>100 мс), что, вероятно, связано с прогрессированием интракардиального фиброза. Независимо от возраста, через 6 месяцев после перенесенного ОКСпST у пациентов установлено ухудшение почечной функции в виде роста концентрации креатинина крови (на 20–25 мкмоль во всех возрастных группах). Определено, что систолическая функция левого желудочка показывает положительный рост в виде увеличения фракции выброса на 5–6 % до значения относительно сохранной ФВ (50–60 %) в группе пациентов среднего и пожилого возраста, в то время как у пациентов старческого возраста ФВ остается в пограничных значениях (40–50 %) [Osipova et al., 2017]. Доказано ухудшение диастолической функции миокарда ЛЖ у пациентов старческого возраста ввиду роста отношения Е/А, что указывает на недостаточный вклад предсердий в общую сократимость миокарда левого желудочка вследствие выраженной жесткости последнего. Установлено, что у пациентов всех возрастов в момент развития острого инфаркта миокарда происходит достоверно значимое повышение концентрации в крови ММП-9, однако у пациентов старческого возраста уровень последней преобладает над показателями в более молодых возрастных группах [Gudnadottir et al., 2019]. Через 6 месяцев происходит значимое снижение концентрации ММП-9 в группе среднего и пожилого возрастов до значений группы контроля (<80 нг/мл), в то время как в группе старческого возраста также происходит снижение концентрации ММП-9, однако в сравнении с пациентами среднего и пожилого возрастов снижение достаточно небольшое и остается выше значений группы контроля (среднее значение 141 нг/мл).
Заключение
Пациенты старческого возраста через 6 месяцев после перенесенного ОКСпST характеризуются ростом ЧСС на 1,2 % в то время как у пациентов среднего и пожилого возраста отмечается снижение ЧСС на 15–20 % (р < 0,05), этот факт говорит о значимом симпатическом влиянии у пациентов старческого возраста после перенесенного инфаркта миокарда. Значимых отличий в показателе АД в зависимости от возраста не наблюдается, что, вероятно, связано с грамотно подобранной антигипертензивой терапией. Независимо от возраста, через 6 месяцев после перенесенного ОКСпST пациенты характеризуются ухудшением функции почек в виде увеличения концентрации креатинина крови
на 20–25 мкмоль/л (р < 0,05), что обусловлено гипоперфузией почечной ткани вследствие сниженного сердечного выброса после перенесённого инфаркта. У пациентов пожилого возраста отмечается улучшение внутри-желудочковой проводимости (р < 0,05), комплекс QRS уменьшается на 0,1 мс, в то время как у пациентов старческого возраста комплекс QRS не изменяется от начала инфаркта миокарда и остается уширенным (106 мс), эти данные свидетельствуют о далеко зашедших процессах интракардиального фиброза у пациентов старческого возраста. У пациентов среднего и пожилого возраста через 6 месяцев после перенесенного инфаркта отмечается улучшение систолической функции в виде увеличения ФВ на 5–6 % (р < 0,05), в то время как у пациентов старческого возраста отсутствует рост ФВ. Через 6 месяцев после манифеста ОКСпST концентрация ММП-9 у пациентов старческого возраста сохраняется высокой (на 80 % выше референсных значений) (р < 0,05), в то время как у пациентов среднего и пожилого возраста ММП-9 достигает нормальных значений, что свидетельствует о постоянной вовлеченности ММП-9 на процессы ремоделирования миокарда ЛЖ в период до 6 месяцев после ОКСпST.





Reference lists
Osipova O.A. Bukatov V.V. 2020. Osobennosti techeniya infarkta miokarda s pod"emom segmenta ST u bol'nyh pozhilogo i starcheskogo vozrasta [Features of myocardial infarction with ST segment elevation in patients of the older age group]. Research Results in Biomedicine. 6 (3): 402–416. DOI:10.18413/2658-6533-2020-6-3-0-10 (in Russian).
Bagai A., Chen A.Y., Ude J.A., McManus D.D., Maurer M.S., Enriquez J.R., Hochman J., Goyal A., Henry T.D., Gulati M., Garratt K.N., Roe M.T., Alexander K.P. 2019. Association of Cognitive Impairment With Treatment and Outcomes in Older Myocardial Infarction Patients: A Report From the NCDR Chest Pain-MI Registry. J. Am. Heart. Assoc. 8 (17): e012929. DOI: 10.1161/JAHA.119.012929.
Chen H.Y., Gore J.M., Lapane K.L., Yarzebski J., Person S.D., Gurwitz J.H., Kiefe C.I., Goldberg R.J. 2015. A 35-year Perspective (1975–2009) into the Long-term Prognosis and Hospital Management of Patients Discharged from the Hospital after a First Acute Myocardial Infarction. Am. J. Cardiol. 116 (1): 24–29. DOI: 10.1016/j.amjcard.2015.03.035.
Deckers K., Schievink S.H.J., Rodriquez M.M.F. 2017. Coronary heart disease and risk for cognitive impairment or dementia: Systematic review and meta-analysis. Meta-Analysis. 12 (9): e0184244. DOI: 10.1371/journal.pone.0184244.
Ertaş F.S., Tokgözoğlu L. 2016. Pre- and in-hospital antithrombotic management patterns and in-hospital outcomes in patients with acute coronary syndrome: data from the Turkish arm of the EPICOR study. Anatol. J. Cardiol. 16 (12): 900–915.
Gu S.Z., Beska B., Chan D., Neely D., Batty J.A., Adams-Hall J., Mossop H., Qiu W., Kunadian V. 2019. Cognitive Decline in Older Patients With Non ST Elevation Acute Coronary Syndrome. Journal of the American Heart Association. 88 (4): e011218. DOI: 10.1161 /JAHA.118.011218.
Gudnadottir G.S., James S.K., Andersen K., Lagerqvist B., Thrainsdottir I.S., Ravn-Fischer A., Varenhorst C., Gudnason T. 2019. Outcomes after STEMI in old multimorbid patients with complex health needs and the effect of invasive management. American Heart Journal. 211: 11–21. DOI: 10.1016/ j.ahj.2019.01.008,
Jun Pu, Song Ding, Heng Ge, Yaling Han, Jinchen Guo, Rong Lin, Xi Su, Heng Zhang, Lianglong Chen, Ben He. 2017. Efficacy and Safety of a Pharmaco-Invasive Strategy With Half-Dose Alteplase Versus Primary Angioplasty in ST-Segment-Elevation Myocardial Infarction: EARLY-MYO Trial (Early Routine Catheterization After Alteplase Fibrinolysis Versus Primary PCI in Acute ST-Segment-Elevation Myocardial Infarction). EARLY-MYO Circulation. 136 (16): 1462–1473. DOI: 10.1161/CIRCULATIONAHA.117.030582.
Kalyuzhin V.V., Teplyakov A.T., Solovtsov M.A. 2016. Remodeling of the left ventricle: one or more scenarios? Bulletin of Siberian medicine. 15 (4): 120–139.
Kocayigit I., Yaylaci S., Osken A., Aydın E., Sahinkus S., Can Yu., Genc A.B., Gunduz H. 2019. Comparison of effects of thrombolytic therapy and primary percutaneous coronary intervention in elderly patients with acute ST-segment elevation myocardial infarction on in-hospital, six-month, and one-year mortality. Arch. Med. Sci. Atheroscler. Dis. 27 (4): 82–88. DOI: 10.5114/amsad.2019.85378.
Kotseva K., Wood D., Bacquer D.D., Backer G.D., Rydén L., Jennings C., Gyberg V., Amouyel P., Bruthans J., Conde A.C., Cífková R., Deckers J.W., Sutter J.D., Dilic M., Dolzhenko M., Erglis A., Fras Z., Gaita D., Gotcheva N., Goudevenos J., Heuschmann P., Laucevicius A., Lehto S., Lovic D., Miličić D., Moore D., Nicolaides E., Oganov R., Pajak A., Pogosova N., Reiner Z., Stagmo M., Störk S., Tokgözoğlu L., Vulic D. 2016. A European Societyof Cardiology survey on the lifestyle, risk factorand therapeutic management of coronarypatients from 24 European countries. Eur. J. Cardiol. 23 (6): 636–648. DOI:10.1177/2047487315569401.
Levine D.A., Davydow D.S., Hough C.L., Langa K., Rogers M.A.M., Iwashyna T.J. 2014. Disability and Cognitive Impairment After Hospitalization for Myocardial Infarction and Stroke. Circulation: Cardiovascular Quality and Outcomes. 7 (6): 863–871. DOI: 10.1161/HCQ.0000000000000008.
Melen Y.P., Skybchik V.A., Fedechko M.Y., Kopchak L.M. 2020. Effect of primary stenting of coronary arteries on clinical course and remodeling of the left ventricle in patients with acute st segment elevation myocardial infarction (results after 12 months). Wiad. Lek. 73 (1): 68–72. DOI:10.31928/2305-3127-2019.1.2128.
Osipova O.A., Zhernakova N.I., Belousova O.N., Pushkareva A.E. 2017. Cardiac mechanisms of chronic heart failure development in patients with ischemic heart disease, postman arctic cardiosclerosis of the elderly. Drug Invention Today. 9 (3): 39–43.
Sugiyama T., Hasegawa K., Kobayashi Y., Takahashi O., Fukui T., Tsugawa Y. 2015. Differential time trends of outcomes and costs of care for acutemyocardial infarction hospitalizations by ST elevation and type of intervention in the United States, 2001–2011. J. Am. Heart Assoc. 4 (3): 414–428. DOI:10.1161/JAHA.114.001445.
Wang X., Khalil R.A. 2018. Matrix Metalloproteinases, Vascular Remodeling, and Vascular Disease. Adv Pharmacol. 81: 241–330. DOI: 10.1016/bs.apha.2017.08.002.
Wojtkowska I., Stępińska J., Stępień-Wojno M., Sobota M., Kopaczewski J., Reszka Z., Kurzelewski M., Medina J. 2017. Current patterns of antithrombotic and revascularization therapy in patients hospitalised for acute coronary syndromes. Data from the Polish Subset of the EPICOR Study. Kardiol. Pol. 75 (5): 445–452. DOI:10.1056/NEJMoa1817083.
Yong-Gang Sui, Si-Yong Teng, Jie Qian, Yuan Wu, Ke-Fei Dou, Yi-Da Tang, Shu-Bin Qiao, Yong-Jian Wu. 2019. Invasive versus conservative strategy in consecutive patients aged 80 years or older with non-ST-segment elevation myocardial infarction: a retrospective study in China. J. Geriatr. Cardiol. 16 (10): 741–774. DOI: 10.11909/j.issn.1671-5411.2019.10.006.
Yudi M.B., Jones N., Fernando D., Clark D.J., Ramchand J., Jones E., Dakis R., Johnson D., Chan R., Islam A., Farouque O., Horrigan M. 2016. Management of Patients Aged ≥ 85 Years With ST-Elevation Myocardial Infarction. Am. J. Cardiol. 118 (1): 44–48. DOI: 10.1016/j.amjcard.2016.04.010.
Zhang H., Yin Y., Liu Y., Zou G., Huang H., Qian P., Zhang G., J. Zhang. 2020. Necroptosis Mediated by Impaired Autophagy Flux Contributes to Adverse Ventricular Remodeling after Myocardial Infarction. Biochem Pharmacol. 14 (175): 113915 doi: 10.1016/j.bcp.2020.113915.