Neural Network Classification of the Type of Ulcerative Gastroduodenal Bleeding According to Endoscopic Images
Annotation
Ulcerative gastroduodenal bleeding remains a serious problem in modern medicine. To determine the type of ulcerative bleeding, the Forrest classification is used worldwide, defining the tactics of treating patients with bleeding gastroduodenal ulcers. The ability to correctly classify the type of bleeding depends primarily on the experience of an endoscopist. With the development of artificial intelligence technologies, there are high expectations in improving the diagnosis and treatment of surgical diseases. This article discusses the possibility of developing an algorithm for recognizing the type of ulcerative bleeding from endoscopic images using machine learning models and integrating it into an expert medical decision support system. In the course of this study, the first Russian neural network classification was developed, which makes it possible to determine the type of ulcerative gastroduodenal bleeding with 75,56 % accuracy. The developed algorithm for recognizing the type of ulcerative bleeding is integrated into a mobile application as a tool to help in making medical decisions, which in the future will improve the quality of diagnosis and medical care for patients with gastrointestinal bleeding of ulcerative etiology.
Keywords: ulcerative gastroduodenal bleeding, artificial intelligence, machine learning, clinical solutions
Unfortunately, the article is available only in Russian
Введение
Актуальность. Язвенные гастродуоденальные кровотечения (ЯГДК) продолжают оставаться серьезной проблемой современной медицины, что определяется высокой частотой встречаемости и летальности при данной патологии. Согласно аналитическим данным, в 2024 году в хирургические стационары Российской Федерации было госпитализировано 48 154 пациента с ЯГДК, оперативное лечение было проведено 5 954 (12,36 %) пациентам при общей летальности в 6,04 % и уровне послеоперационной летальности в 19,53 % [Баранников и др., 2025; Бедин и др., 2025; Ревишвили и др., 2025].
Ведущим методом в диагностике и лечении ЯГДК является неотложная эзофагогастродуоденоскопия (ЭГДС). ЭГДС позволяет диагностировать кровотечение из верхних отделов пищеварительного тракта, установить источник и характер кровотечения [Гасанов и др., 2025; Генрих и др., 2025]. Для определения типа ЯГДК общемировое признание получила эндоскопическая классификация J. Forrest, 1974. Наиболее важной клинической характеристикой данной классификации является возможность определения тактики лечения пациентов с различным типом ЯГДК [Безалтынных и др. 2025; Шептулин, Работягова, 2025]. При продолжающемся кровотечении FIA-FIB показан эндоскопический гемостаз, при нестабильно остановившемся FIIA-FIIB необходимо выполнить эндоскопическую профилактику рецидива кровотечения, а при типе FIIC и FIII эндоскопическая профилактика рецидива кровотечения не рекомендуется [Ивашкин и др., 2024; Cherednikov et al., 2022].
Способность правильно определять тип ЯГДК зависит, прежде всего, от опыта врача-эндоскописта. Так, согласно данным Laine, частота правильного определения типа ЯГДК по J. Forrest увеличивалась по мере накопления опыта (выполнение пяти процедур в месяц) с 59 % до 73 % до прохождения обучения. При оценке типов кровоточащих язв по J. Forrest наблюдается высокая степень согласованности между врачами-эндоскопистами при кровотечениях FIA-FIB, в то время как при FIIA, FIIB, FIIC, FIII согласованность низкая. При этом важно отметить, что ошибки в классификации типов ЯГДК по J. Forrest напрямую приводят к неправильной тактике лечения и развитию рецидивов кровотечения [Yen et al., 2021].
С развитием технологий искусственного интеллекта (ИИ) связаны большие ожидания в совершенствовании диагностики и лечении ЯГДК [Bindra, Jain, 2024; Tasci et al., 2025]. В современной научной литературе активно рассматриваются возможности нейронных сетей и методов машинного обучения для анализа эндоскопических изображений и диагностики желудочно-кишечных кровотечений, что подтверждается работами [Shung, 2021; Alhajlah et al., 2023; Lobanovs et al., 2025], которые демонстрируют значительный потенциал и перспективы применения этих технологий для повышения точности и эффективности диагностики, а также улучшения качества медицинской помощи пациентам. Однако, важно отметить, что в доступных литературных источниках имеются лишь единичные сведения о разработках по применению ИИ в классификации ЯГДК, что связано, прежде всего, с отсутствием общедоступного набора данных эндоскопических изображений ЯГДК [Borgli et al., 2020]. При этом отечественных прототипов нейросетевых классификаций ЯГДК в доступных литературных источниках и реферативных базах найдено не было, что обуславливает необходимость разработки отечественных технологий машинного обучения (МО) для клинической хирургии в целях улучшения качества диагностики и лечения хирургических заболеваний.
Цель. Улучшение качества оказания медицинской помощи пациентам с кровоточащими гастродуоденальными язвами путем разработки алгоритма нейросетевой классификации типа язвенного кровотечения по эндоскопическим изображениям и его интеграции в экспертную цифровую систему поддержки принятия врачебных решений.
Материалы и методы
Исследование проведено c соблюдением принципов Этики (Разрешение Этического комитета Воронежского государственного медицинского университета им. Н.Н. Бурденко Минздрава России (Протокол № 1 от 28.01.2020 г)). На первом этапе разработки нейросетевой классификации ЯГДК был сформирован обучающий набор ЭИ пациентов с различными типами кровоточащих гастродуоденальных язв (КГДЯ). Набор ЭИ проводился на базе Воронежского городского специализированного Центра желудочно-кишечных кровотечений. Произведен анализ архива ЭИ за период 2021–2024 гг. Первоначально для анализа были отобраны 7 954 эндоскопических фотографии пациентов, прошедших эндоскопическое обследование верхних отделов желудочно-кишечного тракта. Все ЭИ были проанализированы с целью отбора фотографий КГДЯ. В результате отбора был сформирован набор предварительных данных из 764 ЭИ КГДЯ. Далее все эндоскопические фотографии с целью повышения релевантности данных и распределения по типам классификации J. Forrest были проанализированы 5 врачами-эндоскопистами высшей категории, имеющими опыт оказания медицинской помощи пациентам с ЯГДК более 5 лет.
В результате окончательной обработки данных был сформирован итоговый набор ЭИ, состоящий из 441 ЭИ КГДЯ, которые распределились по типам ЯГДК следующим образом: FIA – 40 изображений (9,07 %); FIB – 71 изображение (16,09 %); FIIA – 45 изображений (10,20 %); FIIB – 77 изображений (17,46 %); FIIC – 128 изображений (29,02 %); FIII – 80 изображений (18,14 %). Пример ЭИ КГДЯ из обучающего набора данных представлен на рисунке (рисунок 1).
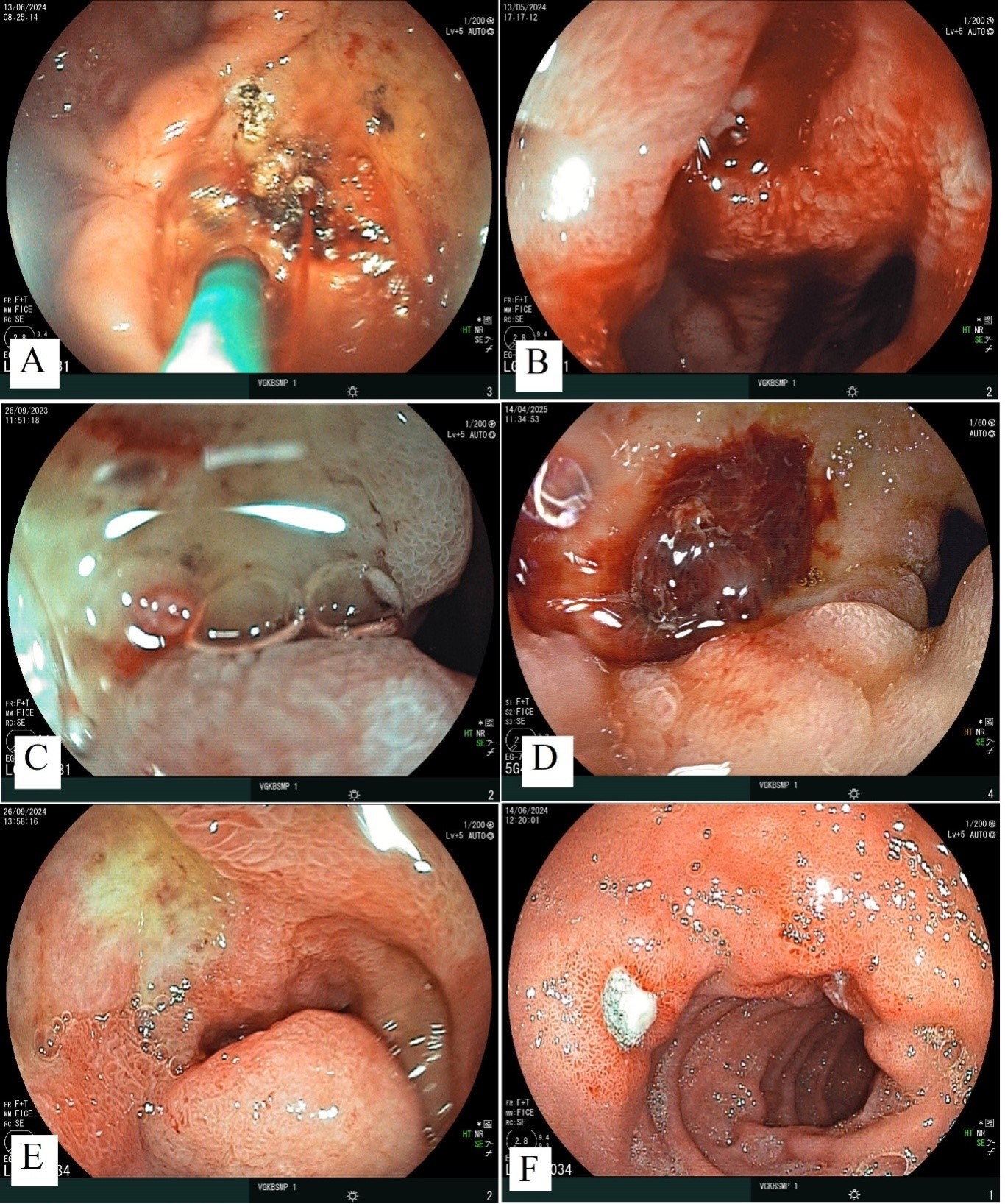
Рис. 1. Пример эндоскопических фотографий КГДЯ из обучающего набора данных: A – тип кровотечения FIA; B – тип кровотечения FIB; C – тип кровотечения FIIA; D – тип кровотечения FIIB; E – тип кровотечения FIIC; F – тип кровотечения FIII
Fig. 1. Example of endoscopic photographs of bleeding gastroduodenal ulcers (BGDU) from the training dataset: A – FIA type of bleeding; B – FIB type of bleeding; C – FIIA type of bleeding; D – FIIB type of bleeding; E – FIIC type of bleeding; F – FIII type of bleeding
Распределение ЭИ имело дисбаланс распределения классов: наиболее частым типом кровотечения был FIIC – 29,02 %, наименее представленным типом был FIA – 9,07 %, что было обусловлено различной частотой встречаемости типов ЯГДК по J. Forrest в клинической практике. На следующем этапе работы с ЭИ производили разметку изображений с выделением патологических структур, соответствующих различным типам ЯГДК (струйное кровотечение, тромбированный сосуд, сгусток крови, гематин, фибрин и др.), что отражено на рисунке 2. В результате обработки изображений было сформировано 2 набора данных: ЭИ без обработки и ЭИ с разметкой данных.
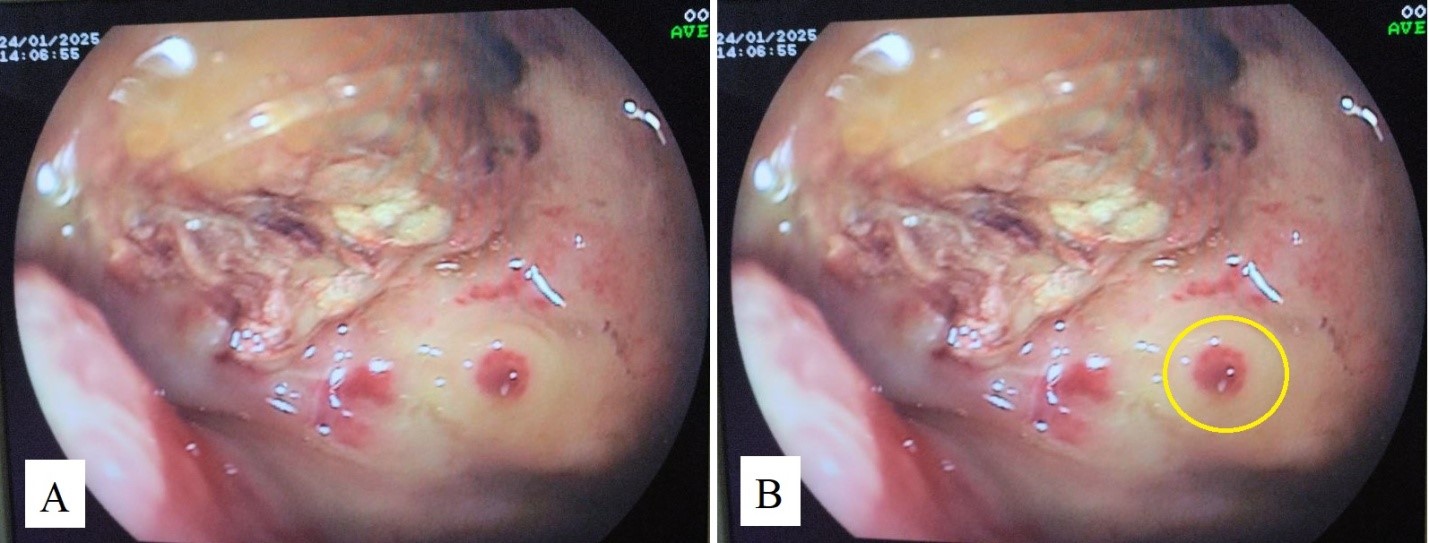
Рис. 2. Эндоскопических фотографий КГДЯ: A – до разметки патологических структур; B – после разметки (желтым кругом выделен тромбированный сосуд в дне КГДЯ)
Fig. 2. Endoscopic photographs of the BGDU: A – before marking the pathological structures; B – after marking (a yellow oval highlights a thrombosed vessel in the bottom of the BGDU)
Далее с целью оптимизации работы алгоритма МО со всех фотографий были удалены шумы и dicom-теги. Для их удаления использовалась обработка данных с применением генеративных диффузионных моделей stable-diffusion-2-inpainting (Stability AI) [Liu et al., 2025; Shen et al., 2025]. Для использования модели был использован Stable Diffusion web UI. Для наилучшей работы модели с ЭИ были выявлены следующие настройки: Mask blur – 4; Mask mode – inpaint masked; Masked content – fill; Inpaint area – only masked; Sampling steps – 5; Denoising strength – 0,65; Примеры обработанных Stable Diffusion изображений представлены на рисунке 3.
При обработке данных с использованием диффузионных моделей для каждого ЭИ была создана маска, которая накладывалась на все фотографии при помощи функции наложения одного изображения на другое с использованием высокоуровневого языка программирования Python. Входными параметрами были архив с ЭИ для обработки и файл наложения, а выходным параметром выступал новый архив с обработанными диффузионной моделью ЭИ.
В качестве альтернативного подхода рассматривался метод предобработки данных удалением, заключающийся в удалении всех изображений, содержащих существенные шумы и дефекты.
В качестве архитектуры машинного обучения для классификации ЭИ была выбрана нейросетевая модель EfficentNetB0, которая в процессе вычислительного эксперимента продемонстрировала наилучшую точность по сравнению с другими мобильными архитектурами (MobileNetV2, MobileNetV3). Модель EfficientNetB0 – это базовая архитектура сверхточной нейронной сети из семейства EfficientNet, известного своей высокой эффективностью.
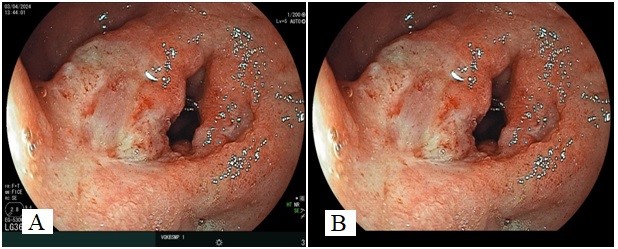
Рис. 3. Эндоскопические фотографии КГДЯ (FIIC): A – исходное изображение; B – после обработки с использованием генеративных диффузионных моделей Stable Diffusion
Fig. 3. Endoscopic photographs of BGDU (FIIC): A – initial image; B – after processing using Stable Diffusion generative diffusion models
Ее ключевое преимущество заключается в оригинальном подходе к масштабированию входного изображения, который равномерно и согласованно увеличивает его глубину, ширину и разрешение. Это позволяет достичь оптимального баланса между точностью и вычислительной эффективностью. В результате модель демонстрирует высокую точность распознавания изображений при значительно меньшем количестве параметров и более высокой скорости работы по сравнению с другими современными архитектурами, что делает ее идеальным решением для устройств с ограниченными ресурсами, таких как мобильные устройства. Для обучения моделей использовались открытая библиотека для МО TensorFlow (Google) и фреймворк для МО PyTorch. При обучении для повышения качества и устойчивости модели использовалась аугментация данных «на лету». Этот метод искусственно увеличивал объем тренировочной выборки за счет создания модифицированных версий изображений, что способствовало лучшему обобщению знаний и предотвращало переобучение моделей.
Для оценки эффективности модели МО использовались метрики точности: Accuracy – для оценки общей точности по 6 классам (формула 1), отражающая долю верных предсказаний модели; и Precision – для оценки точности по классам (формула 2), отражающая долю верных предсказаний класса, среди всех предсказаний этого класса.
(1) | |
(2) |
где TP (True Positive) – верно предсказанные принадлежности к классу (типу ЯГДК); FP (False Positive) – неверно предсказанные принадлежности к классу; TN (True Negative) – верно предсказанные отсутствия принадлежности к классу; FN (False Negative) – неверно предсказанные отсутствия принадлежности к классу.
Результаты исследования и их обсуждение
Модель EfficentNetB0 из библиотеки torchvision.models изначально предобучена для распознавания 1 000 выходных классов изображений (немедицинских) и имеет 1 000 выходов. Поэтому до начала обучения ее последний слой был модифицирован для адаптации под 6 классов. Далее возможны две стратегии обучения:
1. Обучение всех весов сети на имеющихся данных. Минус этого подхода в том, что данных в обучающей выборке не так много, а полная архитектура сети содержит слишком большое количество весов.
2. Заморозка всех весов сети, кроме весов последнего модифицированного слоя, и обучение только весов последнего слоя. Минус этого подхода в том, что для адаптации к обучающему набору данных будет использован только один слой сети.
Для определения наилучшей стратегии обучения было обучено 4 модели EfficentNetB0:
1. Модель классификации по 6 классам с предобработкой данных удалением без заморозки весов (то есть и их полной настройкой) (Модель-I).
2. Модель классификации по 6 классам с предобработкой данных удалением с заморозкой весов (для изменения весов доступен только последний слой) (Модель-II).
3. Модель классификации по 6 классам с предобработкой данных StableDiffusion без заморозки весов (Модель-III).
4. Модель классификации по 6 классам с предобработкой данных StableDiffusion с заморозкой весов (для изменения весов доступен только последний слой) (Модель-IV).
Для оценки эффективности распознавания типа ЯГДК модели EfficentNetB0 была использована тренировочная выборка из 70 % ЭИ из используемого набора данных, остальные 30 % ЭИ составили тестовую выборку. Графики обучения и матрица ошибок на тестовой выборке для всех моделей представлены на рисунках 4–11.
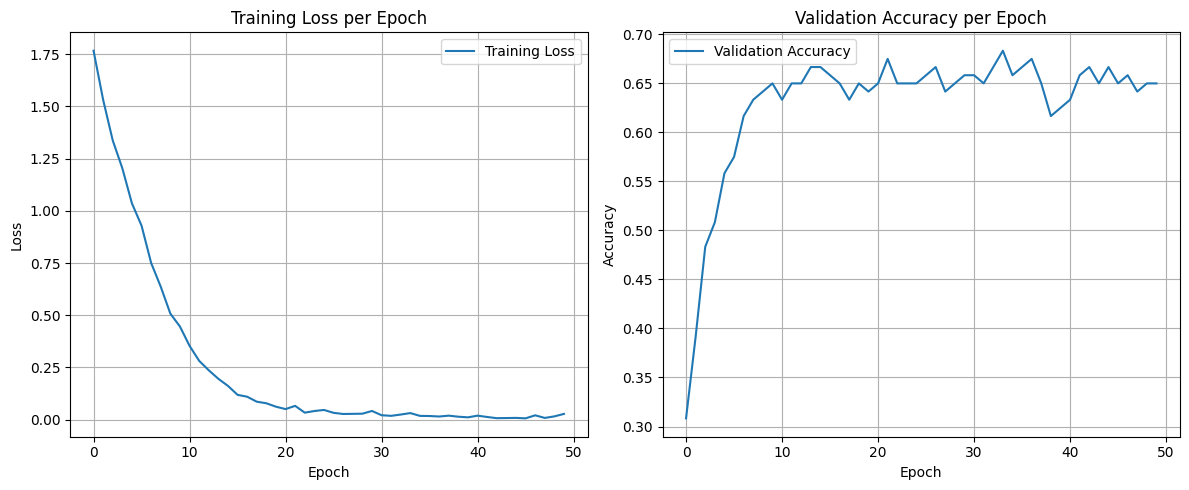
Рис. 4. Графики обучения модели EfficentNetB0 классификации по 6 классам с предобработкой данных удалением без заморозки весов
Fig. 4. Graph of the training of the EfficentNetB0 model for classification into six classes with data preprocessing by deleting weights without freezing
График на рисунке 4 демонстрирует динамику процесса обучения модели без замораживания весов и без применения генеративных диффузионных моделей для предобработки данных. Показаны кривая ошибок на тренировочном наборе (слева) и изменение метрики точности на тестовом наборе данных, позволяющие оценить стабильность и скорость обучения.
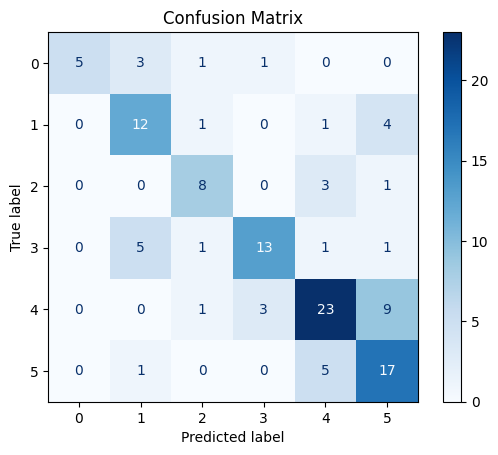
Рис. 5. Матрица ошибок на тестовых данных модели EfficentNetB0 классификации по 6 классам с предобработкой данных удалением без заморозки весов
Fig. 5. Matrix of errors of the EfficentNetB0model of classification into six classes with data preprocessing by deleting without freezing weights
На рисунке 5 представлена матрица ошибок (confusion matrix), иллюстрирующая результаты классификации тестового набора данных. Цветовые градации указывают на частоту правильных или ложных классификаций по каждому типу кровотечения. Из рисунка видно, насколько хорошо модель справлялась с каждым отдельным классом. На диагонали находится количество правильных предсказаний каждого класса на тестовых данных (не участвовавших в обучении и настройке модели). Здесь использованы следующие обозначения: 0 – это класс FIA; 1 – класс FIB; 2 – класс FIIA; 3 – класс FIIB; 4 – класс FIIC;
5 – класс FIII. Видно, что сильнее всего данная модель путает классы 4 и 5.
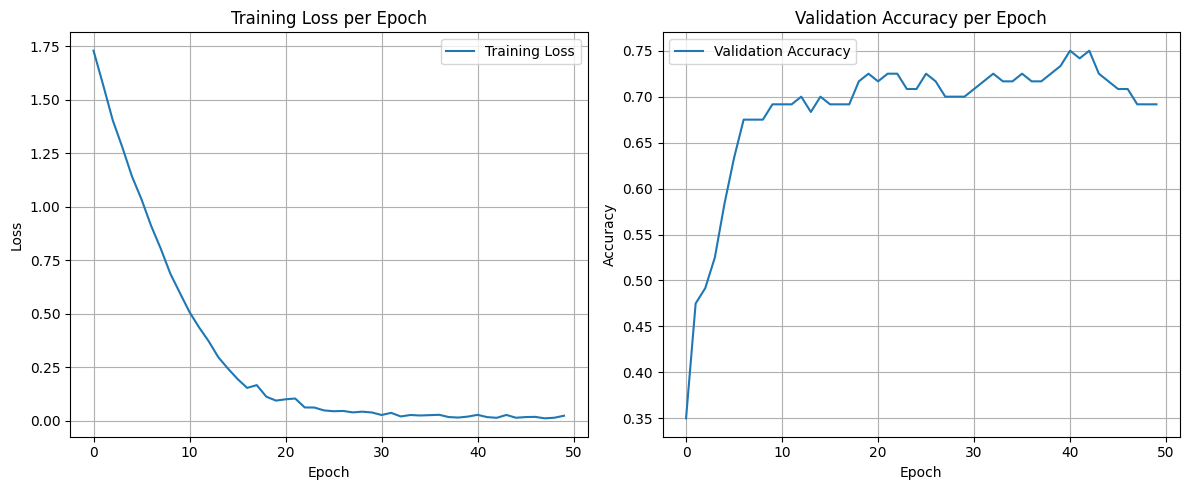
Рис. 6. Графики обучения модели EfficentNetB0 классификации по 6 классам с предобработкой данных удалением с заморозкой весов (для изменения весов доступен только последний слой)
Fig. 6. Graph of the training of the EfficentNetB0 model for classification into six classes with data preprocessing by deleting and freezing weights (only the last layer is available for changing weights)
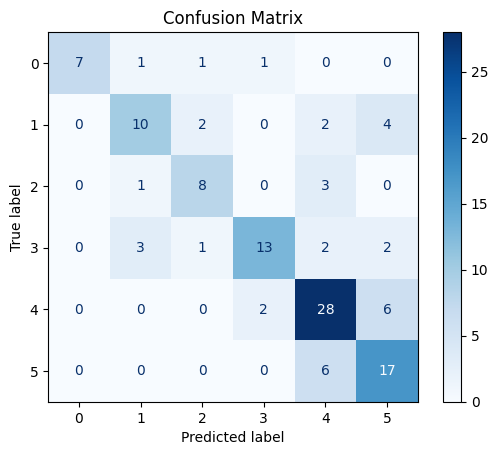
Рис. 7. Матрица ошибок на тестовых данных модели EfficentNetB0 классификации по 6 классам с предобработкой данных удалением с заморозкой весов (для изменения весов доступен только последний слой)
Fig. 7. Matrix of errors of the EfficentNetB0 model of classification into six classes with data preprocessing by deleting and freezing weights (only the last layer is available for changing weights)
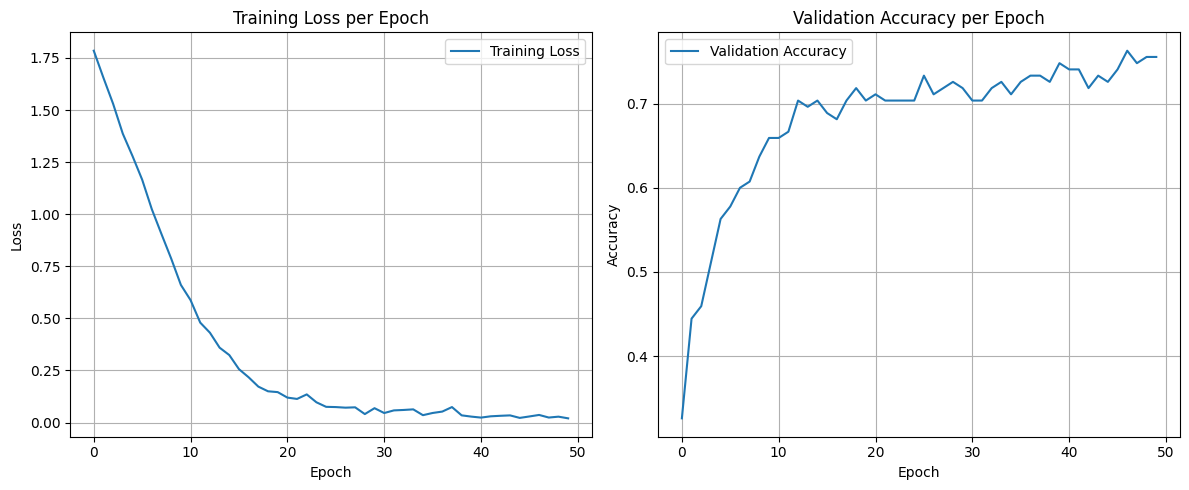
Рис. 8. Графики обучения модели EfficentNetB0 с предобработкой данных StableDiffusion без заморозки весов
Fig. 8. Graph of the Efficientnetb0 model training with StableDiffusion data preprocessing without freezing weights
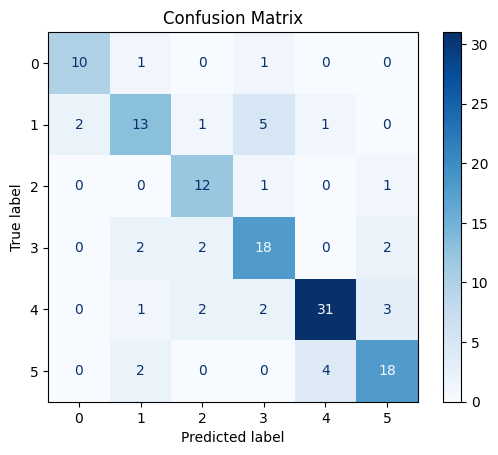
Рис. 9. Матрица ошибок на тестовых данных модели EfficentNetB0 с предобработкой данных StableDiffusion без заморозки весов
Fig. 9. Error matrix of the Efficientnetb0 model with preprocessing of StableDiffusion data without freezing weights
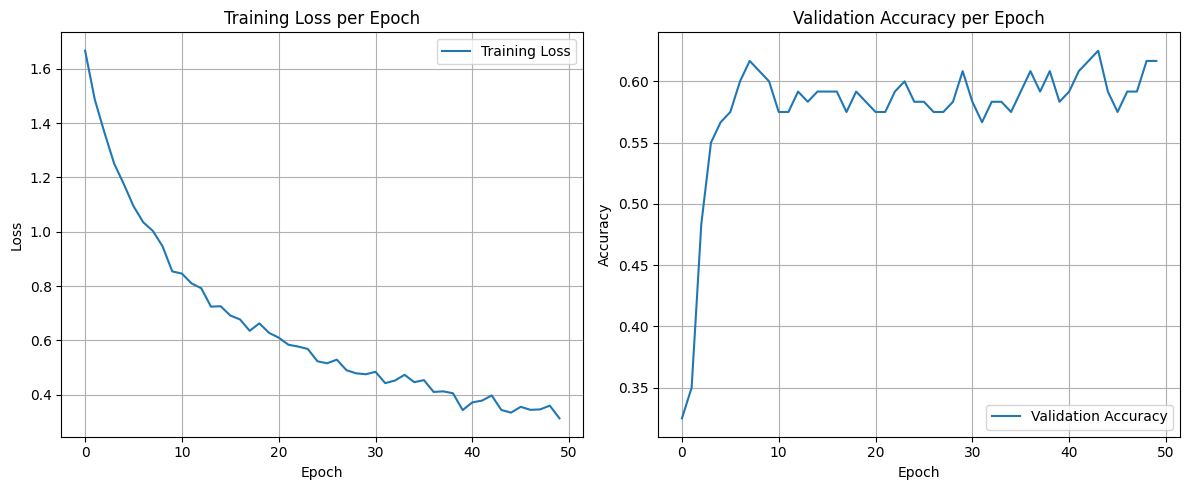
Рис. 10. Графики обучения модели EfficentNetB0 классификации по 6 классам с предобработкой данных StableDiffusion с заморозкой весов (для изменения весов доступен только последний слой)
Fig. 10. Graph of the training of the EfficentNetB0model of classification into six classes with preprocessing of StableDiffusion data with freezing of weights (only the last layer is available for changing weights)
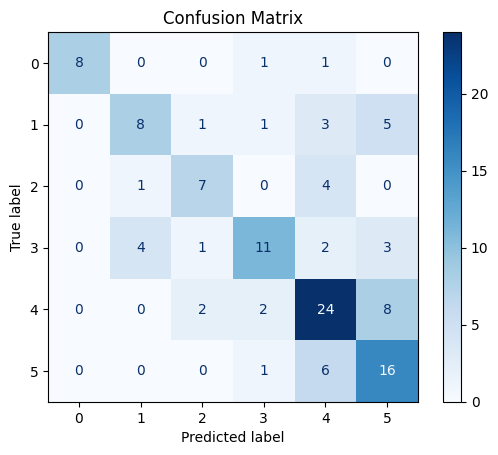
Рис. 11. Матрица ошибок на тестовых данных модели EfficentNetB0 классификации по 6 классам с предобработкой данных StableDiffusion с заморозкой весов (для изменения весов доступен только последний слой)
Fig. 11. Matrix of errors of the Efficientnetb0 model of classification into 6 classes with preprocessing of StableDiffusion data with freezing of weights (only the last layer is available for changing weights)
В таблице представлены результаты тестирования для каждой описанной модели с указанием точности на тестовом наборе как общей (Accuracy), так и для каждого отдельного класса (Precision). В тестовом наборе для ЭИ с предобработкой данных удалением содержится 120 изображений, для датасета с предобработкой данных StableDiffusion – 135 изображений.
Таблица
Table
Точность классификации моделей EfficentNetB0
Classification accuracy of EfficentNetB0 models
Вид модели EfficentNetB0 | Точность по типам ЯГДК по J.Forrest, 1974 | Общая точность для всех типов ЯГДК | |||||
FIA | FIB | FIIA | FIIB | FIIC | FIII | ||
Модель-I (%) | 100 | 57 | 67 | 76 | 70 | 53 | 65 |
Модель-II (%) | 100 | 67 | 67 | 81 | 68 | 59 | 69,17 |
Модель-III (%) | 83 | 68 | 71 | 67 | 86 | 75 | 75,56 |
Модель-IV (%) | 100 | 62 | 64 | 69 | 60 | 50 | 61,67 |
Как видно из данных таблицы, уровень точности различных моделей EfficentNetB0 при различных типах ЯГДК имел существенные отличия. Так, наилучший результат точности при типе кровотечения FIA показали модели I, II, III c уровнем точности классификации 100 %. Модель-III при данном типе кровотечения показала уровень точности 83 %. При типе кровотечения FIB уровень точности в моделях колебался от 57 % до 68 %. При этом наилучший показатель для FIB показала Модель-III – 68 % и Модель-II 67 %. Модели IV и I имели меньший уровень точности классификации для данного типа кровотечения в 62 % и 57 % соответственно. При типе кровотечения FIIA все модели показали примерно одинаковый уровень точности – 64–71 %, однако наилучший показатель был у Модели-III – 71 %. Для FIIB модели показали точность классификации от 67 % до 81 %, при этом наилучший показатель точности для FIIB показали Модель-II – 81 % и Модель-I – 76 %. При кровотечении FIIC точность классификации моделей составила от 60 % до 86 %, наилучший показатель 86 % для FIIC показала Модель-III. Для FIII размах точности моделей был от 50 % до 75 %. Для данного класса кровотечения наилучший показатель 75 % также показала Модель-III. По общей точности наилучшей оказалась Модель-III – 75,56 %. При комплексной оценке изученных моделей в качестве наиболее точной и показывающей стабильные результаты была Модель-III с предобработкой SD без заморозки весов. На данную модель МО получено свидетельство о государственной регистрации программы для ЭВМ № 2025681146 [Каширина и др., 2025].
С целью практического применения разработанной нейросетевой классификации ЯГДК по ЭИ Модель-III с предобработкой SD без заморозки весов была интегрирована в мобильное приложение (МПВР) для принятия врачебных решений «Эндоскопический гемостаз язвенного гастродуоденального кровотечения»» (Свидетельство о государственной регистрации программы для ЭВМ № 2024680004) [Баранников и др., 2025]. Стартовое окно данного МПВР представлено на рисунке 12А.
Для загрузки модели МО в МПВР была реализована функция load Model From Assets, позволяющая загружать модель и ее веса из директории assets. При помощи библиотек expo-image-picker и expo-file-system был реализован экран Camera Screen, который предлагает пользователю выбор источника ЭИ (рисунок 12B): сделать фото или выбрать из галереи. При открытии экрана загружается модель, пользователь выбирает способ загрузки ЭИ в МП. ЭИ отображается под кнопками, полученное изображение отправляется на обработку, предсказанный тип кровотечения отображается под самим изображением (рисунок 12C).
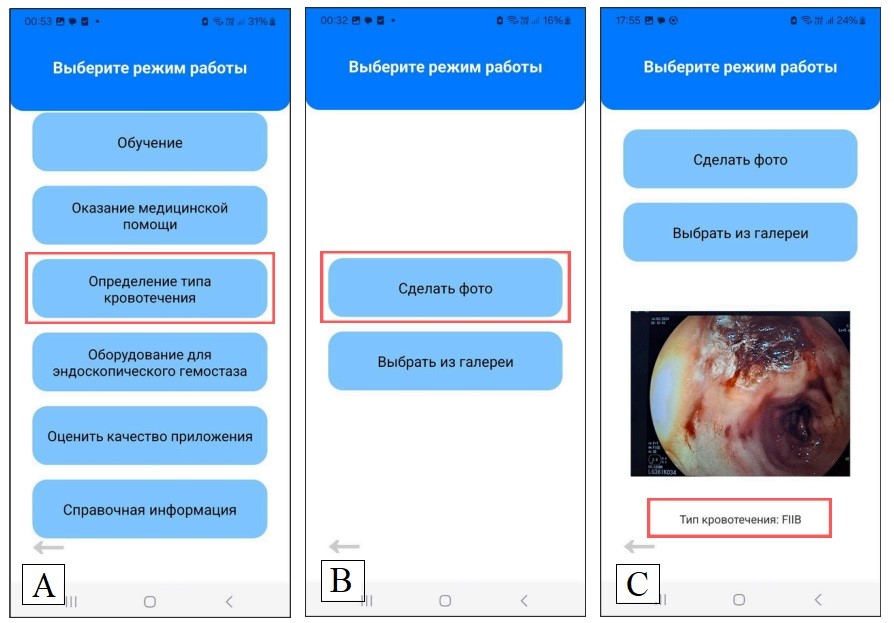
Рис. 12. Окна мобильного приложения «Экспертная цифровая система поддержки принятия врачебных решений «Эндоскопический гемостаз язвенного гастродуоденального кровотечения»»: А – стартовое окно; B – окно определения типа кровотечения; C – окно результата предсказания типа кровотечения
Fig. 12. Windows of the mobile application “E xpert digital medical decision support system "Endoscopic hemostasis of ulcerative gastroduodenal bleeding”: A – Start window; B – window for determining the type of bleeding; C – window for predicting the type of bleeding
Заключение
Таким образом, в ходе проведенного исследования была впервые разработана модель машинного обучения, предназначенная для автоматизированной классификации типа язвенного гастродуоденального кровотечения по эндоскопическим изображениям в соответствии с классификацией J. Forrest. Наилучший результат показала модель на основе архитектуры EfficientNetB0, использующая предобработку данных с помощью генеративных диффузионных моделей (Stable Diffusion) и обученная с полной настройкой всех весов сети. Продемонстрированная общая точность модели на тестовой выборке составила 75,56 %, что является конкурентоспособным результатом для задачи многоклассовой классификации в условиях ограниченного и несбалансированного набора данных.
Практическая значимость работы подтверждается успешной интеграцией разработанного алгоритма в мобильное приложение – экспертную систему поддержки принятия врачебных решений. Это создает предпосылки для его использования в реальной клинической практике в качестве вспомогательного инструмента, способного снизить субъективность эндоскопической диагностики, особенно врачами с недостаточным опытом, и минимизировать ошибки в определении тактики лечения.
Основные научно-практические результаты исследования заключаются в следующем.
1. Создан специализированный размеченный датасет эндоскопических изображений ЯГДК, адаптированный для обучения нейросетевых моделей и соответствующий требованиям медицинского сообщества.
2. Апробирована и сравнена методология предобработки изображений, включая использование генеративных нейросетевых моделей для удаления шумов и артефактов, что доказало свою эффективность для повышения точности классификации.
3. Экспериментально обоснован выбор архитектуры и стратегии обучения (EfficientNetB0 с полным обучением), обеспечивающей оптимальный баланс между точностью и вычислительной эффективностью для развертывания на мобильных устройствах.
Перспективы дальнейших исследований видятся в следующих направлениях: увеличение объема и диверсификация обучающей выборки для улучшения обобщающей способности модели; применение методов балансировки классов для повышения точности распознавания редко встречающихся типов кровотечений.
Внедрение разработанного решения в клиническую практику открывает путь к стандартизации диагностики язвенных кровотечений, повышению доступности квалифицированной эндоскопической оценки и, как следствие, к улучшению качества оказания медицинской помощи пациентам с данной жизнеугрожающей патологией.
Thanks
Funding: the work was carried out with the funds of the Grant of the President of the Russian Federation for state support of young Russian scientists – Candidates of Sciences Grant No. MK-1069.2020.7 (MK-2020 Competition) and the award of the Government of the Voronezh Region among young scientists (Decree of the Government of the Voronezh Region 18.12.2023, No. 924).


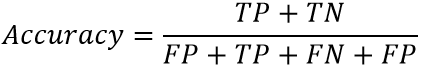
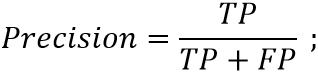



Reference lists
Barannikov S.V., Cherednikov E.F., Banin I.N, Sudakov D.V., Bavykina I.A. 2025. Mobile Application «Prevention of Gastroduodenal Bleeding: An Individualized Risk Assessment Scheme, the Formation of Recommendations on Patient Management Tactics». Challenges in Modern Medicine, 48(3): 390–398 (in Russian). doi: 10.52575/2687-0940-2025-48-3-390-398
Barannikov S.V., Cherednikov E.F., Banin I.N., Choporov O.N., Sudakov D.V., Bolkhovitinov A.E., Kashirina I.L, Vorotilina A.I. 2025. Mobile Application: Expert Digital Medical Decision Support System «Endoscopic Hemostasis of Ulcerative Gastroduodenal Bleeding» Humans and their Health, 28(1): 21–30 (in Russian). doi: 10.21626/vestnik/2025-1/03
Bedin V.V., Korzheva I.Yu., Vlasenko A.V., Mikhailyants G.S., Turkan V.A., Bocharnikov D.S., Sokolov K.A. 2025. Ulcerative Gastroduodenal Bleeding with a High Risk of Recurrence. Treatment Tactics. Moscow Surgical Journal, (2): 200–212 (in Russian). doi: 10.17238/2072-3180-2025-2-200-212
Bezaltynykh E.D., Bezaltynykh V.A., Zebzeev A.A. 2025. Analysis of the Prevalence of Complications of Gastric Ulcer. Smolenskiy Medical Almanac, 1–2: 19–21 (in Russian). doi: 10.37903/SMA.2025.1.53
Hasanov A.F., Galikhanov R.I., Akhmarov N.V., Babayeva G., Maslyaninova A.E. 2025. The Role of Endoscopy in the Diagnosis and Treatment of Gastrointestinal Bleeding. International Scientific Research Journal, 3(153) (in Russian). doi: 10.60797/IRJ.2025.153.55
Heinrich S.R., Durleshter V.M., Kalachev A.G., Bedanokov K.M. 2025. Choosing the Optimal Surgical Method for Duodenal Ulcer Complicated by Bleeding. Pirogov Russian Journal of Surgery, 2:111 118 (in Russian). doi: 10.17116/hirurgia2025021111
Ivashkin V.Т., Mayev I.V., Tsarkov Р.V., Korolev М.Р., Andreev D.N., Baranskaya Е.К., Bordin D.S., Burkov S.G., Derinov А.А., Efetov S.К., Lapina Т.L., Pavlov Р.V., Pirogov S.S., Poluektova Е.А., Tkachev А.V., Trukhmanov А.S., Uljanin А.I., Fedorov Е.D., Sheptulin А.А. 2024. Diagnostics and Treatment of Peptic Ulcer in Adults (Clinical Guidelines of the Russian Gastroenterological Association, the Russian Society of Colorectal Surgeons, the Russian Endoscopic Society and the Scientific Society for the Clinical Study of Human Microbiome). Russian Journal of Gastroenterology, Hepatology, Coloproctology, 34(2): 101–131 (in Russian). doi: 10.22416/1382-4376-2024-34-2-101-131
Kashirina I.L., Vorotilina A.I., Barannikov S.V., Cherednikov E.F., Choporov O.N. 2025. Neural Network Classification of the Type of Ulcerative Gastroduodenal Bleeding According to Endoscopic Images. Certificate of State Registration of the Computer Program N 2025681146 (in Russian).
Revishvili A.Sh., Olovyannyj V.E., Gogiya B.Sh., Ruchkin D.V., Markov P.V., Gurmikov B.N., Mamoshin A.V., Chililov A.M., Kuznecov A.V., Shelina N.V. 2025. Surgical Care in the Russian Federation, Moscow: 192 (in Russian).
Sheptulin A.A., Rabotyagova Y.S. 2025. Etiological Factors and Peculiarities of Diff Erential Diagnosis of Multiple Gastric Ulcers. Clinical Medicine (Russian Journal), 03(3): 223–227 (in Russian). doi: 10.30629/0023-2149-2025-103-3-223-227
Alhajlah M., Noor M.N., Nazir M., Mahmood A., Ashra, I., Karamat T. 2023. Gastrointestinal Diseases Classification using Deep Transfer Learning and Features Optimization. Comput. Mater. Contin, 75(1), 2227–2245. doi: 10.32604/cmc.2023.031890
Bindra S., Jain R. 2024. Artificial Intelligence in Medical Science: A Review. Ir J Med Sci.,193(3): 1419–1429. doi: 10.1007/s11845-023-03570-9
Borgli H., Thambawita V., Smedsrud P.H., Hicks S., Jha D., Eskeland S.L., Randel K.R., Pogorelov K., Lux M., Nguyen D.T.D., Johansen D., Griwodz C., Stensland H.K., Garcia-Ceja E., Schmid, P.T., Hammer H.L., Riegler M. A., Halvorsen P., de Lange T. 2020. HyperKvasir, a Comprehensive Multi-Class Image and Video Dataset for Gastrointestinal Endoscopy. Scientific data, 7(1), 283. doi: 10.1038/s41597-020-00622-y
Cherednikov E.F., Barannikov S.V., Yuzefovich I.S., Chernykh A.V., Berezhnova T.A., Polubkova G.V., Banin I.N., Maleev Yu.V., Ovsyannikov E.S., Shkurina I.A. 2022. Modern Technologies of Endoscopic Hemostasis in the Treatment of Ulcer Gastroduodenal Bleeding: A Literature Review. International Journal of Biomedicine, 12(1): 9–18. doi: 10.21103/Article12(1)_RA1
Liu Y., Jiang T., Li R., Yuan L., Grzegorzek M., Li C., Li X. 2025. A State of the Art Review of Diffusion Model Applications for Microscopic Image and Micro-Alike Image Analysis. Frontiers in Medicine, 12: 1551894. doi: 10.3389/fmed.2025.1551894
Lobanovs S., Aleksejeva J., Rūtiņa A. K., Krustiņš E., Čižovs, J., Bļizņuks D. 2025. Machine Learning in Gastrointestinal Endoscopy: Challenges and Opportunities. BMJ Open Gastroenterology, 12(1): e001923. doi: 10.1136/bmjgast-2025-001923
Shen H., Zhang, J., Xiong, B., Hu, R., Chen, S., Wan, Z., Wang, X., Zhang, Y., Gong, Z., Bao, G. 2025. Efficient Diffusion Models: A Survey. Transactions on Machine Learning Research (TMLR). doi: 10.48550/arXiv.2502.06805
Shung D.L. Advancing Care for Acute Gastrointestinal Bleeding using Artificial Intelligence. 2021 Journal of Gastroenterology and Hepatology, 36(5): 273–278. doi: 10.1111/jgh.15372
Tasci B., Dogan S., Tuncer T. 2025. Artificial Intelligence in Gastrointestinal Surgery: A Systematic Review. World J Gastrointest Surg., 17(8): 109463. doi:10.4240/wjgs.v17.i8.109463
Yen H.H., Wu P.Y., Chen M.F., Lin W.C., Tsai C.L., Lin K.P. 2021. Current Status and Future Perspective of Artificial Intelligence in the Management of Peptic Ulcer Bleeding: A Review of Recent Literature. Journal of Clinical Medicine, 10(16), 3527. doi: 10.3390/jcm10163527