Clinical Manifestations of Post-COVID Syndrome and the Role of Genes in their Development in Patients with Arterial Hypertension and Obesity
Annotation
Though arterial hypertension (AH) and obesity (O) exacerbate the course of acute respiratory syndrome coronavirus 2 (SARS-CoV-2), their contribution to the development of post-COVID syndrome has been insufficiently studied. The aim of this review was to explore published scientific data with a view to identifying clinical syndromes and symptoms, as well as genes and their polymorphisms, underlying post-COVID syndrome in patients with AH and O. Materials and methods. A search for and evaluation of bibliographic databases (Pubmed, Scopus, Google Scholar, eLibrary.ru) for the past 5 years of observations was conducted, reflecting both the main complaints of patients with post-COVID syndrome and the current understanding of the influence produced by gene polymorphisms on the development of post-COVID syndrome in patients with AH and O. Based on the results, the main clinical syndromes and symptoms in patients with AH and O were identified, and their development mechanisms were proposed. Genes responsible for the course of long COVID in patients with AH and O include АроЕ- ꜫ4, АСЕ2, F2 и F5, AGT, AHSG, TNF. Therefore, studying the functional effects of the identified gene polymorphisms and their contribution to the development and maintenance of the main syndromes of post-COVID syndrome in patients with AH and O will help prevent the development of post-COVID syndrome and implement various preventive strategies and therapeutic approaches.
Keywords: COVID-19, post-COVID syndrome, arterial hypertension, obesity, comorbidity, gene polymorphism, genetics, single nucleotide polymorphism
Unfortunately, the article is available only in Russian
Введение
В октябре 2020 года Национальный Институт здоровья Великобритании (National Institute for Health and Care Excellence (NICE) в своих рекомендациях определил постковидный синдром (пост-COVID синдром) как состояние, сохраняющееся в течение трех месяцев после вероятного или подтверждённого заражения инфекцией тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2, severe acute respiratory syndrome-related coronavirus-2) в анамнезе, длящееся не менее двух месяцев с ограничением повседневного функционирования организма и которое не может быть объяснено альтернативными диагнозами [Soriano et al., 2022]. По результатам международного регистра «АКТИВ» на 2023 год у 18,01 % пациентов, перенёсших коронавирусное заболевание 2019 (COVID-19), в течение последующих 12 месяцев были зарегистрированы вновь диагностированные заболевания. В структуре преобладали артериальная гипертония (АГ), сахарный диабет 2 типа и ишемическая болезнь сердца [Арутюнов и др., 2023]. Наиболее распространенными симптомами пост-COVID синдрома являлись усталость, головная боль, бессонница, проблемы с концентрацией внимания, боли в мышцах и суставах и кашель; однако многогранный долгосрочный клинический эффект последствий COVID-19 остается в значительной степени неясным [Soriano et al., 2022; Арутюнов и др., 2023; Nalbandian et al., 2021; Kuodi et al., 2023]. Изучение наиболее частых клинических симптомов постковидного синдрома у пациентов с артериальной гипертонией в сочетании с ожирением сразу после COVID-19, а также выявление ассоциированных с пост-COVID синдромом полиморфизмов генов является актуальным и малоисследованным вопросом. Поэтому этот обзор направлен на представление последних научных отчетов, которые оценивают клинические проявления постковидного синдрома у больных с артериальной гипертонией и ожирением, патогенез развития этих нарушений и их взаимосвязь с выявленными ассоциациями полиморфизмов генов.
Целью данного обзора явилось выделение из опубликованных научных данных клинических синдромов и симптомов, а также генов и их полиморфизмов, лежащих в основе постковидного синдрома у пациентов с АГ в сочетании с ожирением.
Материалы и методы
Электронный поиск статей, опубликованных за последние 5 лет в базах данных MEDLINE, PubMed, Google Scholar, Scopus и eLIBRARY, был проведен тремя разными авторами с использованием следующих поисковых терминов: COVID-19 или SARS-CoV-2; post-COVID syndrome, или post-acute COVID-19 syndrome, или long-COVID, или post-acute COVID, или post-COVID-19 condition; arterial hypertension; obesity; comorbidity; gene polymorphism; genetics; single nucleotide polymorphism.
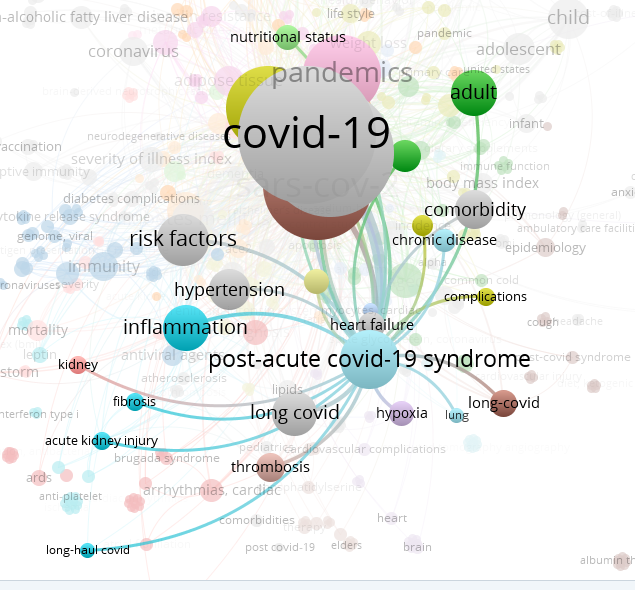
Визуализация поисковых связей при пост-СOVID синдроме
Visualization of search connections in post-COVID syndrome
Применялись для поиска комбинации этих поисковых терминов на русском и английском языках, описывающих связь между изменениями со стороны различных систем организма и перенесенной ковид-ассоциированной пневмонии, а также связь между полиморфизмом генов и постковидным синдромом у больных с артериальной гипертонией и ожирением у взрослых. Визуализация поисковых связей представлена на рисунке, на котором видно, что самый большой интерес в поисковой системе занимает сам термин «COVID-19», затем «post-acute covid-19 syndrome», который значимо связан с воспалением, артериальной гипертензией, коморбидностью и в меньшей степени с ожирением.
Результаты и их обсуждение
Клинические проявления постковидного синдрома у пациентов с артериальной гипертензией и ожирением
Пятилетний анализ наблюдения за пациентами, перенесшими ковидную инфекцию, показал, что пост-COVID синдром характеризуется широким спектром симптомов, охватывающих многие системы органов. Нами были отобраны основные чаще всего встречающиеся синдромы у пациентов с АГ в сочетании с ожирением (АГиО) [Nalbandian et al., 2021; Abdulan et al., 2023].
1. Легочный синдром или синдром дыхательной недостаточности. Этот синдром, по данным многих исследователей, наблюдался в отдаленном периоде наиболее часто в виде одышки различной степени выраженности. В большой выборке пациентов (> 40 тыс.) она встречалась в 41 % случаев; чаще выявлялась у лиц мужского пола и у тех, кто перенес тяжелую острую инфекцию [Pillay et al., 2022]. Авторы объясняют ее продолжительное сохранение у лиц, перенесших ковид-19 инфекцию, остаточными изменениями в легких в виде фиброза и сердечно-сосудистой дисфункцией, которая усугублялась выработкой цитокинов при ожирении [Благов и др., 2022].
2. Гематологический синдром. В ретроспективных исследованиях было отмечено, что тромбоэмболические осложнения пост-COVID синдрома составляют < 5 %; на наш взгляд, в перспективе они требуют особого изучения. У пациентов через 4 месяца после острой вирусной инфекции описаны гиперкоагуляционные и гипофибринолитические состояния, связанные со стойким повышением уровней D-димера, фактора VIII, ингибитора активатора плазминогена-1, фактора Виллебранда и маркеров активации эндотелия [Wójcik et al., 2023].
3. Сердечно-сосудистый синдром. Описанные отдаленные постоянные симптомы включали учащенное сердцебиение (9,7 %), боли в груди (7,3 %) и аритмии (6,1 %) [Kuodi et al., 2023].
К основным механизмам развития таких проявлений у пациентов с АГиО при пост-COVID синдроме можно отнести стойкое воспаление, связанное с сохранением вируса в кардиомиоцитах, а также дисфункцию эндотелия за счет выработки активных форм кислорода и разрушения синтетазы оксида азота [Raman et al., 2022; Georgieva et al., 2023]. Хроническая воспалительная реакция способна усугубляться связанной с ожирением воспалительной передачей сигналов, частично управляемой периваскулярной жировой тканью через высвобождение адипокинов, таких как хемоаттрактантный протеин-1, Т-клеточные хемокины, которые усугубляют эндотелиальную дисфункцию. Последствием таких процессов может стать скрытое повреждение миокарда с его фиброзом, приводящим к нарушению податливости желудочков, ухудшению перфузии миокарда, повышению жесткости миокарда, снижению сократительной способности и формированию потенциального аритмогенного субстрата [Kim et al., 2019].
Другим предполагаемым механизмом повреждения сердечно-сосудистой системы при пост-COVID синдроме является аутоиммунный ответ на сердечные антигены посредством молекулярной мимикрии; некоторые исследования выявили формирование аутоантител к холинергическим и адренергическим рецепторам, которые еще больше усугубляют течение артериальной гипертонии [Blagova et al., 2021].
Роль рецепторов ангиотензинпревращающего фермента 2 (ACE2) в поражении сердца при SARS-CoV-2 в настоящее время хорошо установлена. Повреждению миокарда способствует прямое цитотоксическое воздействие, нарушение регуляции ренин-ангиотензин-альдостероновой системы (РААС), эндотелиит, тромбообразование и нарушение регуляции иммунного ответа с высвобождением цитокинов [Raman et al., 2022; Abdulan et al., 2023; Kuodi et al., 2023].
В проведённом в США исследовании было выявлено, что через год после заражения выздоровевшие пациенты подвергаются повышенному риску развития фибрилляции предсердий, ишемической болезни сердца, миокардита, сердечной недостаточности, тромбоэмболическим осложнениям [Kuodi et al., 2023].
4. Психоневрологический и когнитивный синдром. По результатам метаанализа 19 исследований [Premraj et al., 2022], было выявлена следующая распространенность этих симптомов (выборка более 11 тыс. пациентов): усталость (37 %); «затуманивание мозга» (32 %); нарушение памяти (27 %); снижение концентрации внимания (22 %); миалгии (18 %); аносмия (12 %); дисгевзия (11 %); головная боль (10 %).
Точные причины и механизмы развития когнитивных нарушений остаются не выясненными. Есть предположения о прямой инвазии вирусными частицами нейронов, системном воспалении, которое также сочетается с системным воспалением у пациентов с ожирением, а также глубоком гипоксическом воздействии на центральную нервную систему у пациентов при искусственной вентиляции легких [Morin et al., 2021; Writing Committee…, 2021].
Нарушение обоняния и вкуса встречались в 56–86 % случаев, преимущественно у пациентов с умеренно тяжелыми формами заболевания. По результатам исследований, у 86 % и 96 % пациентов обоняние и вкус восстановились к 1 и 3 месяцам соответственно [Lechien et al., 2021].
5. Почечный синдром. Всё больше исследователей говорят о снижении функции почек (скорости клубочковой фильтрации) в период наблюдения от 6 до 12 месяцев, даже у тех пациентов, которые не имели признаков острого поражения почек во время разгара SARS-CoV-2. Среди основных объяснений механизма постострого поражения паренхимы почек можно предположить повреждение канальцев и эндотелия, подоцитов, связанное с системным воспалением и высвобождением цитокинов, а также активацию комплемента [Copur et al., 2022].
6. Эндокринный синдром. Практически все авторы отмечают усугубление течения существующих эндокринных заболеваний, в том числе и сахарного диабета. Показано, что через 2 месяца после острой стадии инфекции у пациентов, страдающих сахарным диабетом, инсулинорезистентность и гиперстимуляция β-клеток поджелудочной железы сохранялись на протяжении всего этого срока [Montefusco et al., 2021], что, в свою очередь, приводило к еще большему отложению висцеральной жировой ткани и усугублению воспалительной реакции, утяжелению гипертонии.
7. Желудочно-кишечный синдром. COVID-19 способен потенциально изменить микробиом кишечника, включая активное развитие условно-патогенных микроорганизмов, которые потенциально оказывают негативное влияние на развитие метаболического синдрома [Абдулгани и др., 2021]. К частым проявлениям, описанным в научной литературе, можно отнести боли в животе (14 %), тошноту (6 %), диарею (10 %), диспепсию (20 %) и синдром раздраженного кишечника (17 %) [Choudhury et al., 2022].
Генетические аспекты постковидного синдрома у лиц с артериальной гипертензией и ожирением
В настоящее время остается открытым вопрос о роли генов человека в развитии и степени выраженности тех или иных симптомов постковидного синдрома, у пациентов с коморбидными состояниями. Основные проводимые до сих пор исследования затрагивали изучение связи полиморфизма генов человека и вероятности инфицирования и тяжести течения острой коронавирусной инфекции [Беляков и др., 2021]. Мы в своей работе уделили внимание изучению связи полиморфизма генов у пациентов с АГиО на вероятность развития и степень выраженности постковидного синдрома.
Вирусные механизмы инфицирования SARS-CoV-2 предполагают, что генетические факторы играют существенную роль формировании реакции хозяина [Glotov et al., 2021].
Было выявлено, что генетические вариации, такие как однонуклеотидные полиморфизмы (SNP), вовлечены в процесс вирусной инфекции на разных уровнях, затрагивая гены, регулирующие вирусный патогенез и пути иммунного ответа, инициируемые вирусом в клетках-мишенях хозяина. В нескольких исследованиях были идентифицированы гены, участвующие в пути проникновения вируса SARS-CoV-2, такие как поверхностный рецептор ангиотензинпревращающего фермента 2 (ACE2) и рецептор трансмембранной протеазы серин-2 (TMPRSS2), а также ген аполипротеин Е (АроЕ) [Ferreira de Araújo et al., 2022].
Для рассматриваемых нами состояний у больных с постковидным синдромом (артериальная гипертензия, сердечная недостаточность, ожирение, сахарный диабет) в найденных источниках литературы описаны основные выявленные гены: АРОА1 – находится в 11 хромосоме, участвует в транспорте липопротеидов высокой плотности; АРОЕ – 19 хромосома, отвечает за транспорт липопротеидов низкой плотности; CTLA4 – отвечает за иммунные реакции, за счет влияния на цитотоксические Т-лимфоциты; НМОХ1 – 22 хромосома, участвует в расщеплении гема путем активации гемоксигеназы 1; F5 – расположен в 1 хромосоме, регулирует проакцелерин (V фактор); F2 – 11 хромосома, влияет на протромбин; В2М – 15 хромосома, участвует в комплексе гистосовместимости; STAT3 – 17 хромосома, регулирует выработку интерлейкинов и факторов роста [Беляков и др., 2021].
Ген ApoE кодирует белок, участвующий в обмене холестерина, а его вариации, влияющие на метаболизм, могут способствовать увеличению вероятности возникновения и усугубления течения артериальной гипертензии у пациентов с ожирением [Zhao et al., 2021].
Существует три основных аллельных варианта гена АроЕ (АроЕ- ꜫ2; АроЕ- ꜫ3; АроЕ- ꜫ4), определяемые двумя однонуклеотидными полиморфизмами (SNP), rs429358 и rs7412. В проведенных метаанализах было выявлено, что генотип АроЕ- ꜫ4 был связан с высоким риском заражения SARS-CoV-2 и тяжелым течением заболевания [Dieter et al., 2022].
Поскольку полиморфизмы ACE2, TMPRSS2 потенциально связаны с тяжестью заболевания COVID-19 [Ravikanth et al., 2021], имелось предположение, что их полиморфизмы, а также полиморфизмы гена АроЕ могут быть вовлечены в развитие симптомов в постковидном периоде. Результаты не выявили общей связи между исследованными SNP (АСЕ2 rs2285666, ACE2 rs2074192, TMPRSS2 rs12329760, TMPRSS2 rs2070788) и наличием симптоматики в отдаленном периоде после перенесенной вирусной инфекции у госпитализированных выживших, что может быть объяснено генетической изменчивостью и значительной вариабельностью генов, а также тем, что сопутствующие заболевания также связаны с генотипом АроЕ. Развитие артериальной гипертензии в постковидном периоде может быть объяснено экспрессией гена АСЕ2 и выработкой кодируемого им белка ангиотензинпревращающего фермента 2, который участвует в повреждении и дисфункции эндотелия путем активации РААС при SARS-CоV-2. Происходит процесс изменения эластичности артериальной стенки из-за снижения расслабления гладкомышечных клеток и нарушения структуры артериальной стенки, развитие барорефлекторной дисфункции из-за ригидности стенок артерий [Vyas et al., 2023].
Ген ACE1 с генотипом DD связан с повышенным риском развития многих заболеваний у взрослых, таких как гипертония, инфаркт миокарда, ишемическая болезнь сердца, астма, сахарный диабет, за счет своего влияния на каскад РААС. Пациенты с несколькими сопутствующими заболеваниями испытывали более выраженные симптомы COVID-19 и его последствия, чем пациенты без генотипа АСЕ1 DD [Faustine et al., 2023].
Ген AGT кодирует предшественника ангиотензина. Фенотипы этого гена связаны с риском тяжелого течения артериальной гипертонии и сердечной недостаточности [Xu et al., 2021]. AGT rs699 SNP является звеном в прогнозировании исходов COVID-19, влияет на развитие симптомов сердечно-сосудистых заболеваний и метаболического синдрома в постковидном периоде [Cafiero et al., 2021].
Значимую роль в утяжелении течения артериальной гипертензии при пост-COVID19 синдроме играют гены, ответственные за свертывающую систему крови. Ген F2 кодирует протомбин. Полиморфизмы F2 rs1799963 и rs3136516 связаны с увеличением уровня протромбина и риском развития тромботических осложнений, связанных с COVID-19 в остром периоде заболевания и после перенесенной инфекции. Ген фактора свертывания V F5 участвует в регуляции проакцелерина [Xu et al., 2021].
При ожирении и инсулинорезистентности определяются высокие уровни фетуина-А, который кодируется в гене AHSG. В жировой ткани фетуин-А ингибирует экспрессию адипонектина, усиливает воспаление и инактивирует макрофаги. Была установлена ассоциация SNP: rs2248690, rs4917 в гене AHSG. Следовательно, экспрессия гена AHSG приводит к усугублению артериальной гипертензии из-за развития воспалительной реакции и к снижению адипонектина [Xu et al., 2021].
В проведенном исследовании Fishchuk L., Rossokha Z. et al. рассматривалась вероятность влияния экспрессии генов TNF-α (rs1800629), IL-6 (rs1800795) и VDR (rs731236 и rs1544410) на тяжесть течения и последствия COVID-19. Увеличение частоты генотипа СС и аллеля С гена IL-6, гетерозиготных генотипов ТС и GA гена VDR, а также rs1800629 гена TNF-α способствовали более тяжелому течению коронавирусной инфекции [Fishchuk et al., 2021]. TNF-α является провоспалительным цитокином, продуцируемым главным образом макрофагами и лимфоцитами; его основной физиологический эффект – усиление иммунного ответа и формирование воспалительной реакции. Полиморфизм гена TNF может быть связан с риском развития артериальной гипертензии у пациентов с постковидным синдромом путем активации системной воспалительной реакции, окислительного стресса, что приводит к замедлению метаболической передачи сигналов инсулина [Москаленко и др., 2020; Fishchuk et al., 2021].
Заключение
Основные клинические симптомы постковидного синдрома у пациентов с артериальной гипертонией в сочетании с ожирением, по данным анализируемых источников литературы, были следующие: одышка (41 %), тромбоэмболические осложнения (до 5 %), усталость (37 %), «затуманивание мозга» (32 %), нарушение памяти (27 %), миалгии (18 %), аносмия (12 %), дисгевзия (11 %), головная боль (10 %), учащенное сердцебиение (9,7 %), боли в груди (7,3 %), аритмии (6,1 %), боли в животе (14 %), тошнота (6 %), диарея (10 %), диспепсии (20 %) и синдром раздраженного кишечника (17 %).
Среди предполагаемых генов, ответственных за протекание long COVID у пациентов с артериальной гипертензией и ожирением, можно выделить: АроЕ- ꜫ4; АСЕ2; F2; F5; AGT; AHSG, TNF.
Проведенный обзор литературы подтверждает нашу гипотезу, что существуют полиморфизмы генов, экспрессия которых усиливает степень выраженности и частоту симптомов постковидного синдрома у пациентов с такими коморбидными состояниями, как артериальная гипертония в сочетании с ожирением.
Идентификация таких биомаркеров может предоставить значительную стратегическую возможность для понимания патофизиологии механизмов развития заболевания, прогнозировать его отдаленный исход, тем самым улучшая здоровье человека и снижая затраты на здравоохранение.





Reference lists
Abdulghani Sh., Efremova O.A., Chernobai P.E. 2021. Role of Adipokins and Intestinal Microbiota in the Developing of Biliary Tract’s Inflammation in Obesity (Review of Literature). Challenges in Modern Medicine. 44(1): 28–37 (in Russian). doi: 10.18413/2687-0940-2021-44-1-28-37
Arutyunov G.P., Tarlovskaya E.I., Arutyunov A.G., Polyakov D.S., Belenkov Yu.N., Konradi A.O., Lopatin Yu.M., Rebrov A.P., Tereshchenko S.N., Chesnikova A.I., Hayrapetyan H.G., Babin A.P., Bakulin I.G., Bakulina N.V., Balykova L.A., Blagonravova A.S., Boldina M.V., Butomo M.I., Vaisberg A.R., Galyavich A.S., Gomonova V.V., Grigoryeva N.Yu., Gubareva I.V., Demko I.V., Evzerikhina A.V., Zharkov A.V., Zateishchikova A.A., Kamilova U.K., Kim Z.F., Kuznetsova T.Yu., Kulikov A.N., Lareva N.V., Makarova E.V., Malchikova S.V., Nedogoda S.V., Petrova M.M., Pochinka I.G., Protasov K.V., Protsenko D.N., Ruzanov D.Yu., Saiganov S.A., Sarybaev A.Sh., Selezneva N.M., Sugraliev A.B., Fomin I.V., Khlynova O.V., Chizhova O.Yu., Shaposhnik I.I., Schukarev D.A., Abdrakhmanova A.K., Avetisyan S.A., Avoyan H.G., Azaryan K.K., Aimakhanova G.T., Ayypova D.A., Akunov A.Ch., Alieva M.K., Almukhambedova A.R., Aparkina O.Yu., Aruslanova O.R., Ashina E.Yu., Badina O.Yu., Barysheva O.Yu., Batluk T.I., Batchaeva A.S., Bashkinov R.A., Bitieva A.M., Bikhteev I.U., Borodulina N.A., Bragin M.V., Brazhnik V.A., Budu A.M., Bykova G.A., Vagapova K.R., Varlamova D.D., Vezikova N.N., Verbitskaya E.A., Vilkova O.E., Vinnikova E..., Vustina V.V., Elena A. Galova E.A., Genkel V.V., Giller D.B., Gordeychuk E.D., Gorshenina E.I., Grigoryeva E.V., Gubareva E.Yu., Dabylova G.M., Demchenko A.I., Dolgikh O.Yu., Duishobaev M.Y., Evdokimov D.S., Egorova48 K.E., Zheldybaeva A.E., Zarechnova N.V., Zimina Yu.D., Ivanova S.Yu., Ivanchenko E.Yu., Ilina M.V., Kazakovtseva M.V., Kazymova E.V., Yuliya S. Kalinina Yu.S., Kamardina N.A., Karachenova A.M., Karetnikov I.A., Karoli N.A., Karsiev M.Kh., Kaskaeva D.S., Kasymova K.F., Kerimbekova Zh.B., Kim E.S., Kiseleva N.V., Klimenko D.A., Kovalishena O.V., Kozlov S.V., Kolmakova E.V., Kolchinskaya T.P., Kolyadich M.I., Kondryakova O.V., Konoval M.P., Konstantinov D.Yu., Konstantinova E.A., Kordyukova V.A., Koroleva E.V., Kraposhina A.Yu., Kryukova T.V., Kuznetsova A.S., Kuzmina T.Yu., Kuzmichev K.V., Kulchoroeva C.K., Kuprina T.V., Kuranova I.M., Kurenkova L.V., Kurchugina N.Yu., Kushubakova N.A., Levankova V.I., Ledyaeva A.A., Lisun T.V., Lisyanskaya V.E., Lyubavina N.A., Magdeeva N.A., Mazalov K.V., Mayseenko V.I., Makarova A.S., Maripov A.M., Markov N.V., Marusina A.A., Melnikov E.S., Metlinskaya A.I., Moiseenko N.B., Muradova F.N., Muradyan R.G., Musaelyan Sh.N., Nekaeva E.S., Nikitina N.M., Nifontov S.E., Obolentseva E.Yu., Obukhova A.A., Ogurlieva B.B., Odegova A.A., Yuliya V. Omarova Yu.V., Omurzakova N.A., Ospanova Sh.O., Pavlova V.A., Pakhomova E.V., Petrov L.D., Plastinina S.S., Platonov D.A., Pogrebetskaya V.A., Polyakov D.V., Ponomarenko E.V., Popova L.L., Potanin A.A., Prokofieva N.A., Rabik Yu.D., Rakov N.A., Rakhimov A.N., Rozanova N.A., Serikbolkyzy S., Sidorkina Ya.A., Simonov A.A., Skachkova V.V., Skvortsova R.D., Skuridin D.S., Solovieva D.V., Solovieva I.A., Sukhomlinova I.M., Sushilova A.G., Tagaeva D.R., Tikhonova E.P., Tokmin D.S., Tolmacheva A.A., Torgunakova M.S., Trenogina K.V., Trostyanetskaya N.A., Trofimov D.A., Trubnikova M.A., Tulichev A.A., Tursunova A.T., Ulanova N.D., Fatenkov O.V., Fedorishina O.V., Fil T.S., Fomina I.Yu., Fominova I.S., Frolova I.A., Tsvinger S.M., Tsoma V.V., Cholponbaeva M.B., Chudinovskikh T.I., Shavrin I.V., Shevchenko O.A., Shikhaliev D.R., Shishkina E.A., Shishkov K.Yu., Shcherbakov S.Yu., Shcherbakova G.V., Yausheva E.A. 2023. Newly Diagnosed Diseases and the frequency of their Occurrence in Patients after a New Coronavirus Infection. Results of an International Register "Dynamics Analysis of Comorbidities in SARS-CoV-2 Survivors (ACTIV SARS-CoV-2)" (12-month follow-up). Russian Journal of Cardiology. 28(4): 5424 (in Russian). doi: 10.15829/1560-4071-2023-5424
Belyakov N.A., Trofimova T.N., Rassokhin V.V., Rybakova M.G., Vasiliev B.B. 2021. Postcovid Syndrome – Polymorphism of Disorders in a New Coronavirus Infection. HIV Infection and Immunosuppressive Disorders. 13(4): 7–20 (in Russian). doi: 10.22328/2077-9828-2021-13-4-7-20
Blagov A.Yu., Efremova O.A., Khodosh E.M., Aleinikova K.S., Dubrova V.A. 2022. The Role of Cytokines in the Development of Systemic Inflammation in Chronic Obstructive Pulmonary Disease and Obesity. Obesity and Metabolism. 19(4): 442–448 (in Russian). doi: 10.14341/omet12847
Moskalenko M.I., Ponomarenko I.V., Milanova S.N., Verzilina I.N., Efremova O.A., Polonikov A.V. 2020. Polymorphic Locus rs1061624 of the ТNFR2 Gene is Associated with the Development of Arterial Hypertension in Males. Kardiologiia. 60(8): 78–83 (in Russian). doi: 10.18087/cardio.2020.8.n996
Abdulan I.M., Feller V., Oancea A., Maștaleru A., Alexa A.I., Negru R., Cumpăt C.M., Leon M.M. 2023. Evolution of Cardiovascular Risk Factors in Post-COVID Patients. J Clin Med. Oct 15; 12(20): 6538. doi: 10.3390/jcm12206538
Blagova O,, Varionchik N,, Zaidenov V,, Savina P,, Sarkisova N. 2021. Anti-Heart Antibodies Levels and their Correlation with Clinical Symptoms and Outcomes in Patients with Confirmed or Suspected Diagnosis COVID-19. Eur J Immunol. 51(4): 893–902. doi: 10.1002/eji.202048930
Cafiero C., Rosapepe F., Palmirotta R., Re A., Ottaiano M.P., Benincasa G., Perone R., Varriale E., D'Amato G., Cacciamani A., Micera A., Pisconti S. 2021. Angiotensin System Polymorphisms' in SARS-CoV-2 Positive Patients: Assessment Between Symptomatic and Asymptomatic Patients: A Pilot Study. Pharmgenomics Pers Med. 14: 621–629. doi: 10.2147/PGPM.S303666
Choudhury A., Tariq R., Jena A., Vesely E.K., Singh S., Khanna S., Sharma V. 2022. Gastrointestinal Manifestations of long COVID: A Systematic Review and Meta-Analysis. Therap Adv Gastroenterol. 15: 17562848221118403. doi: 10.1177/17562848221118403
Copur S., Berkkan M., Basile C., Tuttle K., Kanbay M. 2022. Post-acute COVID-19 Syndrome and Kidney Diseases: What do we know? J Nephrol. 35(3): 795–805. doi: 10.1007/s40620-022-01296-y
Dieter C., Brondani L.A., Leitão C.B., Gerchman F., Lemos N.E., Crispim D. 2022. Genetic Polymorphisms Associated with Susceptibility to COVID-19 Disease and Severity: A Systematic Review and Meta-Analysis. PLoS One. 17(7): e0270627. doi: 10.1371/journal.pone.0270627
Faustine I., Marteka D., Malik A., Supriyanto E., Syafhan N.F. 2023. Genotype Variation of ACE and ACE2 Genes Affects the Severity of COVID-19 Patients. BMC Res Notes. 16(1): 194. doi: 10.1186/s13104-023-06483-z
Ferreira de Araújo J.L., Menezes D., Saraiva-Duarte J.M., de Lima Ferreira L., Santana de Aguiar R, Pedra de Souza R. 2022. Systematic Review of Host Genetic Association with Covid-19 Prognosis and Susceptibility: What have we Learned in 2020? Rev Med Virol. 32(2): e2283. doi: 10.1002/rmv.2283
Fishchuk L., Rossokha Z., Pokhylko V., Cherniavska Y., Tsvirenko S., Kovtun S., Medvedieva N., Vershyhora V., Gorovenko N. 2021. Modifying Effects of TNF-α, IL-6 and VDR Genes on the Development Risk and the Course of COVID-19. Pilot Study. Drug Metab Pers Ther. 37(2): 133–139. doi: 10.1515/dmpt-2021-0127
Georgieva E., Ananiev J., Yovchev Y., Arabadzhiev G., Abrashev H., Abrasheva D., Atanasov V., Kostandieva R., Mitev M., Petkova-Parlapanska K., Karamalakova Y., Koleva-Korkelia I., Tsoneva V., & Nikolova G. 2023. COVID-19 Complications: Oxidative Stress, Inflammation, and Mitochondrial and Endothelial Dysfunction. International Journal of Molecular Sciences, 24(19), 14876. doi: 10.3390/ijms241914876
Glotov O.S, Chernov A.N., Scherbak S.G., Baranov V.S. 2021. Genetic Risk Factors for the Development of COVID-19 Coronavirus Infection. Russ J Genet. 57(8): 878–892. doi: 10.1134/S1022795421080056
Kim H.W., Belin de Chantemèle E.J., Weintraub N.L. 2019. Perivascular Adipocytes in Vascular Disease. Arterioscler Thromb Vasc Biol. 39(11): 2220–2227. doi: 10.1161/ATVBAHA.119.312304
Kuodi P., Gorelik Y., Gausi B., Bernstine T., Edelstein M. 2023. Characterization of post-COVID Syndromes by Symptom Cluster and Time Period up to 12 Months Post-Infection: A Systematic Review and Meta-Analysis. Int J Infect Dis. 134: 1–7. doi: 10.1016/j.ijid.2023.05.003
Lechien J.R., Chiesa-Estomba C.M., Vaira L.A., De Riu G., Cammaroto G., Chekkoury-Idrissi Y., Circiu M., Distinguin L., Journe F., de Terwangne C., Machayekhi S., Barillari M.R., Calvo-Henriquez C., Hans S., Saussez S. 2021. Epidemiological, Otolaryngological, Olfactory and Gustatory Outcomes According to the Severity of COVID-19: A Study of 2579 Patients. Eur Arch Otorhinolaryngol. 278(8): 2851–2859. doi: 10.1007/s00405-020-06548-w
Montefusco L., Ben Nasr M., D'Addio F., Loretelli C., Rossi A., Pastore I., Daniele G., Abdelsalam A., Maestroni A., Dell'Acqua M., Ippolito E., Assi E., Usuelli V., Seelam A.J., Fiorina R.M., Chebat E., Morpurgo P., Lunati M.E., Bolla A.M., Finzi G., Abdi R., Bonventre J.V., Rusconi S., Riva A., Corradi D., Santus P., Nebuloni M., Folli F., Zuccotti G.V., Galli M., Fiorina P. 2021. Acute and Long-Term Disruption of Glycometabolic Control after SARS-CoV-2 Infection. Nat Metab. 3(6): 774–785. doi: 10.1038/s42255-021-00407-6
Nalbandian A., Sehgal K., Gupta A., Madhavan M.V., McGroder C., Stevens J.S., Cook J.R., Nordvig A.S., Shalev D., Sehrawat T.S., Ahluwalia N., Bikdeli B., Dietz D., Der-Nigoghossian C., Liyanage-Don N., Rosner G.F., Bernstein E.J., Mohan S., Beckley A.A., Seres D.S., Choueiri T.K., Uriel N., Ausiello J.C., Accili D., Freedberg D.E., Baldwin M., Schwartz A., Brodie D., Garcia C.K., Elkind M.S.V., Connors J.M., Bilezikian J.P., Landry D.W, Wan E.Y. 2021. Post-acute COVID-19 Syndrome. Nat Med. 27(4): 601–615. doi: 10.1038/s41591-021-01283-z
Pillay J., Rahman S., Guitard S., Wingert A., Hartling L. 2022. Risk Factors and Preventive Interventions for Post COVID-19 Condition: Systematic Review. Emerg Microbes Infect. 11(1): 2762–2780. doi: 10.1080/22221751.2022.2140612
Premraj L., Kannapadi N.V., Briggs J., Seal S.M., Battaglini D., Fanning J., Suen J., Robba C., Fraser J., Cho S.M. 2022. Mid and Long-Term Neurological and Neuropsychiatric Manifestations of Post-COVID-19 Syndrome: A Meta-Analysis. J Neurol Sci. 434: 120162. doi: 10.1016/j.jns.2022.120162
Raman B., Bluemke D.A., Lüscher T.F., Neubauer S. 2022. Long COVID: Post-Acute Sequelae of COVID-19 with a Cardiovascular Focus. Eur Heart J. 43(11): 1157–1172. doi: 10.1093/eurheartj/ehac031
Ravikanth V., Sasikala M., Naveen V., Latha S.S., Parsa K.V.L., Vijayasarathy K., Amanchy R., Avanthi S., Govardhan B., Rakesh K., Kumari D.S., Srikaran B., Rao G.V., Reddy D.N. 2021. A Variant in TMPRSS2 is Associated with Decreased Disease Severity in COVID-19. Meta Gene. 29: 100930. doi: 10.1016/j.mgene.2021.100930
Soriano J.B., Murthy S., Marshall J.C., Relan P., Diaz J.V. 2022. WHO Clinical Case Definition Working Group on Post-COVID-19 Condition. A Clinical Case Definition of post-COVID-19 Condition by a Delphi Consensus. Lancet Infect Dis. 22(4): e102-e107. doi: 10.1016/S1473-3099(21)00703-9
Vyas P., Joshi D., Sharma V., Parmar M., Vadodariya J., Patel K., Modi G. 2023. Incidence and Predictors of Development of New Onset Hypertension Post COVID-19 Disease. Indian Heart J. 75(5): 347–351. doi: 10.1016/j.ihj.2023.06.002
Wójcik K., Bazan-Socha S., Celejewska-Wójcik N., Górka K., Lichołai S., Polok K., Stachura T., Zaręba L., Dziedzic R., Gradzikiewicz A., Sanak M., Musiał J., Sładek K., Iwaniec T. 2023. Decreased Protein C Activity, Lower ADAMTS13 Antigen and Free Protein S Levels Accompanied by Unchanged Thrombin Generation Potential in Hospitalized COVID-19 Patients. Thromb Res. 223: 80–86. doi: 10.1016/j.thromres.2023.01.016
Writing Committee for the COMEBAC Study Group; Morin L., Savale L., Pham T., Colle R., Figueiredo S., Harrois A., Gasnier M., Lecoq A.L., Meyrignac O., Noel N., Baudry E., Bellin M.F., Beurnier A., Choucha W., Corruble E., Dortet L., Hardy-Leger I., Radiguer F., Sportouch S., Verny C., Wyplosz B., Zaidan M., Becquemont L., Montani D., Monnet X. 2021. Four-Month Clinical Status of a Cohort of Patients after Hospitalization for COVID-19. JAMA. 325(15): 1525–1534. doi: 10.1001/jama.2021.3331
Xu Y., Rong J., Zhang Z. 2021. The Emerging Role of Angiotensinogen in Cardiovascular Diseases. J Cell Physiol. 236(1): 68–78. doi: 10.1002/jcp.29889
Zhao J., Lu W., Ren Y., Fu Y., Martens Y.A., Shue F., Davis M.D., Wang X., Chen K., Li F., Liu C.C., Graff-Radford N.R., Wszolek Z.K., Younkin S.G., Brafman D.A., Ertekin-Taner N., Asmann Y.W., Dickson D.W., Xu Z., Pan M., Han X., Kanekiyo T., Bu G. 2021. Apolipoprotein E Regulates Lipid Metabolism and α-Synuclein Pathology in Human iPSC-Derived Cerebral Organoids. Acta Neuropathol. 142(5): 807–825. doi: 10.1007/s00401-021-02361-9