Dynamics of Behavioral Reactions and Regeneration of Bone Structures in Small Animals following an Injury
Annotation
The aim of the experiment was to analyze the characteristics of behavioral reactions and the intensity of regeneration in the post-traumatic period in small animals. Materials and methods. The experiment involved mature male rats of the breed Vistar (Rappolovo vivarius), weighing 180–320 gr. and aged from six to twelve months. Injury simulation was performed by precision impactor, followed by behavioral responses (PR) on infrared activometer for two weeks. Results and discussion. By the 14th day, the behavioral reactions (PR) in small animals of the first group remained close to reference values, in the second group locomotor activity was sharply reduced, in the third group back-leg rise in response to sound signal was not recorded, while in the fourth group locomotor activity (LA) and the stereotype (S) of behavior was 1.8 times lower than in the other three groups. Conclusion. The damage to the small animals' snout bones in the early post-traumatic period is characterized by negative dynamics of PR. A reduction of motor activity has been recorded, which is most likely due to the disruption of brain and neuro-humoral activity. The study revealed a metabolic imbalance, with a reduced amount of food and water consumed despite their availability, which most likely stems from disruptions in the brain and neuro-humoral activity. Control CT of the second and the fourth group showed signs of occificate deficit in the injured tissues. Morphologically, it corresponded to the local regeneration disturbances.
Keywords: regeneration, locomotor activity, eye-motor disorders, orbital injury, zygomo-orbital complex
Unfortunately, the article is available only in Russian
Введение
Поведенческая активность (ПА) животных – сложный комплекс биофизических и биохимических процессов с разной степенью реакций на раздражители [Canini, 2009; McCarson, 2019]. Регистрация триггеров в клинике осуществляется объективными и субъективными методами или их комплексами. В экспериментальной работе широко используют и считают наиболее достоверными результаты, полученные в актиметре, так как удаётся зафиксировать и детализировать интенсивность поведенческой активности (ПА), стереотипность поведения (СП), недоступных невооруженному глазу [Pontifex, 2024]. Необходимость определения ПА у экспериментальных животных считается фундаментальной основой при валидации показателей и моделировании патологических процессов [Munalisa, 2024], так как динамика их отклонений позволяет проанализировать уровень отклонений в центральной и (или) периферической нервной системе, особенно при моделировании травм. Очевидно, что данный метод целесообразно использовать для мониторинга когнитивных, локомоторных, социальных, сенсорных показателей [Turcotte, 2022]. Изучение общей локомоторной активности (ЛА) животных на открытом поле актиметра позволяет проанализировать динамику, маршрут, характер, интенсивность, оживлённость движений по ритму, координации с регистрацией общего пути следования, стереотипности трафика, временных промежутков отсутствия движения, на основании чего можно высказать предположения о причинах возникновения конвульсивных и несвойственных движений [Wasilewski, 2018; Bouchekioua, 2022]. Предметный анализ статистических данных возможно получить у животных, находящихся на открытой арене, разделённой на сектора инфракрасным лазером с начертанием фиксированных меток [Briones, 2021]. Кроме того, возможно использовать дополнительные элементы, позволяющие определять СП в привычной жизнедеятельности – «ловушки», заземления, световые коридоры [Cheatham, 2021]. Автоматизированные актиметры регистрируют ЛА повседневной жизнедеятельности в реальном времени, в записи [Мустафина, 2023]. Регистрация стереотипных поведенческих реакций (ПР) в движении, в покое, с фиксацией мелкого тремора стала возможной после модернизации устройства и уменьшения поля инфракрасного излучения с сокращением шага с 2,5 см до 2 мм. Последнее условие крайне важно и необходимо для изучения ПР у мелких животных (МЖ), в частности грызунов [Fowler, 2001]. По мнению ряда авторов, моделирование краниофациальных повреждений у экспериментальных животных в превалирующем большинстве случаев сопровождается черепно-мозговой травмой [Андрос, 2022]. Выраженность общемозговой симптоматики зависит от ряда факторов – скорости наносимого удара, массы животного, локализации точки наносимого удара, диаметра и массы ударника, а также анатомо-топографических особенностей воспринимающей силу удара поверхности, а также влияет на процессы метаболизма и регенерации [Клычкова, 2024]. Диагностика мозговой и глазодвигательной симптоматики у МЖ сложна, в большинстве случаев приходится опираться на субъективные, визуальные методы регистрации, объективно и однозначно интерпретировать которые невозможно по причине атипично протекающих нейрогуморальных процессов с алиментарными расстройствами, вероятно, обусловливающих снижение иммунного статуса и нагноение ран, с отрицательной динамикой регенерации костных структур в этой группе животных [Каде, 2018]. Дефицит информации о поведенческой активности при травмах мозга МЖ и роли алиментарных расстройств в этих, вероятнее всего, взаимосвязанных процессах, обуславливающих нарушения репаративной регенерации, определили актуальность настоящего исследования.
Материалы и методы
Изучена ПА у 68 грызунов – самцов, весом от 180 до 320 гр., ранее не участвовавших в экспериментах. Животные содержались в стандартных условиях вивария НИИ фармакологии живых систем НИУ «БелГУ» в системе индивидуально вентилируемых клеток «Tecniplast» при автоматически контролируемых температуре и влажности при циркадном 12-часовом режиме освещения – день/ночь. Содержание животных и экспериментальные манипуляции отвечали международным рекомендациям «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (1986), а также правилам лабораторной практики при проведении доклинических исследований в РФ в соответствии с «Принципами надлежащей лабораторной практики» [GOST 91500.13.0001-2003; GOSTR 33647-2015] и «Об утверждении правил надлежащей лабораторной практики» (Минздрав РФ, приказ № 199н от 1 апреля 2016 г.). Перед экспериментом самцы грызунов были рандомизировано разделены на 4 группы по 18 в каждой. Статистически значимые выбросы по критерию Шовене в измеряемых параметрах определялись как критерий исключения [Хафизьянова, 2006; Миронов, 2016]. Травма наносилась тупым предметом с использованием закрытой техники при помощи прецизионного импактора 68099 Ⅱ Precise Impactor – Built for Speed (USA, RWD Life Science Co). Погрешность смещения при ударе в прецизионном импакторе не превышает 0,01 мм, что обеспечено пневматической и электрической регулировками. Диаметр ударника стандартный – 4 мм, с глубиной погружения до 7 мм, скорость удара являлась заданной и составляла 5,6 и 2,4 м/с, время выдержки – 0,10 м/с.
Объём повреждений визуализирован на аппарате мультиспиральной компьютерной томографии (МС КТ) Philips Brilliance 64 СКТ с 64 срезами (Нидерланды). МС КТ выполняли после введения раствора хлорал гидрата из расчета 450 мг/кг (15 мкг на кг) массы тела животного, внутрибрюшинно, доводя уровень сознания до глубокой седации.
МЖ в эксперименте разделили на 4 группы, по 18 голов, в зависимости от локализации травмы и скорости перемещения травмирующего агента (рисунок 2).
В 1 группу вошли МЖ от 180 до 220 гр., точка приложения удара которым соответствовала центральному сегменту нижней стенки орбиты со скоростью 5,6 м/с ударником массой 4 г.
Во 2 группе масса МЖ равнялась 230–320 гр., для них точка приложения удара располагалась в заднелатеральном сегменте нижней стенки орбиты со скоростью 5,6 м/с ударником массой 4 г.
В группе 3 вес МЖ 180–220 гр., точка приложения удара которым соответствовала центральному сегменту нижней стенки орбиты со скоростью 2,4 м/с ударником массой 4 г.
В 4 группе животных массой 230–320 гр. удар наносили в точку, соответствующую заднелатеральному сегменту нижней стенки орбиты со скоростью 2,4 м/с ударником массой 4 г.
После травмы всем животным выполняли МС КТ, по его результатам распределение следующее: 1 тип повреждений нижней стенки орбиты, без интерпозиции мягкотканых структур у 24 животных (50 %), 2 тип с интерпозицией мягкотканых структур у 18 животных (38 %), многооскольчатый (тотальный) перелом у 2 МЖ (4 %), линейный перелом у 4 МЖ (8 %).
Жизнеспособность животных после травмы оценивали по динамике ПР в аппарате Actimeter, модель LE8825 в режиме открытого поля.
Автоматизировано анализировали общую и ЛА, СП животных, число и продолжительность эпизодов вставания на задние лапы. ЛА представляет собой активное перемещение животного в пространстве на расстояние, превышающее размер тела, общая активность характеризуется всеми возможными видами перемещений, необходимыми для привычной жизнедеятельности. Стереотипностью является устойчивое бесцельное последовательное произведение повторяющегося движения, одним из видов проявлений которого представляется вставание на задние лапы. Исследование проводили в помещении с сумеречным освещением, с поочерёдным размещением животных в двухмерных квадратных рамках с подставкой 45×45 см, непрозрачной подложкой, окрашенной в черный цвет, с разбивкой поля на 9 квадратов. Рама с двухмерной системой координат по осям Х и Yдля оптимальной регистрации положения перемещений исследуемого объекта по плоскости. Размеры двухмерных квадратных рамок позволяли изолировано исследовать одну особь или нескольких МЖ сразу, в том числе с изучением аспектов их социализации. Программное обеспечение актиметра позволяло анализировать траекторию движений МЖ с измерением расстояния от начальной точки до конечной, скорость, время пребывания в покое в выбранных зонах, время «конвульсивных» движений как в записи, так и в режиме реального времени. ПА анализировали по критериям «Горизонтальная двигательная активность» – время нахождения животного в центральном сегменте, количество заходов в центральный сегмент (КЗвЦС), количество пересечений центрального сегмента (КПЦС), «вертикальную двигательную активность» – время нахождения за пределами центрального сегмента, количество актов груминга (КЭГ) («смещенную активность», заключающуюся в воспроизведении животным процессов вылизывания, выкусывания, почесывания), число стоек, число и время замираний (в норме не должны превышать 1/100 от времени исследования), число актов дефекации, регистрируемых в течение 5 часов, при нахождении не более 6 МЖ в клетке актиметра. Анализ показателей осуществляли на протяжении 14 суток с момента моделирования травмы, что обусловлено длительностью периода острой травмы, купированием общемозговой симптоматики и начала периода регенерации.
Статистический анализ
Данные обработаны в программе Sofastats, 2024. Расчёт среднего арифметического (M) и 95 % доверительного интервала (CI) проводили в программе MS Excel 2016. При сравнении средних показателей между различными группами использовали t-критерий Стьюдента. Оценку уровней значимых (р < 0,05) и достоверных (р < 0,001) межгрупповых различий по количественным (метрическим) и порядковым (бальным или полуметрическим) признакам производили с использованием непараметрических критериев Манна – Уитни и Фишера, по качественным признакам – методом χ²-квадрат. За уровень статистической значимости различий показателей принималась величина p < 0,05. Стандартное отклонение (m) и стандартная ошибка (m) представлялись одним значением, использовались для данных выборки и статистической балансировки с учетом отклонений в регистрируемых образцах. Ме принято средним арифметическим, m = [среднеквадратическое отклонение] / корень (n), формула для определения статистического значения.
Результаты и обсуждение
В ходе исследования ни одно животное не выбывало из эксперимента.
После нанесения прицельного удара в центральный сегмент скуло-орбитального сочленения у 4 (8 %) животных зарегистрированы переломы без смещения фрагментов. Общее состояние МЖ расценивалось как удовлетворительное, не требующее оперативного лечения. Нарушений жизнедеятельности и отклонений ПР ни в первые сутки после травмы, ни в последующие дни не выявлено, что, вероятно, обусловлено состоятельностью костных фрагментов, сохранением целостности анатомо-топографических ориентиров соединительно-тканных структур и отсутствием распространения ударной волны за пределы зоны нанесения травмы, так как та же сила, скорость и прочие показатели травмирующего агента при иных точках приложения усилий характеризовались в разной степени отклонениями в ПР. Используя результаты МС КТ, выполненные через 1 месяц после нанесения травмы, анализировали регенерацию костных фрагментов. В 1 и 3 группах плотность костных тканей составляла не менее 600 ЕД Хаунсфилда, что соответствует оптимальному регенерационному процессу.
Известно, что МЖ проявляют «избыточную» активность в замкнутом пространстве, что сопровождалось увеличением частоты пересечений линий по платформе актиметра. В норме их не менее 100 за 20 мин, и в большинстве исследований это принято за референс. При переломах 2 типа у 18 МЖ (38 %) зарегистрировано угнетение ЛА. Анализируя частоту пересечений 4 лапами поля, состоящего из 9 квадратов, разделённого линиями, формирующими сетку, удалось охарактеризовать критерий двигательной активности (КДА). Анализируя КДА в 1-е сутки после травмы по количеству перемещений в течение 20 минут, установлено, что у 18 МЖ (38 %) со 2 типом перелома оно сократилась до 33,2 ± 3 пересечений, что в 3 раза ниже референсных значений. Также отмечено отсутствие адекватной вегетативной реакции МЖ на инфракрасный свет и звуковые сигналы. У МЖ 2 и 4 групп КЭГ не зарегистрирован. У МЖ 1 и 3 групп КЭГ сократился до 6 ± 2 актов. Снижение показателя КЭГ сопровождалось снижением интенсивности локомоторной активности, что нагляднее всего прослеживалось с показателем массы животного (таблица 1). Анализируя выраженность данного критериального союза, сформулировано предположение по аналогии с людьми, имеющими избыточную массу тела, в связи с чем они достаточно неуклюжи. Возможно, в животном мире данное сравнение неуместно, но все же после получения травмы эта неуклюжесть у МЖ прогрессировала и сопровождалась снижением активности.
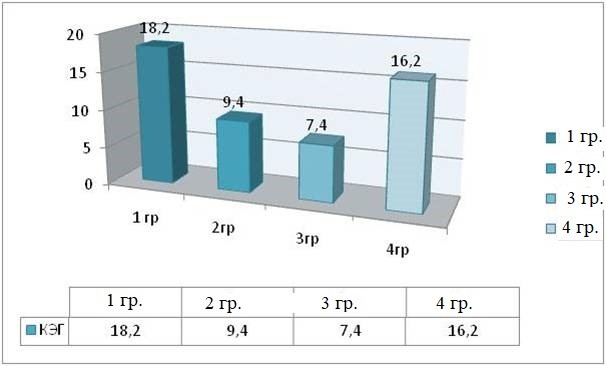
Рис. 1. Интенсивность ПР МЖ в 1-е сутки после травмы (КЭГ)
Fig. 1. The intensity of behavioral reactions in small animals on the first day after injury (number of grooming episodes)
В первые сутки после травмы в 1 и 3 группах общее время груминга не превышало 142,2 ± 7,3 с. за 5 часов нахождения на платформе актиметра. Количество эпизодов равнялось 18,2 ± 2,8 и 7,4 ± 1,6 в 1 и 3 группах соответственно.
Во 2-й и 4-й группах зарегистрировано время груминга 48,2 ± 4,5 с. при количестве эпизодов не более 16,2 ± 3,8 за 5 часов нахождения на платформе актиметра. На протяжении исследования более 6 МЖ в клетке не находилось. Количество актов груминга между группами не носило значимых отклонений на 1-е сутки исследования.
Отсутствие адекватной стереотипности движений у МЖ, вероятнее всего, обусловлено дефицитом нейровегетативных реакций в посттравматическом периоде.
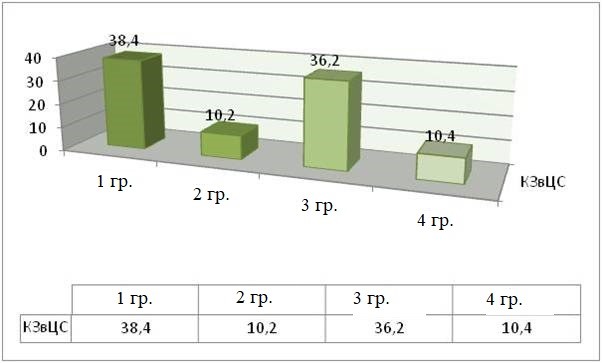
Рис. 2. Интенсивность ПР МЖ в 1-е сутки после травмы (КЗвЦС)
Fig. 2. The intensity of behavioral reactions in small animals on the first day after injury (number of entries to the central segment)
Во 2 и 4 группах КЗвЦС за 1-е сутки после получения травмы не превысил 10,2 и 10,4 соответственно, снижение локомоторной и общей активности обусловлено угнетением функциональной активности центральной нервной системы МЖ, что соответствовало данным клинических наблюдений.
Пересечение линий центрального сегмента животными 2 и 4 групп характеризовалось снижением частоты в 8–9 раз (до 96,6 ± 2,4 пересечений), что свидетельствовало о дисфункции ПР у МЖ. Показатели КЗвЦС и КПЦС в 1 и 3 группах в 2,5 раза выше, чем у МЖ 2 и 4 групп на 1-е сутки после моделирования травмы (рисунок 3).
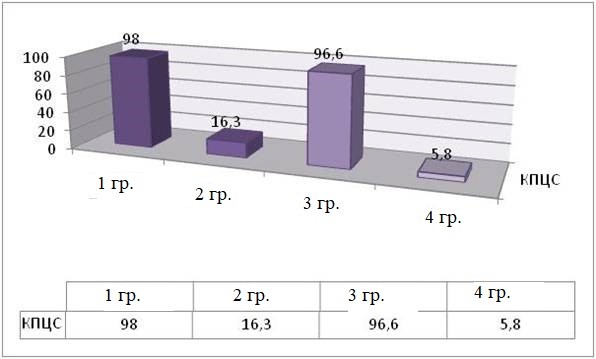
Рис. 3. ПР МЖ в 1-е сутки после травмы (КПЦС)
Fig. 3. The intensity of behavioral reactions in small animals on the first day after injury (number of times when the central segment was crossed)
В остром периоде наблюдений передвижения животных во всех группах регистрировали в life режиме актиметра (запись ПР онлайн, рисунок 4). Отмечена разбалансировка движений с ростом мелко амплитудного тремора до 18,2 ± 2,8 актов за 5 минут исследования.
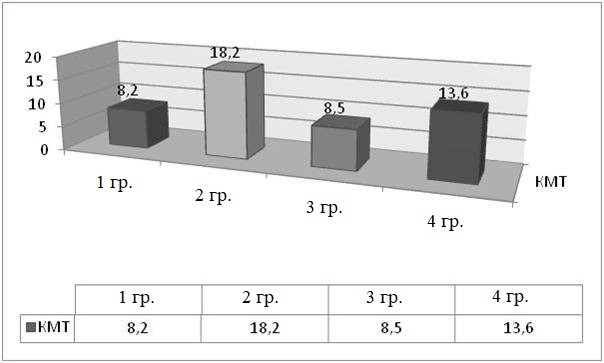
Рис. 4. ПР МЖ в 1-е сутки после травмы (КМТ)
Fig. 4. The intensity of behavioral reactions in small animals on the first day after injury (small amplitude tremor cases)
Таблица 1
Table 1
Интенсивность ПР МЖ в 1-е сутки после травмы
The intensity of behavioral reactions in small animals on the first day after injury
Группы исследования Частота ПР | 1 группа Me ± m | 2 группа Me ± m | 3 группа Me ± m | 4 группа Me ± m |
ЧПЦС | 28,1 ± 3 | 33,2 ± 3 | 27,1 ± 3 | 29,3 ± 3 |
КВС | 23,1 ± 2,5 | 19,8 ± 2,5 | 20,1 ± 3 | 20,4 ± 3 |
КАД | 21,1 ± 2,5 | 10,3 ± 1,8 | 17,2 ± 2,0 | 15,2 ± 2,0 |
КМТ | 10,5 ± 1,8 | 10,2 ± 1,8 | 8,5 ± 1,4 | 8 ± 1,4 |
КЗвЦС | 27,4 ± 3 | 24,2 ± 3 | 25,2 ± 3 | 23,4 ± 3 |
КЭГ | 12,2 ± 2,0 | 10,4 ± 1,8 | 9,4 ± 1,8 | 6,2 ± 1,4 |
ANOVA-тест, р | <0,05 | <0,05 | <0,05 | <0,05 |
Примечание: ЧПЦС – частота пересечений центрального сегмента; КВС – количество вертикальных стоек; КАД – количество актов дефекации; КМТ – количество мелкоамплитудного тремора; КЗвЦС – количество заходов в центральный сегмент; КЭГ – количество эпизодов груминга.
Среднее время замирания (ВЗ) во 2 и 4 группах – 32,4 ± 3,2 с., за 5 минут пребывания на платформе актиметра у животных в 1 и 3 группах оно составило 17,2 ± 2,8 с.
Анализируя ВЗ, его регистрировали как 1/10 времени в ответ на звуковые сигналы, тогда как в норме при стереотипных ПР животные совершают вертикальные стойки с максимальными эпизодами замирания, не превышающими 1/100 от времени исследования. ВЗ соотносили с количеством вертикальных стоек (КВС), которое в среднем колебалось 21,2 ± 3,1 с. во всех группах. В первые сутки после моделирования травмы значимое отклонение зафиксировано во 2 и 4 группах. В них данный показатель был в 3 раза меньше, чем в 1 и 3 группах, и составлял 7 ± 2,3 акта ВС.
У 18 животных (38 %) со 2 типом перелома в актиметре зарегистрированы нарушения жизнедеятельности со снижением числа пересечений инфракрасных линий (КПЦС) до 6 ± 2. По результатам наблюдений, к 7-м суткам в ответ на звуковой раздражитель животные и вовсе не вставали на задние лапы (таблица 2, рисунок 2).
Таблица 2
Table 2
ПР МЖ на 7-е сутки после травмы
Behavioral reactions in small animals on the seventh day after injury
Группа исследования Критерий ПА | 1 группа Me ± m | 2 группа Me ± m | 3 группа Me ± m | 4 группа Me ± m |
ЧПЦС | 18,2 ± 3 | 6 ± 2 | 16,3 ± 3 | 10,6 ± 3 |
КВС | 6,1 ± 1,5 | 0 ± 1,2 | 3,1 ± 1,2 | 2 ± 1,2 |
КАД | 18,3 ± 2,5 | 6,2 ± 1,8 | 13,1 ± 2,0 | 11,3 ± 2,0 |
КМТ | 16,2 ± 1,8 | 13,2 ± 1,8 | 10,5 ± 1,4 | 10 ± 1,4 |
КЗвЦС | 18,4 ± 3 | 14,2 ± 3 | 16,2 ± 3 | 10,4 ± 3 |
КЭГ | 8,2 ± 2,0 | 9,4 ± 1,8 | 7,4 ± 1,8 | 4,2 ± 1,4 |
ANOVA-тест, р | < 0,05 | < 0,05 | < 0,05 | < 0,05 |
Примечание: ЧПЦС – частота пересечений центрального сегмента; КВС – количество вертикальных стоек; КАД – количество актов дефекации; КМТ – количество мелко амплитудного тремора; КЗвЦС – количество заходов в центральный сегмент; КЭГ – количество эпизодов груминга.
К 7-м суткам после моделирования травмы отмечено снижение ПА. Среднее время груминга у животных 1 и 3 групп не превышало 85,2 ± 4,3 с., у животных 2 и 4 групп – 17,2 ± 4,5 с., что в 1,5 раза ниже, чем в 1-е сутки (рисунок 5). Снижение актов груминга исследователями расценивается как следствие органических нарушений в структурах, регулирующих стереотипность поведения. По данным наблюдений, в ряде случаев (около 27 % случаев) это приводит к летальным исходам [Briones, 2021].
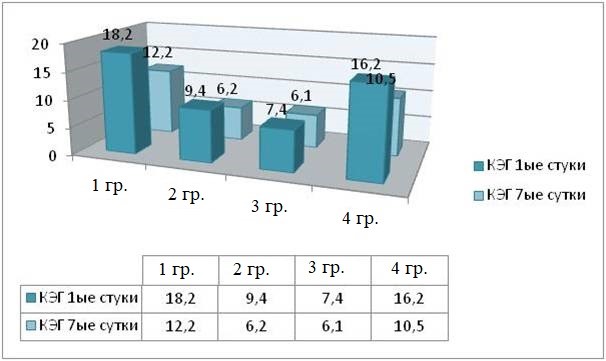
Рис. 5. Интенсивность ПР МЖ на 7-е сутки после травмы (КЭГ)
Fig. 5. The intensity of behavioral reactions in small animals on the seventh day after injury (number of grooming episodes)
КПЦС на 7 сутки исследования колебалось от 6,1до 18,2 ± 3, что в среднем в 1,5 раза ниже при сравнении с данными первых суток после моделирования травмы. Снижение КПЦС, вероятно, обусловлено отрицательной динамикой общемозговой симптоматики на фоне сократившегося объёма потребляемого корма и воды, актов дефекаций до 8 за 5 часов наблюдений и длительным пребыванием МЖ в неактивном состоянии. Необходимо отметить, что проведение какого-либо лечения, даже в объёме симптоматической терапии, не проводили и планировали. Во-первых, объём повреждений не предполагал моделирование мозговой симптоматики. Во-вторых, у абсолютного большинства животных мозговая симптоматика характеризовалась приходящими явлениями. В-третьих, запланированная травма скуло-орбитального комплекса исключает прямое поражение ЦНС, как и прямое повреждение зрительного органа, но отражённые эффекты локальной травмы дискутабельны. В клинической практике данные вопросы наиболее обсуждаемы, что и послужило основанием для создания данной модели (рисунок 6).
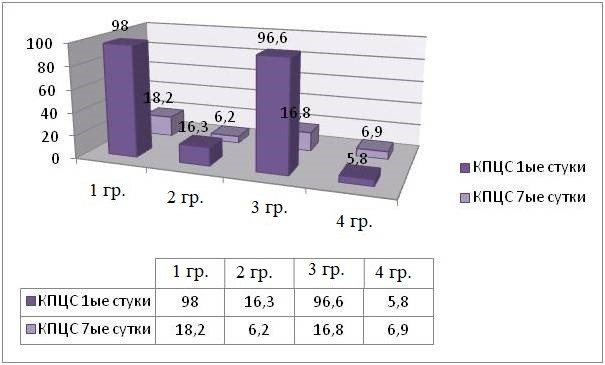
Рис. 6. Интенсивность ПР МЖ на 7-ые сутки после травмы (КПЦС)
Fig. 6. The intensity of behavioral reactions in small animals on the seventh day after injury (number of times when the central segment was crossed)
Отмеченный рост мелко амплитудного тремора (КМТ) с наибольшим количеством 16,2 ± 1,8 выявлен во 2 и 4 группах, что в 1,5 раза больше, чем на 1 сутки. Рост мелко амплитудного тремора сопровождался снижением общей локомоторной активности, стереотипностью поведения с очевидной прогрессирующей общемозговой симптоматикой после полученной травмы.
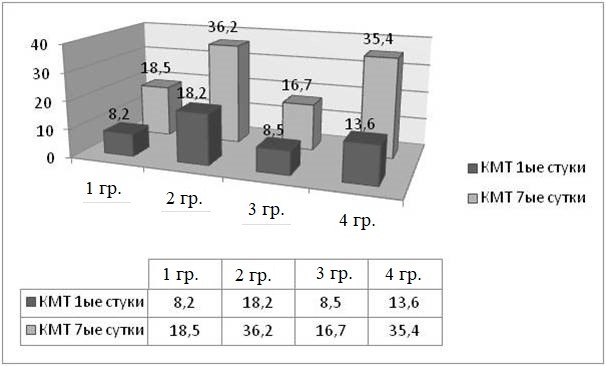
Рис. 7. Интенсивность ПР МЖ на 7-е сутки после травмы (КМТ)
Fig. 7. The intensity of behavioral reactions in small animals on the seventh day after injury (small amplitude tremor cases)
Заметно снижено количество вертикальных стоек, они отсутствовали во 2 группе и не превышали 2 ± 1,2, в 4 группе у животных с наименьшей массой тела (рисунок 8).
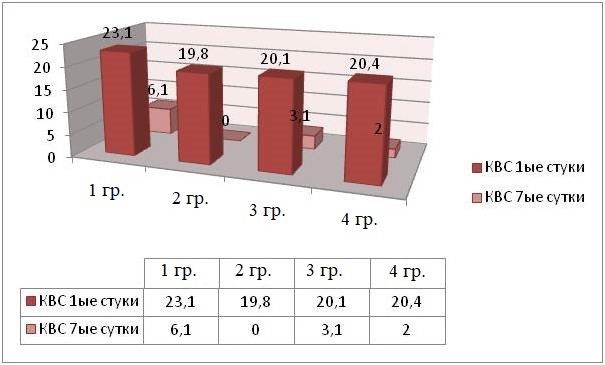
Рис. 8. Интенсивность ПР МЖ на 7-е сутки после травмы (КВС)
Fig. 8. The intensity of behavioral reactions in small animals on the seventh day after injury (number of upright postures)
Среднее время замирания во 2 и 4 группе колебалось в пределах 72,4 ± 3,2 с. за 5 минут пребывания на платформе актиметра, у животных 1 и 3 групп составляло 32,2 ± 2,8 с., что в 2 раза выше, чем на 1-е сутки после получения травмы.
К 14 суткам наблюдений у 24 (50 %) животных количество пересечений инфракрасных линий на платформе достигало 98 ± 8 раз. Показатели двигательной активности оставались в норме, вставание на задние лапы при звуковом сигнале каждый раз, без задержек и «шаткости» при изменении положения тела животного.
У животных 2 и 4 группы отрицательная динамика показателей КВС соответствовала типу перелома, объёму смещённых фрагментов, повреждённых соединительно-тканных структур, общемозговой симптоматике, регистрируемой после моделирования травмы (таблица 3, рисунок 3).
Таблица 3
Table 3
ПА МЖ на 14-е сутки после моделирования патологического процесса
Behavioral reactions in small animals on the 14th day after the simulation of the pathological process
Группа исследования Критерий ПА | 1 группа Me ± m | 2 группа Me ± m | 3 группа Me ± m | 4 группа Me ± m |
ЧПЦС | 98 ± 2,4 | 5,8 ± 2 | 16,3 ± 3 | 96,6 ± 3,4 |
КВС | 28,1 ± 1,5 | 2 ± 1,2 | 25,1 ± 1,2 | 2 ± 1,2 |
КАД | 24,3 ± 2,5 | 6,2 ± 1,8 | 22,1 ± 2,0 | 18,3 ± 2,0 |
КМТ | 8,2 ± 1,8 | 18,2 ± 1,8 | 8,5 ± 1,4 | 13,6 ± 1,4 |
КЗвЦС | 38,4 ± 3 | 10,2 ± 3 | 36,2 ± 3 | 10,4 ± 3 |
КЭГ | 18,2 ± 2,0 | 9,4 ± 1,8 | 7,4 ± 1,8 | 16,2 ± 1,4 |
ANOVA-тест, р | <0,05 | <0,05 | <0,05 | <0,05 |
Примечание: ЧПЦС – частота пересечений центрального сегмента; КВС – количество вертикальных стоек; КАД – количество актов дефекации; КМТ – количество мелкоамплитудного тремора; КЗвЦС – количество заходов в центральный сегмент; КЭГ – количество эпизодов груминга.
К 14 суткам в 1 группе животных ЧПЦС достигала 96,6 ± 2,4 перемещений, что на 25 % выше показателей 7-х суток, соответствовавших 16,8 ± 3,2 перемещениям после моделирования травмы. Данный показатель коррелировал с пропорционально возрастающей интенсивностью КВС и КЗвЦС.
Анализируя интенсивность ПА МЖ в острый период травмы (первые 7 суток), зарегистрированы нарушения общей и ЛА, что соответствует симптомам общемозговой дисфункции, а угасшая стереотипность поведения восстанавливалась в течение 14 суток, о чём свидетельствует динамика показателей, отображённая в таблице 4.
Таблица 4
Table 4
ПР МЖ на 14-е сутки после травмы
Behavioral reactions in small animals on the 14th day after injury
| ЧПЦС 1-е сутки | ЧПЦС 7-е сутки | ЧПЦС 14-е сутки | КВС | КВС 7-е сутки | КВС 14-е сутки | КЗвЦС 1-е сутки | КЗвЦС 7-е сутки | КЗвЦС 14-е сутки |
1 гр. | 28,1 | 18,2 | 98 | 23,1 | 6,1 | 28,1 | 27,4 | 18,4 | 38,4 |
2 гр. | 33,2 | 6 | 5,8 | 19,8 | 0 | 2 | 24,2 | 14,2 | 10,2 |
3 гр. | 27,1 | 16,3 | 16,3 | 20,1 | 3,1 | 25,1 | 25,2 | 16,2 | 36,2 |
4 гр. | 29,3 | 10,6 | 96,6 | 20,4 | 2 | 2 | 23,4 | 10,4 | 10,4 |
Обсуждение. Изучение стереотипности поведения мелких грызунов, по данным отечественных авторов, представляет большой интерес в экспериментальной медицине. Так, авторами [Каде, Кравченко и др., 2018] продемонстрированы изменения в эксперименте открытого поля на животных, получавших нагрузку различными лекарственными средствами. Сравнительный анализ с зарубежными авторами отклонений поведенческой активности выявил корреляцию нарушений в поведенческой активности на фоне моделирования общемозговых острых нарушений кровоснабжения [Pontifex et al., 2024]. В исследовании ПА и СП угнетаются по нарастающей с попаданием в состояние сопора в течение от нескольких часов до нескольких суток, в зависимости от объема поражения головного мозга. Проведенное нами исследование по ряду показателей соответствовало изменениям динамики в работах выше упомянутых авторов. Благодаря отдаленному мониторингу показателей в различных группах определена дальнейшая актуальность исследования влияния травмы, ее силы и точки приложения на мелких животных.
Выводы
Патологические паттерны в поведенческой активности после моделирования травмы отмечены во всех группах МЖ. Среднее ВЗ во 2 и 4 группе снижено до 72,4 ± 3,2 с. за 5 минут пребывания на платформе актиметра. Мелко амплитудный тремор колебался на уровне 18,2 ± 2,8 актов за период наблюдения. У животных 1 и 3 групп КМТ не превышало 8,2 ± 2,8, что в 2 раза меньше, чем во 2 и 4 группах.
Положительная динамика показателей общей и локомоторной активности в 1 и 3 группах позволила предположить отсутствие нарушений глазодвигательной и зрительной функций и отсутствии надобности в оперативном вмешательстве в объёме как минимум репозиции, декомпрессии.
У животных 1 и 3 групп через 1 месяц после нанесения травмы, по данным контрольного МС КТ в проекции повреждённых костей, зарегистрировано не менее 600 ЕД Хаунсфилда. Данный показатель плотности соединительно-тканных структур соответствует стадии посттравматического периода и рентгенологической картине регенераторного процесса. Во 2 и 4 группах нагноение раны зарегистрировано у 3 животных (4 %), данные контрольного МС КТ через 1 месяц характеризовались плотностью регенерата, не превышающего 340 ЕД Хаунсфилда. Данные показатели соответствуют фиброзному типу регенерации костных структур и расценены как результат, свидетельствующий о целесообразности проведения мер профилактики вторичного инфицирования моделируемой травмы.
Предлагаемая модель позволила проанализировать локальные процессы регенерации, изучить общей соматический статус, нейровегетативные показатели, поведенческую активность, жизненное функционирование, сформулировать задачи перспективных исследований, направленных на поиск методов лечения и профилактики посттравматических осложнений в группах МЖ.





Reference lists
Andros N.O., Gunko M.V., Kononenko K.H. 2022. Effect of Sterilization and Castration on Behavioral Reactions when Co-Housing Decorative Rats. North Caucasus Veterinary, 1(4): 15–21 (in Russian). doi: 10.56660/77368_2022_4_15
Kade A.H., Kravchenko S.V., Trofimenko A.I., Polakov P.P., Lipatova A.S., Ananieva E.I., Chaplygina K.U., Avuda E.A., Tereshchenko O.A. 2018. Modern Methods of Assessing Rodent Anxiety in Behavioral Tests Based on Models without Prior Conditioning. Cuban Scientific Medical Journal, 25(6), 171–176.
Klychkova S.N., Pavlova O.N., Gulenko O.N. 2024. Some Features of Changes in the Nervous System of Rat Offspring against the Background of Load by Antioxidants of Plant Origin. Modern Issues in Biomedicine, 8(1): 75–85. doi: 10.24412/2588-0500-2024_08_01_7
Mustafina A.K. 2023. Influence of l-tyrosine on Rat Behavioral Reactions. Bulletin of the Medical Institute «Reaabis»: Rehabilitation, Doctor and Health, 13(2S): 219.
Bouchekioua Y., Nishitani N., Ohmura Y. 2022. Conditioned Lick Suppression: Assessing Contextual, Cued, and Context-cue Compound Fear Responses Independently of Locomotor Activity in Mice. Bio Protoc. 5; 12(23): e4568. doi: 10.21769/BioProtoc.4568
Briones B.A., Pitcher M.N., Fleming W.T., Libby A., Diethorn E.J., Haye A.E., MacDowell C.J., Zych A.D., Waters R.C., Buschman T.J., Witten I.B., Gould E. 2021. Perineuronal Nets in the Dorsomedial Striatum Contribute to Behavioral Dysfunction in Mouse Models of Excessive Repetitive Behavior. Biol. Psychiatry Glob. Open Sci. 17; 2(4): 460–469. doi: 10.1016/j.bpsgos.2021.11.005
Canini F., Brahimi S., Drouet J.B., Michel V., Alonso A., Buguet A., Cespuglio R. 2009. Metyrapone Decreases Locomotion Acutely. Neurosci Lett. Jun 19; 457(1): 41–4. doi: 10.1016/j.neulet.2009.03.103
Cheatham S.M., Muchhala K.H., Koseli E., Jacob J.C., Komla E., Negus S.S., Akbarali H.I. 2021. Morphine Exacerbates Experimental Colitis-Induced Depression of Nesting in Mice. FrontPainRes (Lausanne). Dec 13; 2: 738499. doi: 10.3389/fpain.2021.738499
Fowler S.C., Birkestrand B.R., Chen R., Moss S.J., Vorontsova E., Wang G., Zarcone T.J. 2001. A Force-Plate Actometer for Quantitating Rodent Behaviors: Illustrative Data on Locomotion, Rotation, Spatial Patterning, Stereotypies, and Tremor. J. Neurosci. Methods. 30; 107(1–2): 107–24. doi: 10.1016/s0165-0270(01)00359-4
McCarson K.E., Winter M.K., Abrahamson D.R., Berman N.E., Smith P.G. 2019. Assessing Complex Movement Behaviors in Rodent Models of Neurological Disorders. Neurobiol. Learn. Mem. Nov; 165: 106817. doi: 10.1016/j.nlm.2018.02.025
Munalisa R., Lien T.S., Tsai P.Y., Sun D.S., Cheng C.F., Wu W.S., Li C.C., Hu C.T., Tsai K.W., Lee Y.L., Chou Y.C., Chang H.H. 2024. Restraint Stress-Induced Neutrophil Inflammation Contributes to Concurrent Gastrointestinal Injury in Mice. Int. J. Mol. Sci. 11; 25(10): 5261. doi: 10.3390/ijms25105261
Pontifex M.G., Connell E., Le Gall G., Lang L., Pourtau L., Gaudout D., Angeloni C., Zallocco L., Ronci M., Giusti L., Müller M., Vauzour D. 2024. A Novel Mediterranean Diet-Inspired Supplement Ameliorates Cognitive, Microbial, and Metabolic Deficits in a Mouse Model of Low-Grade Inflammation. Gut Microbes. 16(1): 2363011. doi: 10.1080/19490976.2024.2363011
Turcotte C.M., Rabey K.N., Green D.J., McFarlin S.C. 2022. Muscle Attachment Sites and Behavioral Reconstruction: An Experimental Test of Muscle-Bone Structural Response to Habitual Activity. Am. J. Biol. Anthropol. 177(1): 63–82. doi: 10.1002/ajpa.24410
Wasilewski A., Misicka A., Sacharczuk M., Fichna J. 2018. Prosecretory Effect of Loperamide in Ileal and Colonic Mucosae of Mice Displaying High or Low Swim Stress-Induced Analgesia Associated with High and Low Endogenous Opioid System Activity. Neurogastroenterol Motil. Feb;30 (2). doi: 10.1111/nmo.13166