A New Approach to Preventing Side Effects of Lipid-Lowering Therapy Using Personalized Cytoprotection in Patients with Coronary Heart Disease
Annotation
In order to develop a personalized approach to preventing side effects of statins, a clinical (in vivo) and experimental (in vitro) study of 60 patients with coronary heart disease was conducted. The comparison group (n = 30) received basic therapy (atorvastatin 20 mg/day). The main group (n = 30) additionally received the etoxidol cytoprotector. Atorvastatin monotherapy was found to cause a significant increase in markers of myopathy and myocardial cytolysis (total creatine phosphokinase CPK, MB-CPK, myoglobin) with a moderate hypolipidemic effect. In the etoxidol group, the levels of these markers decreased. The in vitro study showed that the cytoprotective activity of etoxidol was maximum in cases of hypercholesterolemia (CH > 6.6 mmol/l), and that of trimetazidine – in cases of normal/low CH (< 5.3 mmol/l). Personalized prescription of a cytoprotector depending on the level of total blood cholesterol is proposed as a new method for preventing the side effects of statin therapy.
Keywords: coronary heart disease, lipid-lowering therapy, side effects, prevention, personalized cytoprotection, atorvastatin, ethoxidol, trimetazidine
Unfortunately, the article is available only in Russian
Введение
Современные клинические рекомендации рассматривают коррекцию дислипидемии, в частности снижение уровня холестерина липопротеинов низкой плотности (ХС ЛПНП) как ключевую терапевтическую цель для уменьшения смертности от сердечно-сосудистых заболеваний [Ежов и др., 2023; Сергиенко, 2023]. Для этого рекомендованы: интенсивная статинотерапия (аторвастатин, розувастатин, питавастатин), эзетимиб, таргетные ингибиторы PCSK9 (алирокумаб, эволокумаб) и инклисиран – инновационный агент на основе миРНК [Карпов, 2023; Патеюк, 2024]. Стратегия комбинированной гиполипидемической терапии получила убедительное обоснование [Ray et al., 2022; Masana et al., 2023]. Целевые уровни ХС ЛПНП, дифференцированные по риску сердечно-сосудистых осложнений, последовательно снижаются в рекомендациях Европейского и Всероссийского обществ кардиологов (ЕОК/ВНОК) по мере появления новых доказательств улучшения прогноза [Кухарчук и др., 2020; Ежов и др., 2023]. Например, у пациентов очень высокого риска целевой показатель уменьшился с 1,8 ммоль/л до 1,4 ммоль/л в 2020 г. [Grundy et al., 2019; Mach et al., 2020] и остался на этом уровне в последних рекомендациях 2023 года [Андрияшкина и др., 2024].
При этом использование высоких доз гиполипидемических средств ассоциируется с появлением нежелательных лекарственных реакций, которые резко ограничивают применение данного подхода в реальной клинической практике [Леонова, 2022; Чаулин, 2022]. Наиболее частыми побочными эффектами интенсивной статинотерапии являются развитие миопатии и рабдомиолиза [Соболева, 2020; Иськова и др., 2021], повреждения печени, почек, центральной и периферической нервной системы, нарушения репродуктивной функции у мужчин и женщин, ухудшение углеводного обмена, прогрессирование сахарного диабета и др. [Сусеков, 2024], описаны случаи статин-индуцированного повреждения миокарда [Чаулин и др., 2023]. В этой связи весьма актуальным является разработка новых подходов к профилактике побочных эффектов гиполипидемической терапии.
Поскольку в основе развития миопатии лежит возникновение энергодефицита в миоцитах через подавление синтеза убихинона (коэнзима Q) статинами [Чаулин и др., 2023], мы предположили, что назначение цитопротекторов может иметь положительный эффект на клетки и, соответственно, способно предупредить развитие миопатии. В данной работе мы исследовали два лекарственных препарата с цитопротекторными свойствами – этоксидол (в клинике и в эксперименте in vitro) и триметазидин (только в эксперименте in vitro). Этоксидол – антиоксидантный препарат, одним из показаний к назначению которого является ИБС. Триметазидин – метаболически активный препарат, относящийся к группе антиангинальных средств иного механизма действия, рекомендованный для применения у пациентов с ИБС: стенокардией, ХСН согласно клиническим рекомендациям.
Настоящая статья посвящена разработке персонализированного подхода к выбору цитопротекторного препарата для наиболее эффективного предупреждения побочных эффектов гиполипидемической терапии.
Целью настоящего исследования явилась разработка нового подхода к предупреждению развития нежелательных лекарственных реакций на введение гиполипидемических средств (аторвастатина) пациентам с ИБС путём применения персонализированной цитопротекторной терапии.
Материал и методы
Дизайн исследования состоял из двух этапов: I этап – клиническое исследование 60 пациентов с ИБС на базе отделения кардиологии № 1 Белгородской областной клинической больницы Святителя Иоасафа; II этап – исследование цитопротекторной активности этоксидола и триметазидина in vitro на образцах крови тех же пациентов в лаборатории клеточных технологий НИИ фармакологии живых систем НИУ «БелГУ».
На первом этапе было проведено проспективное открытое рандомизированное контролируемое сравнительное исследование, включившее 60 пациентов (40 женщин, 20 мужчин) с ИБС (стабильная стенокардия напряжения I–III ФК), сочетающейся с гипертонической болезнью II–III ст. и хронической сердечной недостаточностью I–IIA ст. (I–III ФК по NYHA). Средний возраст больных – 66,0 ± 2,0 лет (диапазон 49–81 год). Всем участникам выполнялся анализ крови, включавший липидный профиль (ОХ, ХС ЛПНП, ХС ЛПОНП, ХС ЛПВП, ТГ) и определение уровня общей креатинфосфокиназы (КФК), ее МВ-фракции и миоглобина. Методом рандомизации пациенты были распределены на две равнозначные группы (n = 30):
- Контрольная группа (1-я): Получала базисную терапию стенокардии согласно актуальным клиническим рекомендациям Минздрава РФ [Барбараш и др., 2024]. Для улучшения прогноза назначались аспирин (75 мг/сут), аторвастатин (20 мг/сут), бета-адреноблокаторы, иАПФ. Симптоматическая терапия включала антагонисты кальция, нитраты, диуретики (при СН/АГ), кордарон (при аритмиях), манинил (при СД).
- Исследовательская группа (2-я): На фоне аналогичной базисной терапии в стационаре (включая аторвастатин 20 мг/сут) дополнительно получала сублингвально этоксидол (100 мг × 3 р/сут) в течение 10–14 дней госпитализации и далее 40 дней амбулаторно. На амбулаторном этапе доза аторвастатина в этой группе снижалась до 10 мг/сут. Группы были сопоставимы по демографическим показателям, тяжести патологии и фармакотерапии. Продолжительность наблюдения – 2 месяца (стационарный + амбулаторный этапы). Оценивалась динамика липидного профиля, КФК, МВ-КФК и миоглобина на трех этапах: исходно, при выписке и по окончании амбулаторного периода.
На втором этапе исследовали цитопротекторную активность метаболических препаратов этоксидола и триметазидина in vitro, используя разработанную нами методику [Покровский и др., 2020]. Метод заключался в оценке динамики индекса жизнеспособности клеток после добавления тестируемых веществ в «терапевтической концентрации» к лейкоцитарной взвеси пациентов с ИБС. В качестве модельных клеток применяли лейкоциты периферической крови, чей метаболизм служит репрезентативным индикатором обменных процессов в организме [Wei et al., 2014; Yurkovich et al., 2019; Khokhlov et al., 2024]. Индекс жизнеспособности (соотношение живых/мертвых клеток) определяли методом флуоресцентной микроскопии (микроскоп Eclipse Ti-U, Nikon, Япония) с применением красителей Calcein AM (Invitrogen, США) для витальных клеток и Ethidium bromide (Sigma-Aldrich, США) для погибших [Ларионов и др., 2003; Митрошина и др., 2015]. Всего проанализировано 18 000 клеток.
Для обработки данных использовались методы вариационной статистики: вычисление средних арифметических значений и их стандартных ошибок, а также оценка значимости различий между группами сравнения по t-критерию Стьюдента. Порог статистической значимости был установлен на уровне p < 0,05. Статистический анализ изображений флуоресцентной микроскопии выполнялся с применением специализированного программного обеспечения – микроскопа EZ-C1 FreeViewer Ver.3.90 (Nikon). Применяли также прогностический анализ Вальда для определения значимости показателей анализа крови для достоверного прогнозирования цитопротекторной активности препаратов in vitro.
Участие субъектов в исследовании было добровольным. Каждый пациент был ознакомлен и подписал информированное согласие до забора крови и назначения лечения. Страхование жизни и здоровья больных не требовалось в связи с наблюдательным характером исследования. Тестирования лекарственных препаратов выполняли in vitro. Исследование одобрено локальным этическим комитетом при Белгородской областной клинической больнице Святителя Иоасафа (Протокол № 3 от 24.03.2018).
Результаты и их обсуждение
По результатам 60-дневного курса фармакотерапии ИБС отмечена позитивная динамика в виде гиполипидемического эффекта: концентрация общего холестерина в крови достоверно уменьшилась с 5,13 ± 0,18 ммоль/л до 4,36 ± 0,18 ммоль/л (p < 0,01), не достигнув, однако, целевого значения показателя в применённой невысокой дозировке аторвастатина (20 мг/сут) на протяжении небольшого промежутка времени (таблица 1). В группе пациентов, дополнительно получавших этоксидол, гиполипидемический эффект был более выраженным и стойким, о чём подробно было описано в нашей предыдущей статье [Ромащенко и др., 2024].
Динамика показателей липидного профиля, состояния скелетных мышц и миокарда представлены в таблице 1 и на рисунках 1 и 2.
Таблица 1
Table 1
Показатели липидного профиля, состояния скелетных мышц и миокарда на фоне двух вариантов фармакотерапии пациентов с ИБС – базисного лечения и с дополнительным назначением этоксидола
Indicators of lipid profile, skeletal muscle and myocardial condition in two variants of pharmacotherapy of patients with coronary heart disease – basic treatment and that with additional administration of ethoxidol
Показатели крови | 1я группа: | 2я группа: | ||||
Исходное состояние | После стационар-ного лечения | После амбулаторного лечения | Исходное состояние | После стационар-ного лечения | После амбулаторного лечения | |
ХС общий, ммоль/л | 5,3 ± 0,3**! | 4,2 ± 0,2** | 4,5 ± 0,3! | 4,9 ± 0,3* | 4,0 ± 0,2* | 4,3 ± 0,2 |
ТГ, ммоль/л | 1,8 ± 0,2 | 1,7 ± 0,2 | 1,7 ± 0,2 | 1,7 ± 0,2 | 1,7 ± 0,2 | 1,5 ± 0,1 |
ХС-ЛПВП, ммоль/л | 1,2 ± 0,1 | 1,2 ± 0,1 | 1,2 ± 0,1 | 1,2 ± 0,1 | 1,1 ± 0,1 | 1,2 ± 0,1 |
ХС-ЛПНП, ммоль/л | 3,2 ± 0,3**! | 2,2 ± 0,2** | 2,5 ± 0,3! | 2,9 ± 0,3* | 2,2 ± 0,1* | 2,6 ± 1,3 |
ХС-ЛПОНП, ммоль/л | 0,9 ± 0,1 | 0,9 ± 0,1 | 0,8 ± 0,1 | 0,8 ± 0,1 | 0,8 ± 0,1 | 0,7 ± 0,1 |
Коэффициент атерогенности | 3,7 ± 0,4 | 2,8 ± 0,2 | 3,0 ± 0,4 | 3,3 ± 0,3 | 2,9 ± 0,2 | 2,6 ± 0,2 |
КФК общ., Ед/л | 107,1 ± 12,8 | 74,6 ± 10,5 | 119,7 ± 13,2 | 110,0 ± 8,0 | 92,7 ± 10,5 | 116,9 ± 15,9 |
МВ-КФК, Ед/л | 15,7 ± 1,6! | 14,3 ± 1,0 | 28,8 ± 2,4! | 15,9 ± 1,3 | 15,3 ± 1,3 | 12,0 ± 2,5 |
Миоглобин, мкг/л | 65,7 ± 0,3! | 69,2 ± 0,2 | 78,5 ± 0,3! | 78,9 ± 7,9 | 77,6 ± 6,9 | 74,2 ± 8,9 |
Примечание. **p < 0,01 – достоверность различий при сравнении между показателями исходного состояния и после стационарного этапа лечения внутри группы; !p < 0,05 – достоверность различий при сравнении между показателями исходного состояния и после амбулаторного этапа лечения внутри группы; ХС – холестерин общий, ХС-ЛПВП – холестерин липопротеидов высокой плотности, ХС-ЛПНП – холестерин липопротеидов низкой плотности, ХС-ЛПОНП – холестерин липопротеидов очень низкой плотности, ТГ – триглицериды, КФК общ. – креатинфосфокиназа общая, МВ-КФК – МВ фракция креатинфосфокиназы.
Показатели уровня миоглобина и миокардиальной фракции КФК в сравнении с нормой представлены на рисунках 1 и 2.
Фармакотерапия с добавлением этоксидола и сниженными дозами аторвастатина (10–20 мг/сут) показала лучший профиль безопасности, чем монотерапия аторвастатином (20 мг/сут). В частности, к концу амбулаторного этапа уровень миоглобина нормализовался во 2-й группе (с этоксидолом), но превысил норму в 1-й группе (без этоксидола); показатель состояния кардиомиоцитов (МВ-КФК в крови) во 2-й группе (с этоксидолом) оставался в пределах нормальных значений, в то время как в 1-й группе (без этоксидола) он стал выше нормы к концу амбулаторного этапа наблюдения. Полученные данные позволяют сделать вывод о возможном наличии кардиоцитопротекторного свойства у этоксидола.
Первый этап исследования подтвердил гипотезу о возможности предупреждения возникновения нежелательной лекарственной реакции на введение статинов в виде разрушения скелетных мышц и миокарда с помощью дополнительного назначения лекарственного препарата с цитопротекторным свойством.
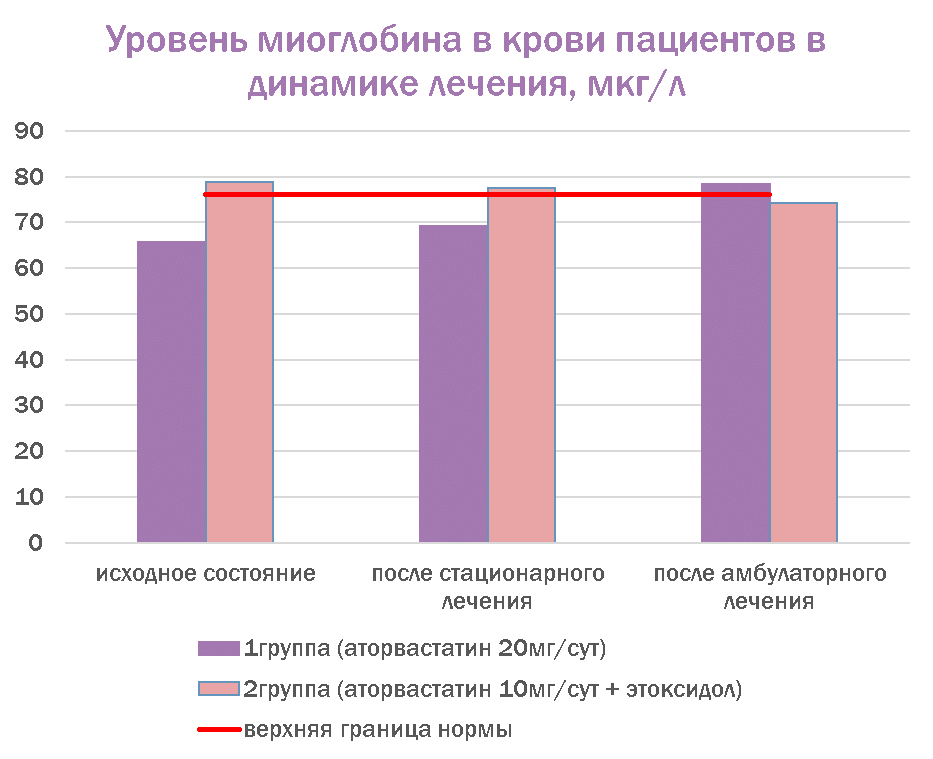
Рис. 1. Уровень миоглобина в крови пациентов в динамике лечения (в сравнении с нормой)
Fig. 1. Myoglobin level in the patients’ blood in the dynamics of treatment (compared to the norm)
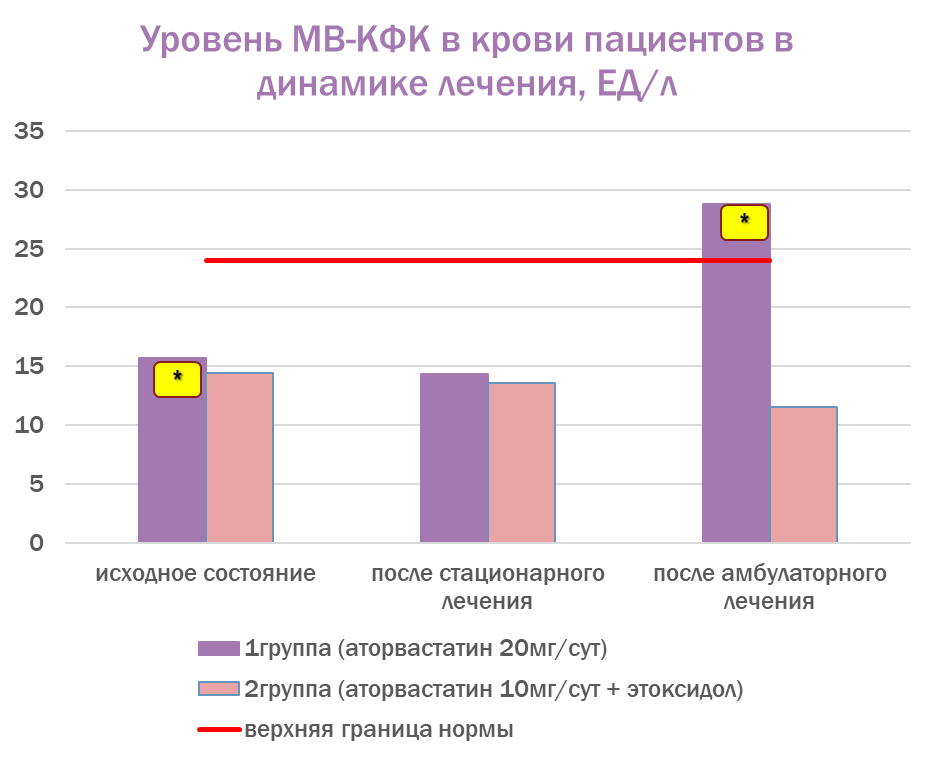
Рис. 2. Уровень МВ-КФК в крови пациентов в динамике лечения (в сравнении с нормой)
Fig. 2. The level of MB-CPK in the patients’ blood in the dynamics of treatment (compared to with the norm)
Примечание. *p < 0,05 – достоверность различий при сравнении между показателями исходного состояния и после амбулаторного этапа лечения внутри группы; МВ-КФК – МВ фракция креатинфосфокиназы.
Второй этап исследования был посвящён разработке персонализированного подхода к применению цитопротекторов с целью минимизации побочных эффектов статинов. Изучали два цитопротектора – триметазидин и этоксидол in vitro.
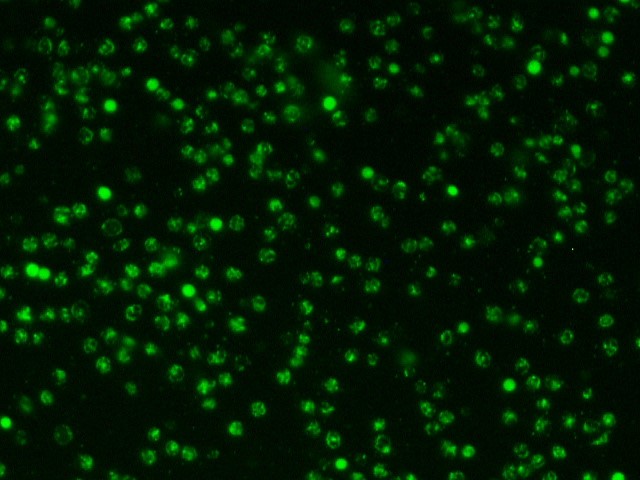
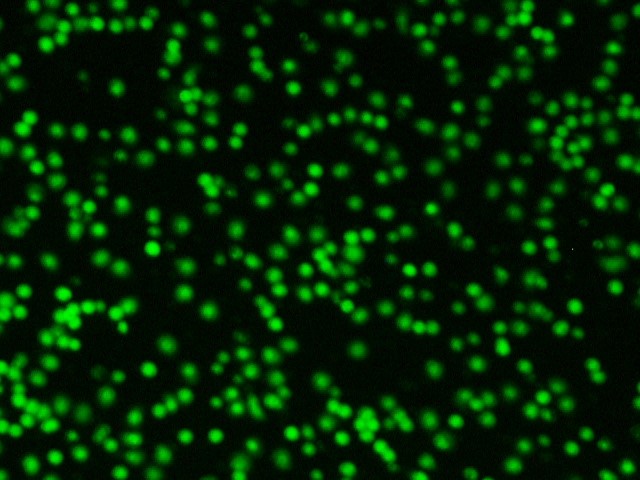
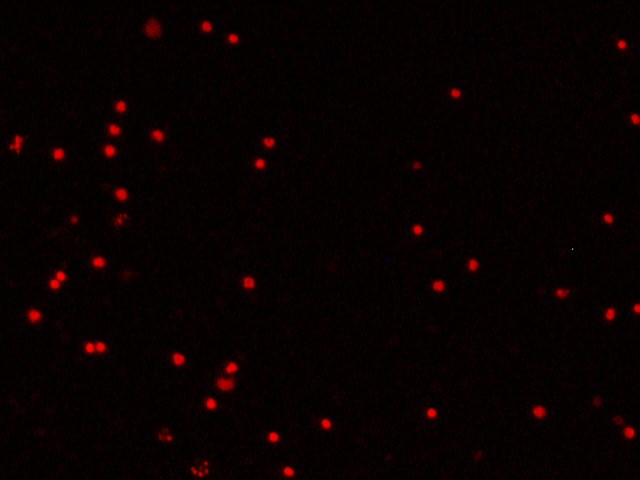
После введения цитопротекторов в лунки с лейкоцитарной взвесью пациентов с ИБС в «терапевтической концентрации» обнаружили два варианта изменения индекса жизнеспособности – в виде его повышения либо снижения, что зависело от исходных показателей анализа крови больных. О цитопротекторном эффекте препарата судили исключительно в случае повышения индекса жизнеспособности, т. е. при увеличении количества живых клеток и уменьшении количества мёртвых клеток в полях зрения (рисунок 3).
|
|
А1. Живые клетки в исходном состоянии | А2. Живые клетки после введения |
|
|
Б1. Мёртвые клетки в исходном состоянии | Б2. Мёртвые клетки после введения |
Fig. 3. Cytoprotective effect of the drug (fluorescence microscopy, 200× magnification)
А1 и А2 – увеличение количества живых клеток в поле зрения после введения цитопротекторного препарата (триметазидина или этоксидола) (окраска Сalcein АМ);
Б1 и Б2 – уменьшение количества мёртвых клеток в поле зрения после введения цитопротекторного препарата (триметазидина или этоксидола) (окраска Ethidium bromide).
Методом прогностического анализа Вальда были установлены критерии отбора больных для назначения того или иного цитопротектора в комплексном лечении ИБС на основании динамики индекса жизнеспособности в сторону увеличения последнего (таблица 2).
Таблица 2
Table 2
Критерии отбора пациентов с ИБС для назначения триметазидина или этоксидола по данным анализа крови (прогностическая модель)
Criteria for the selection of patients with coronary heart disease for prescribing trimetazidine or ethoxidol based on blood test data (prognostic model)
Препарат выбора | Показатель крови | Диапазон значений | ПК | КИ |
Этоксидол | ХС общ., ммоль/л | до 6,6 включительно | -2 | 1,08 |
более 6,6 | +4 | |||
ХС-ЛПВП, ммоль/л | менее 1,6 | +2 | 0,68 | |
более или равно 1,6 | -3 | |||
Триметазидин | ХС общ., ммоль/л | менее 5,3 | +5 | 3,92 |
более или равно 5,3 | -8 | |||
ХС-ЛПОНП, ммоль/л | менее 1,0 | +2 | 0,57 | |
более или равно 1,0 | -3 | |||
Коэффициент атерогенности | менее 3,0 | +4 | 2,79 | |
более или равно 3,0 | -7 | |||
КФК общ., Ед/л | менее 100,0 | -4 | 1,80 | |
более или равно 100,0 | +5 | |||
МВ-КФК, Ед/л | менее 15,0 | -3 | 1,01 | |
более или равно 15,0 | +3 |
Примечание. ПК – прогностический коэффициент (при положительном его значении прогнозируется цитопротекторный эффект препарата, при отрицательном значении – отсутствие такового); КИ – коэффициент информативности признака (чем он выше, тем большая значимость фактора для прогнозирования цитопротекторного эффекта препарата).
Прогностический анализ Вальда показал важную роль параметров липидного профиля в проявлении цитопротекторных эффектов триметазидина и этоксидола при ИБС. Согласно полученным прогностическим коэффициентам, этоксидол демонстрирует пик цитопротекторной активности на фоне гиперхолестеринемии (ХС общ. > 6,6 ммоль/л), в то время как триметазидин – при низких и нормальных значениях общего ХС в крови (≤ 5,3 ммоль/л).
Различия в эффективности могут объясняться особенностями фармакодинамики. Антиоксидант этоксидол нейтрализует реактивные формы кислорода за счет неспаренных электронов, защищая ключевые клеточные структуры (мембраны, митохондрии, ДНК, РНК) от окислительного стресса и поддерживая энергетический метаболизм (синтез АТФ) [Shivakumar et al., 2018; Punetha et al., 2023]. Поскольку перекисные процессы активизируются при высоком уровне холестерина и прогрессировании ИБС [Воробьёва и др., 2010; Волкова и др., 2021], цитопротекторный потенциал этоксидола наиболее востребован именно в таких условиях. Видимо, поэтому для этоксидола наиболее благоприятной клинической ситуацией для проявления своего фармакодинамического эффекта является гиперхолестеринемия. Прямым подтверждением данного предположения является результат нашего предыдущего исследования, в котором была доказана наиболее высокая эффективность включения этоксидола в программу лечения пациентов с ИБС именно при исходной гиперхолестеринемии [Ромащенко и др., 2024].
Механизм действия триметазидина подразумевает переключение клеточного метаболизма с жирового типа на углеводный посредством ингибирования митохондриального фермента 3-кетоацилкоэнзим А тиолазы, вследствие чего происходит подавление бета-окисления свободных жирных кислот и стимуляция гликолиза [Рябихин, 2023]. Такое направление регуляции внутриклеточного метаболизма целесообразно в углеводные фазы активации и резистентности общего адаптационного синдрома (ОАС) и нецелесообразно в жировую фазу истощения [Хохлов и др., 2023]. Поскольку процесс прогрессирования заболевания представляет собой разворачивание общего адаптационного синдрома во времени, нормальный уровень холестерина в крови характерен для начальных стадий активации и резистентности, а гиперхолестеринемия – для конечной стадии истощения ОАС [Виноградов, 1989]. Способность триметазидина проявлять свой цитопротекторный эффект именно при нормальных значениях холестерина в крови полностью соответствует предложенной нами концепции пациентоориентированного подхода к применению лекарственных средств с цитопротекторной активностью у пациентов с ишемической болезнью сердца [Хохлов и др., 2023].
Интересной находкой явилось обнаружение прогностической значимости уровня общей креатинфосфокиназы в крови и её миокардиальной фракции для проявления цитопротекторной активности триметазидина. Оказалось, что триметазидин способен повышать жизнеспособность клеток при повышенных уровнях данных показателей, т. е. при наличии признаков миопатии и миокардиального цитолитического синдрома. Таким образом, можно считать, что в случае развития указанной нежелательной лекарственной реакции на введение статинов прогнозируется высокая эффективность назначения триметазидина как цитопротектора. Индивидуальная целесообразность применения данного препарата в комплексном лечении пациента с ИБС обусловлена наличием фармакодинамической мишени в виде нарушений внутриклеточного метаболизма с признаками цитолиза миокардиоцитов и клеток скелетной мускулатуры [Ромащенко, 2021].
Таким образом, результаты нашего исследования открывают новый путь к профилактике побочных эффектов гиполипидемической терапии с помощью применения персонализированной цитопротекции. Внедрение принципов персонализированной медицины в клиническую практику открывает путь к более эффективной, безопасной и пациентоориентированной помощи при сердечно-сосудистых заболеваниях [Хапохов и др., 2025].
Заключение
Базисная терапия ИБС с аторвастатином 20 мг/сут без «прикрытия» цитопротекторами ассоциируется с развитием миопатии и миокардиального цитолитического синдрома. Добавление к базисному лечению цитопротекторного препарата (этоксидола) сдерживает развитие миопатии у пациентов с ИБС. По данным исследований in vitro, наиболее предпочтительным цитопротектором при нормальных и низких значениях холестерина крови является триметазидин, а при гиперхолестеринемии – этоксидол. Использование персонализированной цитопротекторной терапии как компонента комплексного лечения ИБС можно рассматривать в качестве перспективной стратегии, повышающей безопасность гиполипидемической терапии за счет профилактики ее побочных эффектов.
Thanks
The work was carried out with the financial support of Medimex LLC (Kurgan, Russia).






Reference lists
Andryashkina D.Yu., Klimenko A.A., Karina I.O., Chernyaeva A.Yu., Doronina S.N. 2024. Recommendations for Lipid-Lowering Therapy 2023 – What's New? General Medicine. 1: 37–46 (in Russian). doi: 10.24412/2071-5315-2024-13085
Barbarash O.L., Karpov Yu.A., Panov A.V., Akchurin R.S., Alekyan B.G., Alekhin M.N., Aronov D.M., Harutyunyan G.K., Belenkov Yu.N., Boytsov S.A., Boldueva S.A., Boschenko A.A., Bubnova M.G., Bulkina O.S., Vasyuk Yu.A., Galyavich A.S., Glezer M.G., Golubev E.P., Golukhova E.Z., Grinstein Yu.I., Davidovich I.M., Yezhov M.V., Zavadovsky K.V., Irtyuga O.B., Karpov R.S., Kashtalap V.V., Koziolova N.A., Korennova O.Yu., Kosmacheva E.D., Koshelskaya O.A., Kukharchuk V.V., Lopatin Yu.M., Merkulov E.V., Mironov V.M., Martsevich S.Yu., Mirolyubova O.A., Mikhin V.P., Nedoshivin A.O., Nikulina N.N., Nikulina S.Yu., Oleinikov V.E., Panchenko E.P., Perepech N.B., Petrova M.M., Protasov K.V., Saidova M.A., Samko A.N., Sergienko I.V., Sinitsyn V.E., Skibitsky V.V., Soboleva G.N., Shalaev S.V., Shaposhnik I.I., Shevchenko A.O., Shiryaev A.A., Shlyakhto E.V., Chumakova G.A., Yakushin S.S. 2024. Clinical Practice Guidelines for Stable Coronary Artery Disease. Russian Journal of Cardiology. 2024; 29(9): 6110 (in Russian). doi: 10.15829/1560-4071-2024-6110
Vinogradov V.V. 1989. Hormones, Adaptation and Systemic Reactions of the Organism. Minsk: Science and Technology. – 223 p. (in Russian).
Volkova M.V., Ragino Y.I. 2021. Modern Biomarkers of Oxidative Stress Estimated by Immuno-Enzymal Analysis. Ateroscleroz. 17(4): 79–92 (in Russian). doi:10.52727/2078-256X-2021-17-4-79-92
Vorobiova E.N., Simonova G.I., Vorobiov R.I., Leschenko I.G. 2010. Free-Radical Oxidation and Atherosclerosis. Ateroscleroz. 6(2): 20–27 (in Russian).
Ezhov M.V., Sergienko I.V., Kukharchuk V.V. 2023. Clinical Guidelines for Lipid Disorders. 2023. What's New. Atherosclersis and Dyslipidemias. 3(52): 5–9 (in Russian). doi: 10.34687/2219–8202.JAD.2023.03.0002
Ezhov M.V., Chubykina U.V., Dmitriev V.A. 2023. Difficulties in Achieving Target Levels of Low-Density Lipoprotein Cholesterol in Patients with Atherosclerotic Cardiovascular Diseases in Real Clinical Practice. Atherosclerosis and Dyslipidemia. 4: 27–34 (in Russian). doi: 10.34687/2219-8202.JAD.2023.04.0003
Iskova I.A., Klyaritskaya I.L., Tsapyak T.A., Krivoy V.V., Maksimova E.V. 2021. Statin-Induced Myopathy. Crimean Therapeutic Journal. 3: 64–70 (in Russian).
Karpov Yu.A. 2023. A New Vector for Reducing Cardiovascular Risk – Intensive Lipid-Lowering Therapy. Atmosphere. Cardiology news. 1: 3–10 (in Russian). doi: 10.24412/2076-4189-2023-12836
Kukharchuk V.V., Ezhov M.V., Sergienko I.V., Arabidze G.G., Bubnova M.G., Balakhonova T.V., Gurevich V.S., Kachkovsky M.A., Konovalov G.A., Konstantinov V.O., Malyshev P.P., Pokrovsky S.N., Sokolov A.A., Sumarokov A.B., Gornyakova N.B., Obrezan A.G., Shaposhnik I.I. 2020. Diagnostics and Correction of Lipid Metabolism Disorders for the Prevention and Treatment of Atherosclerosis. Russian Guidelines, VII Revision. Atherosclerosis and dyslipidemia. 1: 7–40 (in Russian). doi: 10.34687/2219-8202.JAD.2020.01.0002
Larionov P.M., Malov A.N., Mandrik M.M., Maslov N.A., Orishich A.M. 2003. Changes in the Spectrum of Laser-Induced Fluorescence of Myocardial Tissue as its Viability Decreases. Journal of Applied Spectroscopy. 70(1): 38–42 (in Russian). doi: 10.1023 / A: 1023212206592
Leonova M.V. 2022. Effects of nocebo and drusebo in Determining Statin-Induced Muscle Symptoms. Meditsinskiy Sovet. 16(17): 136–142 (in Russian). doi:10.21518/2079-701X-2022-16-17-136-142
Mitroshina E.V., Mishchenko T.A., Vedunova M.V. 2015. Determination of the Viability of Cell Cultures. Study Guide. Nizhny Novgorod: 21p. (in Russian).
Pateyuk I.V. 2024. Statins in the Treatment of Patients with Dyslipidemia: General Principles and Algorithm for Choosing a Drug. Recipe. 27(2): 166–179 (in Russian). doi:10.34883/PI.2024.27.2.003
Pokrovsky M.V., Romashchenko O.V., Nadezhdin S.V., Morozova A.V., Savvina Yu.A. 2020. Method for Determining the Cytoprotective Properties of a Medicinal Product. Know-How Certificate No. 336 Dated November 9, 2020. Belgorod, National Research University "BelGU" (in Russian).
Romashchenko O.V. 2021. Personalized Approaches to the Administration of Trimetazidine as a Cytoprotector in Patients with Coronary Heart Disease. Russian Journal of Cardiology. 6: 106–114 (in Russian). doi: 10.15829/1560-4071-2021-4532
Romashchenko O.V., Khokhlov A.L., Alferov P.K., Yakunchenko T.I., Pyatakovich F.A., Mevsha O.V. 2024. Effect of the Combination of Atorvastatin and Ethylmethylhydroxypyridine Malate on the Lipid Profile in Patients with Coronary Heart Disease. Actual Problems of Medicine, 47(4): 449–464 (in Russian). doi: 10.52575/2687-0940-2024-47-4-449-464
Ryabikhin E.A. 2023. Rational Therapy of Patients with Ischemic Heart Disease, what will the Addition of Trimetazidine Give us? Are We Using All the Possibilities in the Treatment of Patients with Ischemic Heart Disease? Atmosphere. Cardiology News. 2: 46–51 (in Russian). doi: 10.24412/2076-4189-2023-12867
Sergienko I.V. 2023. Russian Clinical Guidelines for Lipid Metabolism Disorders. 2024. What's New? RMJ. 4: 12–16 (in Russian).
Soboleva N.I. 2020. Undesirable Side Effects of Statins in the Treatment of Elderly Patients. Clinical Gerontology. 26(5–6): 34–38 (in Russian). doi: 10.26347/1607-2499202005-06034-038
Susekov AV. 2024. Statins in the Practice of an Internal Medicine Specialist: A Review. Consilium Medicum. 26(10): 641–648 (in Russian). doi: 10.26442/20751753.2024.10.202995
Khapokhov I.M., Ryazanov A.S., Melnikova L.V., Makarovskaya M.V. 2025. Personalized Approach to the Management of Patients with Cardiovascular Diseases in Outpatient Practice (Literature Review). News of Higher Educational Institutions. Volga Region. Medical Sciences. 1(73): 99–114 (in Russian). doi: 10.21685/2072-3032-2025-1-8
Khokhlov A.L., Romashchenko O.V., Rumbesht V.V., Alferov P.K., Grishchenko N.D., Gorbach T.V., Kukes V.G. 2023. The General Concept of a Patient-Oriented Approach to the Use of Drugs with Cytoprotective Activity in Patients with Coronary Heart Disease. Patient-Oriented Medicine and Pharmacy. 1(3): 1–14 (in Russian). doi: 10.37489/2949-1924-0019
Chaulin A.M. 2022. The Main Side Effects of Statins in Clinical Practice. Clinical Practice. 13(2): 98–107 (in Russian). doi: 10.17816/clinpract108076
Chaulin A.M., Duplyakov D.V. 2023. Statins and Highly Sensitive Cardiac Troponins: Cardiotoxicity or Cross-Reactivity? Rational Pharmacotherapy in Cardiology. 19(2): 209–216 (in Russian). doi: 10.20996/1819-6446-2023-04-01
Grundy S.M., Stone N.J., Bailey A.L., Beam C., Birtcher K.K., Blumenthal R.S. 2019. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: Executive Summary: A Report of the American College of Cardiology / American Heart Association Task Force on Clinical Practice Guidelines. J. Am. Coll. Cardiol. 73(24): 3168–3209. doi: 10.1016/j.jacc.2018.11.002
Khokhlov A.L., Romaschenko O.V., Rumbesht V.V., Yakunchenko T.I., Zhernakova N.I., Zakirova L.R., Kukes V.G. 2024. Leukocyte as an Adequate Model for Studying Changes in Energy Metabolism in Heart Cells under the Influence of Cardiocytoprotectors in Myocardial Ischemia. Acta biomedica scientifica. 9(5): 114–121. doi:10.29413/ ABS.2024-9.5.12
Mach F., Baigent C., Catapano A.L., Koskinas K.C., Casula M., Badimon L. 2020. ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the Management of Dyslipidaemias: Lipid Modification to Reduce Cardiovascular Risk. Eur. Heart. J. 41(1): 111–188. doi: 10.1093/eurheartj/ehz455
Masana L., Plana N., Andreychuk N., Ibarretxe D. 2023. Lipid Lowering Combination Therapy: From Prevention to Atherosclerosis Plaque Treatment. Pharmacological Research. 190: 106738. doi: 10.1016/j.phrs.2023.106738
Punetha M., Saini S., Chaudhary S., Bala R., Sharma M., Kumar P., Kumar D., Yadav P.S. 2023. Mitochondria-Targeted Antioxidant MitoQ Ameliorates ROS Production and Improves Cell Viability in Cryopreserved Buffalo Fibroblasts. Tissue Cell. 82: 102067. doi: 10.1016/j.tice.2023.102067
Ray K.K., Reeskamp L.F., Laufset U. 2022. Combination Lipid-Lowering Therapy as First-Line Strategy in Very High-Risk Patients. European Heart Journal. 43(8): 830–833. doi:10.1093/eurheartj/ehab718
Shivakumar A., Yogendra Kumar M.S. 2018. Critical Review on the Analytical Mechanistic Steps in the Evaluation of Antioxidant Activity. Crit. Rev. Anal. Chem. 48(3): 214–236. doi: 10.1080/10408347.2017.1400423
Yurkovich J.T, Hood L. 2019. Blood Is a Window into Health and Disease. Clinical Chemistry. 65(10): 1204–1206, doi:10.1373/clinchem.2018.299065
Wei J., Gao D.F., Wang H., Yan R., Liu Z.Q., Yuan Z.Y., Liu J., Chen M.X. 2014. Impairment of Myocardial Mitochondria in Viral Myocardial Disease and its Reflective Window in Peripheral Cells. PLoS One. 9(12): e116239. doi: 10.1371/journal.pone.0116239