DifficultiesinDiagnosingPeritonealMesothelioma (RareClinicalCase)
Annotation
The goal of the study was to draw the attention of surgeons, angiosurgeons, infectious disease specialists and oncologists to non-standard predictors of peritoneal mesothelioma development and peculiarities of its diagnostics. The artice presents the analysis of publications on the diagnosis of malignant peritoneal mesothelioma and our own clinical observation with unusual disease debut: cervical lymphadenopathy, thrombosis of the branches of the superior vena cava, bilateral exudative pleurisy. Diagnostic algorithm of peritoneal mesothelioma consists of analyzing the results of clinical examination with sequential application of ultrasound, multispiral computed tomography of the neck, thoracic, abdominal and small pelvis organs with intravenous bolus contrast (MSCTAG), positron emission tomography combined with computed tomography (PET/CT). Endovideoscopy with histologic and immunohistochemical examination of peritoneal biopsy specimens using mesothelial lineage antibodies and epithelial markers is the final and clarifying method of diagnostics of malignant peritoneal mesothelioma.
Keywords: peritoneal mesothelioma, non-standard predictors of development, MSCTAG, PET/CT, endovideolaparoscopy, immunohistochemistry of peritoneal biopsies
Unfortunately, the article is available only in Russian
Введение
В 2022 г. в России выявлено впервые 624 835 случаев злокачественных новообразований, прирост по сравнению с 2021 г. составил 7,6 % [Каприн и др., 2022]. В клинической практике чаще встречается мезотелиома плевры, она составляет от 80 до 90 % случаев злокачественных мезотелиом. Мезотелиома брюшины – довольно редкий подтип, она наблюдается лишь в 6–10 % случаев [Ishizuka et al., 2021; Chun et al., 2023], а по данным, приведенным в практических рекомендациях RUSSCO, – в 15–20 % случаев [Волкова и др., 2023], в то же время авторы отмечают, что по России статистических данных по заболеваемости и смертности по данной патологии нет. По данным международной группы по изучению мезотелиом, представленным на 16-й Международной конференции в г. Лилль (2023), стандартизованные по возрасту показатели заболеваемости на 100 000 населения среди мужчин в Англии и Австралии составили 3,4 и 3,2 человека, а в Австрии и Польше – меньше 1 человека на 100 000 населения [Барболина, Багрова, 2023]. В базе данных с 1975 по 2016 г., приведенной исследователями, зарегистрировано 1 998 пациентов с первичной мезотелиомой брюшины, из них европеоидная раса встретилась у 90,4 %, мужчины составили 56,2 %, средний возраст постановки диагноза составил 69 ± 13 лет [Ullah et al., 2022].
По мнению большинства исследователей, основным этиологическим фактором мезотелиомы считается контакт с асбестом, особенно амфиболовые варианты, а также вермикулит, цеолит, флюорит и хризотил-асбест [Барболина, Багрова, 2023; Sousa et al., 2023]. Кроме асбеста в развитии мезотелиомы имеют значение и другие химические канцерогены (силикаты, бериллий, жидкий парафин) [Волков и др., 2023]. Другими причинами возникновения мезотелиомы считаются радиация, хроническое воспаление, генетическая предрасположенность. Некоторые исследователи связали развитие мезотелиомы брюшины у пациента с туберкулезом легких в анамнезе [Subahi et al., 2024]. Мезотелиома плевры и мезотелиома брюшины по мнению других исследователей являются абсолютно самостоятельными нозологиями [Hiltbrunner et al., 2022].
Диффузная мезотелиома брюшины наблюдается значительно чаще, чем локализованный тип [Kuribayashi et al., 2022; Sousa et al., 2023] она была обнаружена в 45, а локализованная форма встретилась в 15 случаях. Диффузная форма имеет неблагоприятный прогноз: 5-летняя общая выживаемость составляет 20,0 ± 5,9 % [Kusamura et al., 2023]. Среди неблагоприятных прогностических факторов отмечают пожилой возраст, мужской пол, стадию заболевания, саркоматоидную и двухфазную гистологические формы опухоли, ответ на лечение, общесоматический статус, потерю массы тела, исходный уровень гемоглобина и лейкоцитов [Волков и др., 2023; Verma et al., 2018]. Медиана выживаемости в группе пациентов, которым выполняли циторедуктивные операции с гипертермической внутрибрюшинной химиотерапией, выше и составляет от 34 до 92 месяцев [Verma et al., 2018]. Злокачественная мезотелиома брюшины из-за редкой встречаемости и неспецифических, потенциально вводящих в заблуждение клинических проявлений чрезвычайно трудно поддается диагностике [Huang et al., 2022; Zeng et al., 2022; Alhamadh et al., 2023]. Данное клиническое наблюдение представляет интерес в плане обсуждения нестандартного развития дебюта злокачественной мезотелиомы брюшины, а также дифференциальной диагностики с перитонеальным канцероматозом.
Цель: Обратить внимание хирургов, ангиохирургов, инфекционистов и онкологов на нестандартные предикторы развития злокачественной мезотелиомы брюшины и особенности её диагностики.
Материалы и методы: анализ литературных данных и ретроспективный анализ истории болезни пациента с мезотелиомой брюшины, осложненной лимфаденопатией, тромбозом ветвей верхней полой вены и двухсторонним экссудативным плевритом.
Описание клинического случая
Пациент М., 47 лет, считает себя больным в течение месяца, когда на фоне удовлетворительного состояния стала ежедневно подниматься температура тела, появилась слабость и быстро начала снижаться масса тела. В анамнезе контакт с асбестом и другими химическими канцерогенами не отмечает. Спустя две недели у пациента появились отечность лица и правой половины шеи, нарастающая одышка. 11.12.2023 при МСКТ выявлены отек и инфильтрация жировой клетчатки вокруг правой внутренней яремной вены от уровня С7 до С2 с количественной региональной лимфаденопатией. Зафиксированы также участки пневмофиброза и множественные буллы в правом легком, правосторонний умеренный гидроторакс, небольшой гидроперикард и внутригрудная лимфаденопатия. Пациенту были назначены цефтриаксон 1,0 в/м 1 раз в сутки в течение 10 дней и ривароксабан 2,5 мг 2 раза в день; состояние не улучшалось.
12.12.23 больной был госпитализирован в отделение торакальной хирургии ГБУЗ РМ «РКБ № 4». Общее состояние средней тяжести, температура тела – 37,9 С. При осмотре в правой передне-боковой поверхности шеи и правой надключичной областях обнаружен отек, а при пальпации – умеренно смещаемые конгломераты безболезненных плотно-эластической консистенции увеличенных лимфатических узлов. Тоны сердца приглушены, частота сердечных сокращений 118 уд./мин. Над нижней долей левого легкого выслушивалось ослабленное везикулярное дыхание, а над нижней долей правого легкого оно не проводилось, при перкуссии там же определялся тупой звук. Частота дыхательных движений составляла 23 в мин. SpO2 – 95%. Печень и селезенка не увеличены, пальпация их безболезненна.
При УЗ обследовании 12.12.23 зафиксированы двухсторонний гидроторакс, в правой надключичной области и передне-боковой поверхности шеи обнаружены два конгломерата лимфатических узлов с нарушениями их структуры и дифференцировки, размерами 4,0×1,6 см (надключичные) и 8,5×1,5 см (боковые шейные), тромбоз правой внутренней яремной и правой подключичной вен, диффузные изменения поджелудочной железы, гемангиома левой доли печени, выпот в брюшной полости в небольшом количестве, патологии щитовидной железы не выявлено. На ЭХОКС от 12.12.23 зафиксирован небольшой выпот в полости перикарда. Общий анализ крови от 12.12.23: гемоглобин – 96 г/л, эритроциты 3,7×1012/л, лейкоциты – 18,6×109/л, нейтрофилы – 46 %, лимфоциты – 38 %, моноциты – 16 %,
СОЭ – 57 мм/ч. Биохимический анализ крови от 12.12.23: креатинин – 56 мкмоль/л, мочевина – 3,0 ммоль/л, АлАТ – 18,5 U/l, АсАТ – 18,8 U/l, общий белок – 66 г/л, глюкоза –
5,3 ммоль/л. В коагулограмме от 13.12.2023: тромбоциты 680×109/л, фибриноген – 5,0 г/л, протромбиновый индекс – 85 %, МНО – 1,18, АЧТВ – 50,1 сек.
Установлен диагноз: двухсторонний плеврит неясной этиологии, шейная и медиастинальная лимфаденопатия, острый тромбоз правой внутренней яремной и подключичной вен. При пункции правой плевральной полости 14.12.2024 получено 1 100 мл соломенно-желтого цвета жидкости, атипических клеток в ней не обнаружено. Жидкость из правой плевральной полости затем удалялась 1 раз в неделю по 1 л; из левой плевральной полости – по 200 мл. Состав плеврального экссудата: лимфоциты – 75–85 %, эозинофилы – 5–20 %, нейтрофилы – 5–10 %, макрофаги, дегенеративно измененные клетки мезотелия. Атипических клеток и КУМ в плевральной жидкости и мокроте не обнаруживали. При ФБС от 14.12.23 установлены признаки атрофического бронхита.
При ЭГДФС от 15.12.23 выявлены аксиальная грыжа пищеводного отверстия диафрагмы, острая язва антрального отдела желудка, эрозивный гастрит, косвенные признаки панкреатита. Консультирован фтизиатром и инфекционистом: данных за туберкулез легких и острый инфекционный процесс не выявлено. ЦДС внечерепных отделов брахиоцефальной артерии (БЦА) от 19.12.23: атеросклероз БЦА без гемодинамически значимого стеноза. Окклюзионный тромбоз правой внутренней яремной вены и ее ветвей, брахиоцефальной и позвоночных вен. Неполная реканализация правой подключичной вены. Лимфатические узлы не увеличены. При МСКТ от 22.12.23: патологических изменений мягких тканей шеи не определяется. В анализах крови от 26.12.2024: прокальцитонин 0,2 нг/мл, СРБ – 161 мг/л, ферритин – 760 нг/мл. Аутоиммунная диагностика от 29.12.23: антитела к двуспиральной ДНК – 1,4 Ед/мл (норма <20); антинуклеарный фактор на клеточной линии с определением 6 типов свечения: HEp-2 <1:160 (норма <1:160), тип свечения АНФ HEp-2 – AC0; антитела к протеиназе-3 0,4 RU/ml (<20) – антитела не обнаружены; антитела к миелопероксидазе 0,2 RU/ml (<20) – антитела не обнаружены.
МСКТ АГ от 09.01.24: диффузное утолщение большого сальника (канцероматоз брюшины?), небольшой асцит, локальное утолщение стенки прямой кишки, мягкотканных образований подкожно-жировой клетчатки передней брюшной стенки, кардио-диафрагмальных синусов, гепатомегалии, диффузных изменений паренхимы печени по типу «жирового гепатоза», аденомы правого надпочечника, пупочной грыжи (рис. 1, 2).
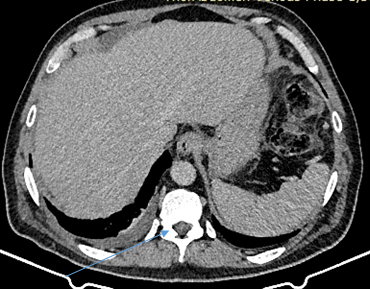
Рис. 1. МСКТ АГ, аксиальный срез от 09.01.2024.
В правой плевральной полости жидкость и плотные фестончатые структуры (стрелка)
Fig. 1. MSCT AG, axial slice dated 09/01/2024.
Fluid and dense festooned structures in the right pleural cavity (arrow)
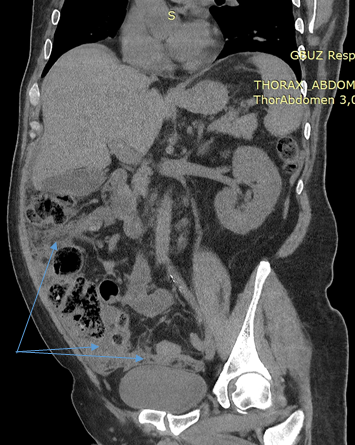
Рис. 2. МСКТ АГ органов брюшной полости, парасагиттальный срез от 09.01.2024.
Диффузное утолщение большого сальника, асцит (стрелки)
Fig. 2. MSCT AG of abdominal cavity organs, parasagittal section dated 09/01/2024.
Diffuse thickening of the omentum, ascites (arrows)
Колоноскопия от 10.01.24: органической патологии толстой кишки не выявлено.
12.01.24 выполнена диагностическая лапароскопия. В брюшной полости жидкость желтовато-серого цвета, на передней поверхности правой доли печени, большом сальнике и брыжейке тонкой и ободочной кишок имеются множественные образования в виде белесоватых бляшек округлой формы до 3 мм в диаметре. Большой сальник отечный, имеет мелкобугристую структуру с участками уплотнений. Цитологическое исследование от 15.01.24: цитограмма выпота с наличием элементов злокачественного новообразования. Гистологическое исследование брюшины (бляшек) от 17.01.2024: материал представлен злокачественной опухолью, формирующей железистоподобные, розеткообразные и солидные структуры, мономорфные клетки с округлыми ядрами, митотическая активность повышена. Окружающая строма склерозирована. Морфологическая картина соответствует метастазу ацинарного рака поджелудочной железы. УЗИ от 18.01.24: в левой плевральной полости жидкость (сепарация до 13 мм) над диафрагмой. Динамики по структуре печени нет. Поджелудочная железа: головка 38 мм, тело – 16,6 мм, хвост – 25 мм. Контуры ровные. Структура неоднородная, гиперэхогенная. Четких узловых образований не выявлено. Исследование крови от 19.01.24 на содержание гастрина – 38,3 пг/мл (норма 13,0–115,0).
Гистологические препараты консультированы 29.01.2024 в ООО «Лаборатория Гемотест», г. Москва: микроскопия биопсийного материала: фрагменты опухоли, представленной гнездами из атипических клеток с обильной эозинофильной цитоплазмой, умеренно полиморфными ядрами без ядрышек. Встречаются атипические митозы. ИГХ исследование проведено с маркерами: PanCK, CK7, GAT A3, Calretinin, WT1 – выявлена позитивная реакция в опухолевых клетках, Ki-67 – позитивная реакция в 15–17 % опухолевых клеток. CK20, Chromogranin, TTF-1, p63 и ER – в опухолевых клетках экспрессия отсутствует. Заключение: морфологическая картина с учетом ИГХ-исследования соответствует мезотелиоме брюшины.
ЦДС сосудов шеи от 22.01.24: тромбоз правой внутренней и наружной яремных вен, брахиоцефальной и позвоночных вен в стадии неполной реканализации. Неокклюзионный тромбоз левой брахиоцефальной вены. Коагулограмма от 22.01.2024: фибриноген – 12,8 г/л, тромбиновое время – 16 сек, антитромбин-тест – 101 %, протромбиновый индекс – 73 %, МНО – 1,35, протромбиновое время – 14,8 сек, протромбиновое отношение – 1,36, АЧТВ – 36,4 сек. Анализ крови общий от 24.01.2024: гемоглобин – 65 г/л, эритроциты – 2,93×1012/л, лейкоциты – 14,9×109/л, тромбоциты – 754×109/л, СКФ – 89,2 мл/мин. ИФА крови от 24.01.2024: серотонин – 75,63 нг/мл, хромогранин А – 42,62 мкг/л.
ПЭТ/КТ от 13.02.2024: зафиксированы метаболическая активность неопластической ткани по ходу большого сальника, брюшины, лимфатических узлов парапанкреатической клетчатки, умеренная метаболическая активность по ходу красного костного мозга. Количественная внутригрудная и ретроперитонеальная лимфаденопатия. Умеренная метаболическая активность левой половины мошонки. Правосторонний гидроторакс. Асцит. Тромбоз правой подключичной, правой внутренней яремной вены, верхней полой вены. Гепатомегалия. Аденома правого надпочечника.
В течение всего периода госпитализации отмечалось повышение температуры до 37,60 С, которую удавалось купировать только после введения дексаметазона. Пациент получал лечение: гепарин 7500 ЕД 4 раза в сутки, левенокс, цефтриаксон, ципрофлоксацин, ванкомицин, тигециклин, кламосар, дексаметазон, кеторол, ребамипид по 300 мг, ксарелто по 20 мг и диосмин 600 мг в сутки. Выписан 24.02.2024 на лечение в онкологический диспансер с диагнозом: Мезотелиома брюшины IV ст. (T4N2M1) c распространением на большой сальник, висцеральную брюшину, лимфатические узлы параперикардиальной клетчатки, с поражением красного костного мозга. Осложнения: Двухсторонний гидроторакс. Асцит. Вторичная анемия. Тромбоцитоз. Тромбоз левой внутренней и наружной яремных вен, левой подключичной и верхней полой вен в стадии реканализации.
С 29.02.2024 по 04.03.2024 и с 25.03.2024 по 28.03.2024 пациент находился на лечении в ГБУЗ РМ «Республиканский онкологический диспансер», где получал курсами паллиативную полихимиотерапию (ПХТ) 1 линии: пеметрексед 500 мг/м2 и карбоплатин 845 мг AUC-5 внутривенно капельно. 29.02.2024 и 04.03.2024 при пункции из обеих плевральных полостей удалено по 1 л соломенно-желтого цвета жидкости, атипических клеток в ней не обнаружено. В анализе крови от 25.03.2024: гемоглобин – 93 г/л, эритроциты – 3,79×1012/л, лейкоциты 18,6×109/л, лимфоциты – 7,6 %, моноциты – 6,5 %, нейтрофилы – 85 %, тромбоциты 818×109/л, фибриноген – 9,22 г/л, протромбиновый индекс – 60 %, МНО – 1,60, АЧТВ – 57,5 сек. В дополнение к ПХТ больной получал ежедневно рибоксин 200 мг, коргликард 0,6 мг внутривенно струйно, дексаметазон 8 мг, цефтриаксон 2,0, 4 % раствор калия хлорида 20 мл, 5 % раствор глюкозы 250 мл и стерофундин 500,0 внутривенно капельно.
Больной продолжает лечение, однако состояние не улучшается, беспокоят прогрессирующая слабость, одышка, отсутствие аппетита, вздутие живота.
Заключение
Большинство случаев мезотелиомы брюшины на ранних стадиях протекают бессимптомно или неспецифично, поэтому диагноз устанавливается в среднем через четыре – пять месяцев от появления симптомов [Chun et al., 2022; Huang et al., 2022; Sousa et al., 2023; Sun et al., 2023]. В дебюте заболевания у пациентов с мезотелиомой брюшины по мнению Sousa et al. (2023) редко наблюдаются признаки паранеопластического синдрома, однако в представленном наблюдении первыми симптомами были лихорадка, слабость, быстрая потеря массы тела, прогрессируюшая анемия, лейкоцитоз, тромбоцитоз, что согласуется с публикацией Liang et al. (2024). Следующим клиническим признаком в наблюдении явилась лимфаденопатия. О случае метастазирования мезотелиомы брюшины в надключичные и медиастинальные лимфатические узлы сообщают Zannella et al. (2014). Обнаруженные конгломераты безболезненных лимфатических узлов в сочетании с медиастинальной локализацией вызвали предположение о злокачественном характере процесса. Кроме того, маскировка злокачественного характера процесса, возможно, была обусловлена применением глюкокортикостероидов, о чем сообщают также Ali et al. [2022]. Однако воспалительный характер лимфаденопатии косвенно подтвердил факт рассасывания конгломерата через три недели от начала лечения, что послужило отказом для проведения биопсии лимфатических узлов [Коваль и др., 2021; Verma, Khera, 2020].
Развитие острого тромбоза правой яремной и подключичной вены из-за сдавления увеличенными лимфатическими узлами в представленном случае согласуется с Sun et al. (2023), которые наблюдали окклюзию и тромбоз верхней полой вены при злокачественной мезотелиоме брюшины в сочетании с медиастинальной лимфаденопатией. С другой стороны, связать однозначно данный факт с воспалительным характером патологии нельзя, так как, несмотря на проведение адекватной антикоагулянтной терапии (гепарин 30 тыс. ЕД/сут и показатели коагулограммы), через 12 дней присоединился тромбоз левой брахиоцефальной вены, что может свидетельствовать в пользу развития синдрома Труссо. Так, Leci-Tahiri et al. (2018) также ведущей причиной спонтанного двухстороннего тромбоза внутренних яремных вен считают развитие синдрома Труссо, среди возможных причин также указывают на внешнее сдавление вены.
Несмотря на выявление только пролиферирующих и дегенеративных клеток мезотелия при повторных цитологических исследованиях плевральной жидкости, можно предположить, что причиной двухстороннего плеврита является метастазирование клеток злокачественной мезотелиомы брюшины непосредственно через диафрагму или её лимфатические каналы, аналогичное предположение представлено Zeng et al. (2022). Учитывая неспецифический характер клинико-лабораторных признаков мезотелиомы брюшины, основная роль в топической диагностике локальных проявлений, по данным многих исследователей, принадлежит МСКТ АГ [Carlson et al., 2022; Sousa et al., 2023]. При дифференцировке злокачественной мезотелиомы от карциноматоза брюшины показано, что КТ обладает диагностической чувствительностью в 53 %, специфичностью в 100 % и точностью в 68 % случаев [Carlson et al., 2022], особое значение она приобретает при прогнозировании и планировании стратегии лечения [Sugarbaker et al., 2021].
При невозможности определения злокачественного характера мезотелиомы и для сопоставления с результатами морфологического исследования биопсийного материала показано применение ПЭТ/КТ [Kuribayashi et al., 2022; Zeng et al., 2022]. Цитологическая диагностика мезотелиомы затруднена тем, что имеются сходные признаки между мезотелиальными и метастатическими (карциномы) клетками и реактивными изменениями мезотелия с клетками мезотелиомы [Rao et al., 2022], а также тем, что во многих случаях эти клетки не удается обнаруживать.
Мезотелиому брюшины необходимо дифференцировать с канцероматозом брюшины при раке яичников, раке желудка и др. [Волков и др., 2023]. Ведущая роль в морфологической верификации мезотелиомы брюшины принадлежит иммуногистохимической диагностике. Результаты, полученные в данном клиническом наблюдении, согласуются с приведенными в исследовании [Tandon et al., 2018]. Положительными маркерами при мезотелиоме брюшины в порядке чувствительности ими были представлены: кальретинин (100 %), WT1 (94 %), CK5/6 (89 %), мезотелин (88 %) и D2-40 (80 %). Маркеры, которые использовали авторы для дифференцировки карциномы от мезотелиомы, показали иммунореактивность при мезотелиоме брюшины: рецептор эстрогена (2 %), B72.3 (3 %), CK20 (4 %), CD15 (4 %), p63 (5 %), РЭА (5 %), PAX8 (6 %), рецептор прогестерона (7 %), Ber-EP4 (8 %) и CD138 (10 %). Тараканова и др. (2023) показали, что при затруднениях в морфологической диагностике мезотелиомы необходимо применять не только цитологические, гистологические и иммуноморфологические методы (иммуноцитохимия и иммуногистохимия), а в некоторых случаях и молекулярно-генетический метод (FISH) для определения делеции гена p16/CDKN2A.
Выводы
- Трудности диагностики злокачественной мезотелиомы брюшины связаны с чрезвычайной редкостью патологии и неспецифическим характером паранеопластических симптомов в дебюте заболевания.
- Затруднение в диагностике в представленном клиническом наблюдении обусловлено нестандартными предикторами развития заболевания: шейная и медиастинальная лимфаденопатия на фоне пролонгированной гипертермии, прогрессирующий тромбоз ветвей верхней полой вены, упорное течение двухстороннего плеврита, нечеткость результатов цитологического и гистологического методов исследований, на которые мы обращаем внимание профильных специалистов.
- При появлении подозрения на мезотелиому брюшины считаем необходимым проводить топическую диагностику со скринингового неинвазивного УЗ-исследования, для уточнения локализации и характера процесса – МСКТ АГ и затем, при необходимости – ПЭТ/КТ. Для морфологической верификации мезотелиомы рекомендуем использовать видеолапароскопию с гистологическим и гистохимическим исследованием биопсийного материала.
- Дифференциальная диагностика сложна, и в основном её приходится проводить с канцероматозом брюшины и метастазами рака иных и неустановленных локализаций в брюшину.
Thanks
The work was carried out without external sources of funding.





Reference lists
Barbolina T.D., Bagrova S.G. 2023. Sovremennyye podkhody k diagnostike i lecheniyu mezoteliomy [Modern Approaches to the Diagnosis and Treatment of Mesothelioma]. Obzor materialov konferentsii IMIG-2023. Chast′ 1: mezotelioma plevry. Zlokachestvennyye opukholi. 13(3s1): 140.
Volkov N.M., Barbolina T.D., Borisova T.N., Vladimirova L.Yu., Den′gina N.V., Levchenko E.V. 2023. Prakticheskiye rekomendatsii po lekarstvennomu lecheniyu mezoteliomy plevry, bryushiny i drugikh lokalizatsiy [Practical Recommendations for Drug Treatment of Mesothelioma of the Pleura, Peritoneum and Other Localizations]. Prakticheskiye rekomendatsii RUSSCO, chast′ 1. Zlokachestvennyye opukholi. 13(3s2): 72–88. doi: 10.18027/2224-5057-2023-13-3s2-1-72-88
Kaprin A.D., Starinskiy V.V., Shakhzadova A.O. 2022. Sostoyaniye onkologicheskoy pomoshchi naseleniyu Rossii v 2022 godu [The State of Cancer Care for the Population of Russia in 2022]. M., MNIOI im. P.A. Gertsena − filial FGBU «NMITS radiologii» Minzdrava Rossii: 239.
Koval′ T.I., Izyumskaya E.M., Marchenko E.G., Priymenko N.O., Kotelevskaya T.M., Bodnar V.A. 2021. Limfadenopatiya: algoritm diagnostiki i taktika vedeniya patsiyenta [Lymphadenopathy: Diagnostic Algorithm and Patient Management Tactics]. Klinicheskaya infektologiya i parazitologiya. 10(2): 187–199. doi: 10.34883/PI.2021.10.2.025.
Tarakanova O.V., Slavnova E.N., Tyusheva V.V., Bol′shakova D.A. 2023. Morfologicheskaya diagnostika mezoteliomy. Klinicheskiy sluchay [Morphological Diagnosis of Mesothelioma. Clinical case]. Novosti klinicheskoy tsitologii Rossii. 27(1): 15–19. doi: 10.24412/1562-4943-2023-1-0003
Alhamadh M.S., Alanazi R.B., Wadaan O.M., Alhabeeb A.Y., Alkaiyat M., Aljarbou O.Z., Sabatin F. 2023. Thrombocytosis as a Paraneoplastic Syndrome in Metastatic Malignant Peritoneal Mesothelioma of Biphasic Morphology Mimicking Ovarian Adenocarcinoma: A Case Report. Clin. Case Rep. Mar 2, 11(3): e6974. doi: 10.1002/ccr3.6974
Ali M., Elhatw A., Hegazy M., Albeyoumi H., Sakr N., Deyab A.M., Soliman A.Y., Said E., Samir Elbehwashy A., Nassar M., Alfishawy M. 2022. The Evaluation of Lymphadenopathy in a Resource-Limited Setting. Cureus. 14(10): e30623. doi: 10.7759/cureus.30623
Carlson B., Harmath C., Turaga K., Kindler H.L., Armato S.G. 3rd, Straus C. 2022. The Role of Imaging in Diagnosis and Management of Malignant Peritoneal Mesothelioma: A Systematic Review. Abdom. Radiol. (NY). 47(5): 1725–1740. doi: 10.1007/s00261-022-03464-x
Chun C.P., Song L.X., Zhang H.P., Guo D.D., Xu G.X., Li Y., Xin X., Cao J., Li F. 2023. Malignant Peritoneal Mesothelioma. Am. J. Med. Sci. 365(1): 99–103. doi: 10.1016/j.amjms.2022.07.008
Hiltbrunner S., Fleischmann Z., Sokol E., Zoche M., Felley-Bosco E. 2022. Genomic Landscape of Pleural and Peritoneal Mesothelioma Tumours. Br. J. Cancer. 127(11): 1997–2005
Huang X., Hong Y., Xie S.Y., Liao H.L., Huang H.M., Liu J.H., Long W.J. 2022. Malignant Peritoneal Mesothelioma with Massive Ascites as the First Symptom: A Case Report. World J. Clin. Cases. 10(28): 10317–10325. doi: 10.12998/wjcc.v10.i28.10317
Kuribayashi K., Kitajima K., Minami T., Ikeda M., Yamakado K., Kijima T. 2022. Malignant Peritoneal Mesothelioma Features Shown by FDG-PET/CT. Cancer Diagn. Progn. 2(6): 654–660. doi: 10.21873/cdp.10156
Kusamura S., Baratti D., De Simone M., Pasqual E.M., Ansaloni L., Marrelli D., Robella M., Accarpio F., Valle M., Scaringi S., Biacchi D., Palopoli C., Gazzanelli S., Guaglio M., Deraco M. 2023. Diagnostic and Therapeutic Pathway in Diffuse Malignant Peritoneal Mesothelioma. Cancers (Basel). 15(3): 662. doi: 10.3390/cancers15030662
Leci-Tahiri L., Zherka-Saracini H., Tahiri A., Koshi A. 2018. Bilateral Internal Jugular Vein Thrombosis Due to Malignant Tumor. Med. Case Reports. 12(1): 42. doi: 10.1186/s13256-017-1556-0
Liang X.L., Su Y.D., Li X.B., Fu Y.B., Ma R., Yang R., Wu H.L., Li Y. 2024. Risk Factors and Prognosis of Malignant Peritoneal Mesothelioma with Paraneoplastic Syndrome. World J. Surg. Oncol. 22(1): 29. doi: 10.1186/s12957-024-03312-w
Rao N., Wei S. 2022. Mesothelioma. Cytojournal. 19(10). doi: 10.25259/cmas_02_08_2021.
Sousa B., Silva J., Monteiro N., Romano M., Araújo E. 2023. Malignant Peritoneal Mesothelioma: A Case Report. Cureus. 15(8): e42902. doi: 10.7759/cureus.42902
Subahi E.A., Fadul A., Mohamed A., Alsayed A., Ali E.A., Sayed S., Mustafa S., Wazwaz B., Fadul M.H. 2024. Biphasic Peritoneal Mesothelioma Is a Rare Tumor and a Diagnostic Challenge: A Case Report. Cureus. 16(1): e51725. doi: 10.7759/cureus.51725
Sugarbaker P.H., Chang D., Jelinek J.S. 2021. Concerning CT Features Predict Outcome of Treatment in Patients with Malignant Peritoneal Mesothelioma. Eur. J. Surg. Oncol. 47(9): 2212–2219. doi: 10.1016/j.ejso.2021.04.012
Sun L., Li Ch., Gao Sh. 2023. Diffuse Malignant Peritoneal Mesothelioma: A Review. Front. Surg. 6(9): 1015884. doi: 10.3389/fsurg.2022.1015884
Tandon R.T., Jimenez-Cortez Y., Taub R., Borczuk A.C. 2018. Immunohistochemistry in Peritoneal Mesothelioma: A Single-Center Experience of 244 Cases. Arch. Pathol. Lab. Med. 142(2): 236–242. doi: 10.5858/arpa.2017-0092-OA
Ullah A., Waheed A., Khan J., Mishra A., Tareen B., Nama N., Karki N.R., Panezai M.S., Zarate L.V., White J., Cason F.D., Matolo N., Misra S., Karim N.A. 2022. Incidence, Survival Analysis and Future Perspective of Primary Peritoneal Mesothelioma (PPM): A Population-Based Study from SEER Database. Cancers (Basel). 14(4): 942. doi: 10.3390/cancers14040942
Verma R., Khera S. 2020. Cervical Lymphadenopathy: A Review. Int. J. Health Sci. Res. 10(10): 292–298.
Verma V., Sleightholm R.L., Rusthoven C.G., Koshy M., Sher D.J., Grover S., Simone C.B. (2018). Malignant Peritoneal Mesothelioma: National Practice Patterns, Outcomes, and Predictors of Survival. Annals of Surgical Oncology. 25(7): 2018–2026. doi: 10.1245/s10434-018-6499-1
Zannella S., Testi M.A., Cattoretti G., Pelosi G., Zucchini N. 2014. Peritoneal Malignant Mesothelioma Metastatic to Supraclavicular Lymph Nodes. Int. J. Surg. Pathol. 22(6): 552–554. doi: 10.1177/1066896913520037
Zeng X., Xu K., Zhang L., Huang X. 2022. Challenging Diagnostic Process for a Malignant Peritoneal Mesothelioma Patient with Ascites and Pleural Effusion: A Case Report and Review of the Literature. Front. Oncol. 15(12): 784064. doi: 10.3389/fonc.2022.784064