Modeling of Craniofacial Lesions, Analysis of Regeneration Time and Indications for Surgical Correction
Annotation
The purpose of the experiment. Experimental modeling of craniofacial injuries, analysis of oculomotor function and regeneration in the post-traumatic period. Materials and methods. In the experiment, 48 sexually mature males of the Wistar breed were hit with a blunt hammer on a pre-determined area on the muzzle. According to the MS CT data, the nature of the displacement of bone fragments and the presence of muscle interposition were visualized. In the post-traumatic period, behavioral activity in the Actimeter device was analyzed. Results and discussion. Taking into account the thickness of the bone, the localization of the buttress at the place of applied force in the rodent, the hypothesis of energy absorption with its propagation through the bone structures of the orbits, and their subsequent displacement, was confirmed. Conclusions. In 38% of animals (groups 2 and 4), after impact to the postero lateral segment of the lower wall of the orbit, type 2 fracture of the cheekbone-orbital complex was recorded. In the post-traumatic period, a violation of behavioral activity was registered, which required prompt correction of displaced fragments. Upon impact to the central segment, in 50% of cases, 1 type of fracture was formed, without deviations in behavioral activity and without the need for surgical treatment.
Keywords: regeneration, craniofacial lesions, cheekbone-orbital fracture, experimental model, oculomotor function, behavioral reactions
Unfortunately, the article is available only in Russian
Введение
Сочетанные краниофациальные повреждения по данным отечественных и зарубежных специалистов достигают 75 % от общего числа травм головы и лица, когда в той или иной степени в патологический процесс вовлекаются кости носа, скуло-орбитального комплекса, верхняя челюсть, структуры передней и средней черепных ямок [Hasanov, 2024; Taniguchi, 2024]. Сложная анатомия указанных структур предопределяет их взаимозависимую функциональную активность, в том числе с органом зрения. В норме физиологические процессы оптимально и функционально взаимосвязаны между различными мимическими группами, клапанными механизмами, органами дыхания, органом зрения, гидравлическим давлением в полости черепа, другими анатомическими структурами [Martel, 2021; Кim, 2024]. Из общего числа сочетанных повреждений количество изолированных переломов скуло-орбитального комплекса не превышает 25 % [Schlittler, 2018; Valencia, 2021]. И те и другие переломы без своевременной коррекции являются причиной эстетически негативных следов на лице, нередко сочетающихся с соматическими дисфункциями. Ряд отечественных и зарубежных авторов акцентирует внимание на так называемых «взрывных» изолированных переломах стенок орбиты, скуло-орбитального комплекса, подразделяя их на типы с подтипами, детализируя вовлеченность глазодвигательных структур в патологический процесс. И ранее клиницисты рассматривали механизмы травм, их следствия сквозь призму прямолинейного вектора прикладываемой силы, угол передачи энергии, пренебрегая массой ранящего предмета ввиду отсутствия технических средств для выполнения сложных экспериментов. Сторонники гипотезы, предложенной R. LeFort (1901), описывали основной механизм разрушения нижней стенки орбиты как волновую деформацию, передаваемую от подглазничного края [Moura, 2021; Song, 2023], рассматривали её как горизонтальную либо как вращательную деформацию [Al-Sukhun, 2023] в зависимости от направления сил, действующих на нее [Kearney, 2021; Modabber, 2024; Wu, 2024]. Также высказывалось мнение о том, что максимальная площадь перелома возникает, когда ранящий объект движется снизу вверх под углом 30º к подглазничному краю [Jacobs, 2019; Nagasao, 2022; Cieplucha, 2024]. Для унификации диагностического стандарта, модернизации способов хирургического лечения переломов краниофациальной локализации генерирована рабочая концепция, частично представлена в данной работе. В эксперименте после травмы, по данным МС КТ, визуализированы, детализированы смещения фрагментов, характер, объём сочетанных и изолированных повреждений костных структур скуло-орбитального комплекса. Изучая нарушения поведенческих реакций, обусловленных глазодвигательными дисфункциями, анализируя процессы регенерации в посттравматическом периоде моделируемой изолированной травмы, сформулирована цель и задачи исследования.
Материалы и методы
Исследование выполнялось на базе вивария НИИ фармакологии живых систем НИУ «БелГУ». В качестве экспериментальных животных выбраны самцы крыс, которых содержали в индивидуально вентилируемых клетках «Tecniplast» с автоматически контролируемыми температурой и влажностью при циркадном 12-часовом режиме освещения день/ночь. Экспериментальная часть исследования осуществлялась в соответствии с «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (1986), а также по правилам лабораторной практики при проведении доклинических исследований в РФ, по постановлению РФ «Принципы надлежащей лабораторной практики» [GOST 91500.13.0001-2003; GOSTR 33647-2015] и «Об утверждении правил надлежащей лабораторной практики» (Минздрав РФ, приказ № 199н от 1 апреля 2016 г.). Количество в исследовании животных – 48, разделение осуществляли рандомно на 4 группы, по 12 голов в каждой. Статистически значимые выбросы по критерию Шовене в измеряемых параметрах определялись как критерий исключения [Миронов, 2012; Хафисианова, 2013]. Эти исключенные из эксперимента животные заменялись повторными опытами, так что общее количество животных в группе составило 12 грызунов массой 180–320 гр. Травма наносилась тупым предметом с использованием закрытой техники при помощи прецизионного импактора 68099 Ⅱ Precise Impactor – Built for Speed (USA, RWD Life Science Co) (рисунок 1).
Повреждения визуализировали на МС КТ Philips Brilliance 64 СКТ с 64 срезами (Нидерланды). В условиях хлорал гидратного наркоза из расчета 450 мг/кг 15 мкг на кг массы тела животного путем внутрибрюшинного введения достигали состояния глубокой седации.

Рис. 1. Прецизионный импактор 68099 Ⅱ Precise Impactor–Built for Speed (USA, RWD Life Science Co)
Fig. 1. Ⅱ Precise Impactor 68099 – Built for Speed (USA, RWD Life Science Co)
Животных разделили на 4 группы по 12 голов в зависимости от локализации прикладываемой силы и скорости перемещения ударника прецизионного импактора (рисунок 2).
В 1-й группе животных с массой 180–220 гр. удар наносили в проекцию центрального сегмента нижней стенки орбиты со скоростью 5,6 м/с, площадью бойка ударника в 4 мм и массой 325 грамм.
Во 2-й группе животных с массой 230–320 гр. удар наносили в проекцию заднелатерального сегмента нижней стенки орбиты со скоростью 5,6 м/с, площадью бойка ударника диаметром в 4 мм и массой 325 грамм, той же массы.
В 3-й группе животных с массой 180–220 гр. удар наносили в центральный сегмент нижней стенки орбиты со скоростью 2,4 м/с, площадью бойка ударника диаметром в 4 мм и массой 325 грамм.
В 4-й группе животных с массой 230–320 гр. удар наносили в точку, соответствующую заднелатеральному сегменту нижней стенки орбиты, со скоростью 2,4 м/с, площадью бойка ударника диаметром в 4 мм и массой 325 грамм.
 Рис. 2. Часть животных, участвующих в эксперименте, выполнение МС КТ
Рис. 2. Часть животных, участвующих в эксперименте, выполнение МС КТ
Fig. 2. Animals participating in the experiment, MC CT stage
По результатам МС КТ, 1 тип повреждений нижней стенки орбиты без вовлечения мягкотканого компонента выявлен у 24 животных (50 %); 2 тип перелома нижней стенки орбиты с вовлечением мягкотканого компонента выявлен у 18 животных (38 %); полный (тотальный) перелом (многооскольчатый) (ПТП) выявлен у 2 животных (4 %); линейный перелом (ЛП) без смещения отломков выявлен у 4 животных (8 %) (таблица 1).
Таблица 1
Table 1
Разделение животных по группам согласно типу перелома
Breakdown of animals according to fracture type
Тип перелома | 1 тип | 2 тип | ПТП | ЛП |
Группа |
|
|
|
|
1 | 10 (22 %) | 6 (13 %) | 1 (2 %) |
|
2 | 5 (10 %) | 4 (8 %) | – | 2 (4 %) |
3 | 3 (6 %) | 5 (10 %) | 1(2 %) |
|
4 | 6 (13 %) | 3 (6 %) | – | 2 (4 %) |
Жизнеспособность животных как критерий реакции на полученную травму оценивали по поведенческой активности на аппарате Actimeter (инфракрасный), модель LE8825, компании Panlab Harvard Apparatures с программным обеспечением Actitrack v2.7.13 в режиме открытого поля (рисунок 3).
Рис. 3. Контрольная панель для оценки поведенческих реакций на аппарате Actimeter модель LE8825 компании Panlab Harvard Apparatures
Fig. 3. Control panel for evaluating behavioral responses on the device Actimeter Model LE8825 Panlab Harvard Apparatures
Автоматизировано анализировали общую и локомоторную активность, стереотипность поведения животных, число и продолжительность эпизодов вставания на задние лапы. Исследование проводили в помещении с сумеречным освещением, с поочерёдным размещением животных в двухмерных квадратных рамках с подставкой 45×45 см, непрозрачной подложкой, окрашенной в черный цвет с разбивкой поля на 9 квадратов.
Статистический анализ
Статистический анализ данных проводился с использованием пакета STATISTICA, version 10.0 (Stat Soft, Inc.). Количественные данные представлены в виде M ± σ, где М – среднее значение, σ – стандартное отклонение. Сравнение количественных показателей между группами проводилось с помощью критерия Стьюдента. Все различия считались значимыми при р < 0,05.
Результаты исследования
В ходе исследования ни одно животное не выбывало из эксперимента.
В группах исследования у 18 животных (38 %) зарегистрирован 2-й тип перелома (рисунок 4).
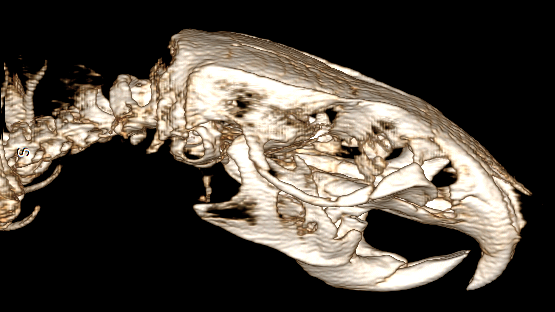
Рис. 4. Животное № 132, 2 тип – перелом скуло-орбитального комплекса
Fig. 4. Animal 132, 2 type – fracture of cheekbone-orbital complex
Учитывая малые размеры животного, соизмеряя толщину кости с пропорциями скелета человека, определено их соотношение по следующим анатомическим структурам. По ширине глазницы у животного 6,2 ± 0,8 мм, соответствовал размеру у человека в 41,5 ± 2,2 мм, по высоте глазницы у животного – 6,5 ± 0,5 мм, у человека – 33,8 ± 2,2 мм, что позволило соотнести координаты так называемых «типичных» мест перелома и наносить удар максимально корректно. Заблаговременно определяли силу, корректировали глубину погружения ударника, что обеспечивало получение модели сочетанной травмы нескольких костей лицевого скелета, без прямого повреждения структур головного мозга. Отсутствие прямого воздействия на структуры головного мозга, данная травма расценена как изолированная, что нашло подтверждение в данном исследовании. Всё же у двух МЖ посредствам волновой передачи кинетической энергии к структурам головного мозга зарегистрированы ПР, соответствовавшие сотрясению головного мозга, в связи с чем всё последующее экспериментальное моделирование проводилось с ещё большим соблюдением мер профилактики повреждений головного мозга, ограничив глубину погружения ударника в периферические структуры костей морды МЖ не более чем на 4 мм. После нанесения прицельного удара в центральный сегмент скуло-орбитального сочленения линейное смещение кости с надкостницей выявлено у 4 (8 %) животных. С клинической точки зрения смещение фрагментов с сохранённым контактом, без признаков нарушения жизнедеятельности и биомеханических функций, а также без отклонений ПР не требует репозиции.
Во 2-й и 4-й группах у 18 животных (38 %) со 2 типом перелома зафиксирована возросшая локомоторная активность с грубыми поведенческими нарушениями, что соответствовало данным контрольной панели актиметра. При анализе частоты указанных перемещений в течение 20 минут установлено, что у животных со 2 типом перелома двигательная активность сократилось до 6,4 ± 2,2 пересечений при норме 100. Предположено, что отсутствие адекватной реакции грызунов на инфракрасный свет и звуковые сигналы обусловлено очаговыми повреждениями головного мозга (рисунок 5) в ответ на травматическое воздействие, степень которых зависит не только от скорости, силы удара, но и масс взаимодействующих объектов. Выявленные повреждения головного мозга свидетельствуют о многообразии неизученных закономерностей, анализ которых планируется при создании следующей модели.
У 18 животных (38 %) со 2 типом перелома визуализировано смещение костных фрагментов кнутри, что соответствовало траектории раневого канала и подтверждено наличием «капкан» при анализе нативных срезов МС КТ. Регистрируемые в актиметре нарушения жизнедеятельности сопровождались снижением числа пересечений инфракрасных линий на платформе до 6,4 ± 2,2 при полном отсутствии вставаний на задние лапы в ответ на звуковые раздражители. Также отмечена разбалансировка движений с мало амплитудным тремором и «шаткостью» зарегистрированных при передвижении животных в life режиме.
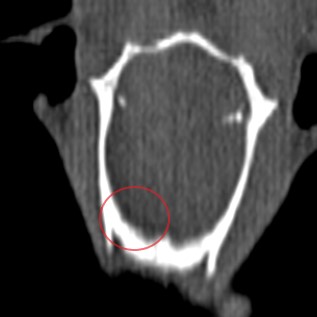
Рис. 5. Животное № 132, 2 тип – перелом скуло-орбитального комплекса, МС КТ признаки гематомы ГМ в правой лобной доле
Fig. 5. Animal No. 132, type 2 – fracture of the cheekbone-orbital complex, MС CT signs of hematoma GM in the right frontal lobe
В 1 и 3 группах у 13 животных (28 %) после нанесения травмы зарегистрированы нарушения поведенческих реакций, но интерпозиции мягкотканых структур не выявлено. Число пересечений инфракрасных линий составило 25,2 ± 4,8, что в 4 раза ниже значений у здоровых животных. Зарегистрированные результаты с клинической точки зрения характеризуются как «приходящие» неврологические нарушения, что в этих случаях, вероятно, напрямую обусловлено острым дефицитом функциональной активности глазодвигательного аппарата. По мере купирования явлений травматического отёка и регресса компрессии, глазодвигательных и проводящих нервные импульсы структур, отмечена положительная динамика поведенческих реакций. Период наступления положительных сдвигов соответствовал срокам купирования явлений травматического отёка без медикаментозной коррекции. У 2 животных (4 %) с первых посттравматических суток отмечены субконъюктивальные кровоизлияния, суффузии, на основании чего высказано предположение о повреждении сосуда в мягких тканях, и вероятной имбибицией глазодвигательной мышцы. Данное предположение косвенно подтверждено длительным периодом реабилитации, который в три раза превышал срок при сравнении с животными, имевшими аналогичные клинические проявления. Поведенческие реакции в полном объёме у этих двух животных так и не восстановились, что вероятнее всего обусловлено формированием рубцовой контрактуры глазодвигательных структур. Морфологический анализ высказанных предположений запланирован на период выведения животных их эксперимента.
У 8 (16 %) животных из 2 и 4 групп визуализировано смещение фрагментов кнутри, с мышечной интерпозицией. При мониторинге поведенческой активности выявлено, что количество пересечений инфракрасных линий на платформе сократилось в два раза – до 53 ± 5. Произвольное вставание на задние лапы в ответ на звуковой сигнал возникало каждый раз, без задержек и «шаткости», но в несвойственные положения. Очевидно, что выявленные отклонения ПР – следствие посттравматической дисфункции глазодвигательного аппарата, коррекция которых без устранения интерпозиции невозможна.
У 24 животных (50 %) 1 и 3 групп количество пересечений инфракрасных линий на платформе составило 98 ± 8,2 раз. Показатели двигательной активности оставались в норме, вставание на задние лапы при звуковом сигнале возникало каждый раз, без задержек и «шаткости» при изменении положения тела животного. Этим животным хирургическая коррекция полученной травмы не требовалась.
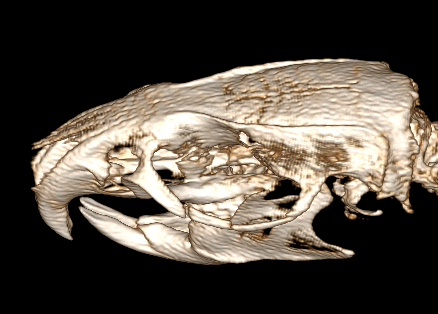
Рис. 6. Животное, участвующее в эксперименте 52, 1 тип – перелом нижней стенки орбиты
Fig. 6. Animal participating in experiment 52, type 1 – fracture of the lower orbital wall
Обсуждение полученных результатов
В доступной литературе публикаций, посвящённых моделированию травм морды МЖ в данном формате с использованием прецизионного импактора не найдено, что подтверждает актуальность темы и выбранного пути научных изысканий. Для получения наиболее точных данных проведена калибровка шага (глубины) погружения рабочей части (с интервалом 0,1 мм) травмирующего инструмента, что соответствовало максимально реалистичному эффекту [Diotalevi, 2023].
По данным исследований [Leconte, 2020; Roseanna, 2021; Wai, 2021], грызуны проявляют «избыточную» активность в замкнутом пространстве, и это выражается увеличением числа пересечений линий на платформе актиметра, у здоровых животных не менее 100 за 20 мин в ответ на световой раздражитель, что принято за референсное значение. В настоящем эксперименте поведенческая активность у 18 (38 %) со 2 типом перелома сократилась до 6,4 ± 2,2 на фоне грубых нарушений глазодвигательной функции, что обусловлено смещением фрагментов с потребностью хирургической коррекции.
Выводы
По данным МС КТ у 100 % обследуемых животных изучен характер смещения костных фрагментов, объем повреждений соединительно-тканных, мягкотканых структур, вовлеченность глазодвигательного аппарата. Последний критерий анализировали в привязке к нарушениям поведенческих реакций, скорости наносимого удара, массе животного. После удара, нанесённого со скоростью 2,4 м/с в заднелатеральный сегмент скуло-орбитального сочленения, у 5 (10 %) 3 группы МЖ с массой 180–220 гр зарегистрировано смещение фрагментов по 2 типу с пролабированием мягких тканей глазницы в щель перелома с нарушениями ПР – снижением локомоторной и общей активности, сокращением числа пересечений инфракрасных линий на 16,3 % до 6,4 ± 2,2 в сравнении с референсными значениями. У 6 (13 %) животных 1 группы с массой 230–320 гр пересечение инфракрасных линий на платформе сокращалось в два раза – до 53 ± 5 актов, что в 8 раз выше, чем у животных 3 группы с массой 180–220 гр.
У 11 (23 %) животных 2 и 4 групп (1 тип перелома) с массой 230–320 гр пересечение инфракрасных линий на платформе сокращалось в два раза – до 53 ± 5 актов, что в 8 раз выше, чем у животных 1 и 3 групп 11 (23 %) (2 тип перелома) с массой 180–220 гр.
По данным МС КТ, у двух (4 %) животных со 2 типом перелома зарегистрированы повреждения головного мозга, что свидетельствует о деформационно-волновой передаче кинетической энергии ранящего агента. Высокая частота нарушений поведенческой активности у 54 % (26) животных со 2 типом перелома в посттравматическом периоде, вероятно, обусловлена расстройством глазодвигательной функции за счёт дислокации глазодвигательных структур. В посттравматическом периоде в проекции порочно стоящих фрагментов (животные со 2 типом перелома) визуализировано формирование костной мозоли с преобладанием деструктивных явлений, что, вероятно, обусловлено нарушением оптимального кровоснабжения и иных механизмов репаративной регенерации. По полученным результатам запланированы дальнейшие исследования, проводится наблюдения, мониторинг ПР в позднем реабилитационном периоде.
Thanks
The work was carried out without external sources of funding.





Reference lists
Mironov A.N., Bunyatyan N.D., Vasilyev A.N., Verstakov O.L., Zhuravleva M.V., Lepakhin V.K., Korobov N.V., Merkulov V.A., Orekhov S.N., Sakaeva I.V., Uteshev D.B., Yavorsky A.V. 2012. Guidelines for Pre-Clinical Drug Research. Scientific Center of Examination of Means of Medical Application of the Ministry of Health and Development of Russia. P. 944 (in Russian).
Khafisianova R.H., Burykin I.M., Aleeva G.N. 2013. Classification of Defects of Pharmacotherapy as a Basis for Assessment of Quality of Drug Therapy in Healthcare. Bulletin of Siberian Medicine. 12(3): 82–91. https://doi.org/10.20538/1682-0363-2013-3-82-91 (in Russian).
Al-Sukhun J.A. 2023. Novel Method to Reconstruct the Upper and Lower Jaws Using 3D-Custom-Made Titanium Implants. J. Craniofac. Surg. 1; 34(3): e244-e246. doi: 10.1097/SCS.0000000000009088
Cieplucha M., Yaïci R., Bock R., Moayed F., Bechrakis N.E., Berens P., Feltgen N., Friedburg D., Gräf M., Guthoff R., Hoffmann E.M., Hoerauf H., Hintschich C., Kohnen T., Messmer E.M., Nentwich M.M., Pleyer U., Schaudig U., Seitz B., Geerling G., Roth M. 2024. Chat GPT und die deutsche Facharztprüfungfür Augenheilkunde: eine Evaluierung [ChatGPT and the German board examination for ophthalmology: an evaluation]. Ophthalmologie. doi: 10.1007/s00347-024-02046-0
Diotalevi L., Mac-Thiong J.M., Wagnac E., Petit Y. 2023. Contribution of Impactor Misalignment to the Neurofunctional Variability in Porcine Spinal Cord Contusion Models. Annu. Int. Conf. IEEE Eng. Med. Biol. Soc. doi:10.1109/EMBC40787.2023.10340195
Hasanov F., Davudov M., Isgandarova S. 2024. New Approach in Management of Orbital Adherence Syndrome. J. Craniofac. Surg. doi: 10.1097/SCS.0000000000010143
Jacobs S.M., Sharifi E., Wu L., Howe K., Le T.P., Mitsumori L., Ching R., Jian-Amadi A. 2019. Association between Pre- and Intraorbital Soft Tissue Volumes and the Risk of Orbital Blowout Fractures Using CT-Based Volumetric Measurements. Orbit. (4): 269–273. doi: 10.1080/01676830.2018.1509097
Kearney A.M., Shah N., Zins J., Gosain A.K. 2021. Fifteen-Year Review of the American Board of Plastic Surgery Maintenance of Certification Tracer Data: Clinical Practice Patterns and Evidence-Based Medicine in Zygomatico-Orbital Fractures. Plast. Reconstr. Surg. 1; 147(6): 967e-975e. doi: 10.1097/PRS.0000000000007955
Кim H., Kim K.H., Koh I.C., Lee G.H., Lim S.Y. 2024. Delayed Treatment of Traumatic Eyeball Dislocation Into the Maxillary Sinus and Treatment Algorithm: a Case Report and Literature Review. Arch. Craniofac. Surg. 25(1): 31–37. doi: 10.7181/acfs.2023.00535
Leconte C., Benedetto C., Lentini F., Simon K., Ouaazizi C., Taib T., Cho A., Plotkine M., Mongeau R., Marchand-Leroux C., Besson V.C. 2020. Histological and Behavioral Evaluation after Traumatic Brain Injury in Mice: A Ten Months Follow-Up Study. J. Neurotrauma. 1; 37(11): 1342–1357. doi: 10.1089/neu.2019.6679
Martel A., Bougaci N., Lagier J., Almairac F., Dagain A. 2021. Post-Traumatic Orbitorrhea: An Underestimated Life-Threatening Complication Following Anterior Skull Base Fractures. Eur. J. Ophthalmol. 31(2): 123–125. doi: 10.1177/1120672119867827
Modabber A., Winnand P., Ooms M., Heitzer M., Ayoub N., von Beck F.P., Raith S., Prescher A., Hölzle F., Mücke T. 2024. The Impact of Orbital Floor Defect Ratio on Changes in the Inferior Rectus Muscle and Prediction of Posttraumatic Enophthalmos – A Cadaver Study. Ann. Anat. doi: 10.1016/j.aanat.2024.152294
Moura L.B., Jürgens P.C., Gabrielli M.C., Pereira Filho V.A. 2021. Dynamic Three-Dimensional Finite Element Analysis of Orbital Trauma. Br. J. Oral. Maxillofac. Surg. 59(8): 905–911. doi: 10.1016/j.bjoms.2020.09.021
Nagasao T., Miyanagi T., Wu L., Hatano A., Morotomi T. 2022. Hardness of Artificial Bone and Vulnerability of Reconstructed Skull-A Biomechanical Study. Eplasty. 15; 22:41
Roseanna V.M. 2021. Re: Use of CAD-based Pre-Bent Implants Reduced Theatre Time in Orbital Floor Reconstruction: Results of a Prospective Study. Br. J. Oral. Maxillofac. Surg. 59(6): 728. doi: 10.1016/j.bjoms.2020.10.287
Schlittler F., Schmidli A., Wagner F., Michel C., Mottini M., Lieger O. 2018. What Is the Incidence of Implant Malpositioning and Revision Surgery After Orbital Repair? J. Oral. Maxillofac. Surg. 76(1): 146–153. doi: 10.1016/j.joms.2017.08.024
Song C., Luo Y., Huang W., Duan Y., Deng X., Chen H., Yu G., Huang K., Xu S., Lin X., Wang Y., Shen J. 2023. Extraocular Muscle Volume Index at the Orbital Apex with Optic Neuritis: a Combined Parameter for Diagnosis of Dysthyroid Optic Neuropathy. Eur. Radiol. 33(12): 9203–9212. doi: 10.1007/s00330-023-09848-x
Taniguchi H., Nishioka H., Kuriyama E., Inoue Y., Okumoto T. 2024. Craniofacial Fracture with Superior Orbital Fissure Syndrome Resulting in Pupil-sparing Oculomotor Nerve Palsy. Plast. Reconstr. Surg. Glob. Open. 12(5): 5828. doi: 10.1097/GOX.0000000000005828
Valencia M.R., Miyazaki H., Ito M., Nishimura K., Kakizaki H., Takahashi Y. 2021. Radiological Findings of Orbital Blowout Fractures: a Review. Orbit. 40(2): 98–109. doi: 10.1080/01676830.2020.1744670
Wai K.M., Wolkow N., Yoon M.K. 2021. Displaced Bone Fragment Simulating an Orbital Foreign Body. Orbit. 40(4): 344–345. doi:10.1080/01676830.2020.1775263
Wu K.Y., Fujioka J.K., Daigle P., Tran S.D. 2024. The Use of Functional Biomaterials in Aesthetic and Functional Restoration in Orbital Surgery. J. FunctBiomater. 15(2): 33. doi: 10.3390/jfb15020033