Application of Intravascular Ultrasound During Percutaneous Coronary Interventions in Controversial Cases and Complex Atherosclerotic Lesions
Annotation
The aim of the study is to present our own experience of using intravascular ultrasound (IVUS) for making a clinically informed decision to perform percutaneous coronary intervention (PCI) in a particular patient. Material and methods: A 65-year-old patient with angina pectoris and a positive exercise test, which revealed horizontal ST depression in the chest leads, underwent diagnostic coronary angiography, which diagnosed stenosis of up to 50 % of the trunk of the left coronary artery (LCA). In this connection, IVUS was performed to make a decision on the advisability of performing PCI. According to IVUS data, the area of narrowing of the LCA trunk was 60 %. There is a “torn” edge of the intima of the vessel with severe calcification in the largest segment of the narrowing, which indicates the “instability” of the atherosclerotic plaque. The patient underwent PCI with stenting of the LCA trunk with a transition to the proximal segment of the anterior descending artery (LAD) due to the spread of an atherosclerotic plaque at the mouth of the LAD. Conclusion: IVUS plays an important role in the decision to perform PCI in controversial cases and complex atherosclerotic lesions.
Keywords: intravascular ultrasound, coronary artery disease, clinically informed decision, percutaneous coronary intervention, controversial cases, complex atherosclerotic lesions
Unfortunately, the article is available only in Russian
Введение
Коронарография (КАГ), являясь «золотым» стандартом диагностики ишемической болезни сердца и эталоном принятия решения о необходимости проведения процедур реваскуляризации миокарда, имеет некоторые ограничения, не позволяющие оценить, кроме анатомической структуры коронарной артерии и степени стеноза, особенности атеросклеротической бляшки (АБ) (признаки нестабильности АБ, наличие тонкой покрышки АБ) и особенности локальной гемодинамики в прилегающем к ней сосудистом бассейне [Cheng et al., 2014; Lee et al., 2019; Gaba et al., 2023]. Накопленный опыт клинических исследований за последние десятилетия говорит о превалирующей роли выявления признаков ишемии миокарда, а не значения степени стеноза коронарной артерии для последующего принятия решения о проведении процедур реваскуляризации миокарда у пациентов со стабильной стенокардией напряжения [Karády et al., 2020; Montone et al., 2021; Raftopoulos et al., 2022]. Именно поэтому применение дополнительных методик, таких как внутрисосудиcтое ультразвуковое исследование (ВСУЗИ) и оценка фракционного резерва кровотока во время КАГ, получили свое отражение в текущих клинических рекомендациях [Neumann et al., 2019; Lawton et al., 2022] и чаще стали применяться не только в научных исследованиях, но и в реальной клинической практике [Koo et al., 2022]. Важной отличительной особенностью ВСУЗИ является возможность точного выявления «нестабильной» АБ и АБ с тонкой капсулой, наличие которых в разы увеличивает риски развития сердечно-сосудистых осложнений у пациентов при проспективном наблюдении, особенно при их локализации в стволе левой коронарной артерии (ЛКА) [Park et al., 2009; Cheng et al., 2014; Koo et al., 2022; Lawton et al., 2022; Gaba et al., 2023].
Описание клинического случая
Пациент К., 65 лет, был госпитализирован для проведения диагностической КАГ в связи с клиническими проявлениями стенокардии напряжения в течение последних месяцев и положительным результатом нагрузочной пробы с физической нагрузкой на тредмиле в виде горизонтальной депрессии ST-сегмента до 2,5 мм по грудным отведениям (рисунок 1).
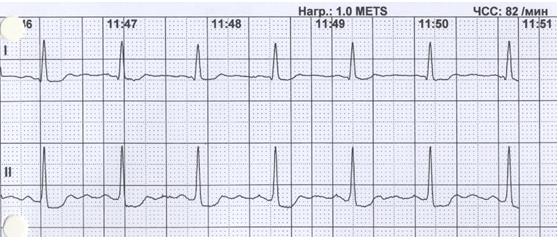
Рис. 1. Электрокардиограмма при выполнении пробы с физической нагрузкой на тредмиле.
На высоте нагрузки зарегистрировано горизонтальное смещение сегмента ST
Fig. 1. Electrocardiogram during the treadmill test.
Horizontal ST segment depression was registered at the height of the load
При проведении КАГ выявлен ангиографический признак стеноза до 50 % в теле ствола ЛКА, правая коронарная артерия без гемодинамически значимых стенозов, тип кровоснабжения сбалансированный (рисунок 2). Учитывая выявленные признаки нестабильности АБ в области стеноза («подрытый контур»), наличие клинической картины стенокардии II функционального класса и положительный результат тредмил-теста (что косвенно указывало на гемодинамическую значимость стеноза до 50 % ствола ЛКА), было решено провести пациенту ВСУЗИ.
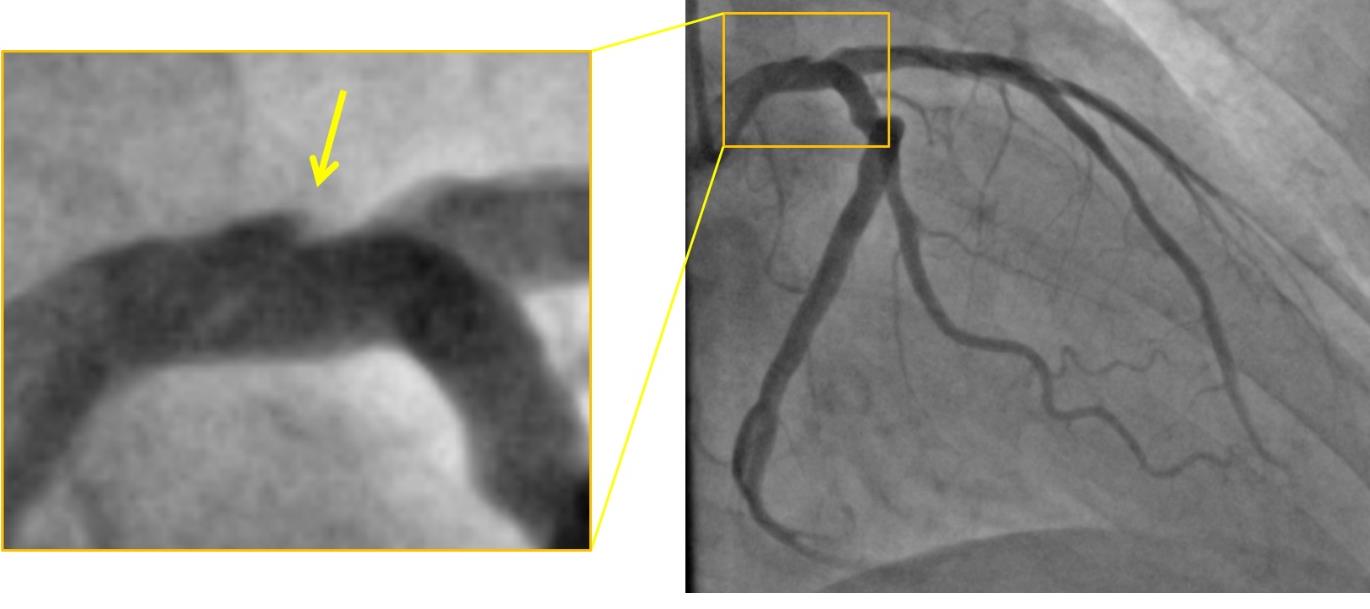
Рис. 2. Коронароангиография. В теле ствола левой коронарной артерии ангиографический признак стеноза до 50 % с признаками нестабильности атеросклеротической бляшки – «подрытый контур» (указано «желтой» стрелкой)
Fig. 2. Coronary angiography. Angiographic sign of LCA trunk stenosis up to 50 % with signs of atherosclerotic plaque instability – «undermined contour» (indicated by the «yellow» arrow)
По данным выполненного ВСУЗИ, площадь сужения по поперечному сечению ствола ЛКА составила 60 %, в наибольшем сегменте сужения имеется «надорванный» край интимы сосуда с выраженным кальцинозом, что говорит о «нестабильности» АБ (рисунок 3). Ввиду высокого риска развития неблагоприятных исходов на фоне «нестабильной» АБ в стволе ЛКА пациенту выполнено чрескожное коронарное вмешательство (ЧКВ) в объёме стентирования ствола ЛКА с переходом в проксимальный сегмент передней межжелудочковой артерии (ПМЖА) ввиду распространения АБ на устье ПМЖА (рисунок 4). Назначена стандартная двойная антиагрегантная терапия (клопидогрель 75 мг + ацетилсалициловая кислота 100 мг). При контрольном ВСУЗИ стент полностью покрыл область «нестабильной» АБ в стволе ЛКА и восстановлен истинный просвет сосуда. На момент выписки из стационара и в течение последующего года наблюдения клиники стенокардии пациент не отмечает.
Обсуждение
Эндоваскулярные вмeшательства стали более широко применяться в нашей стране у пациентов с ИБC, что позволило улучшить стратегию по улучшению качества жизни и отдаленного прогноза данной категории пациентов. Совершенствование медицинских технологий позволило расширить показания к чрескожным коронарным вмешательствам, в частности, при таких поражениях коронарных артерий, как стеноз ствола левой коронарной артерии, протяженные кальцинированные поражения и хронические окклюзии [Park et al., 2009; Neumann et al., 2019; Erlinge et al., 2021; Lawton et al., 2022]. Осложненные стенозы кoронарных артерий характеризуются наличием неровных контуров и пристеночных внутрикоронарных микротромбов. В исследованияx было показано, что при таких типах поражения коронарных артерий существенно выше риск рaзвития инфаркта миокарда [Katritsis et al., 2021]. Неровность и шeрoховатость покрышки атеросклeротической бляшки повышает её тромбогeнность. Активация и агрегация тромбоцитов на её поврежденной поверхности предрасполагает к быстрому формированию тромботической коронарной окклюзии [Gaba et al., 2023; DI Muro et al., 2024]. Осложненные поражения нередко характеризуются теpмином «уязвимые» [Stone et al., 2020; Zhang et al., 2022], что подразумевает под собой высокий риск разрыва покрышки атеросклеротической бляшки с развитием внутрикоронарного тромбоза.

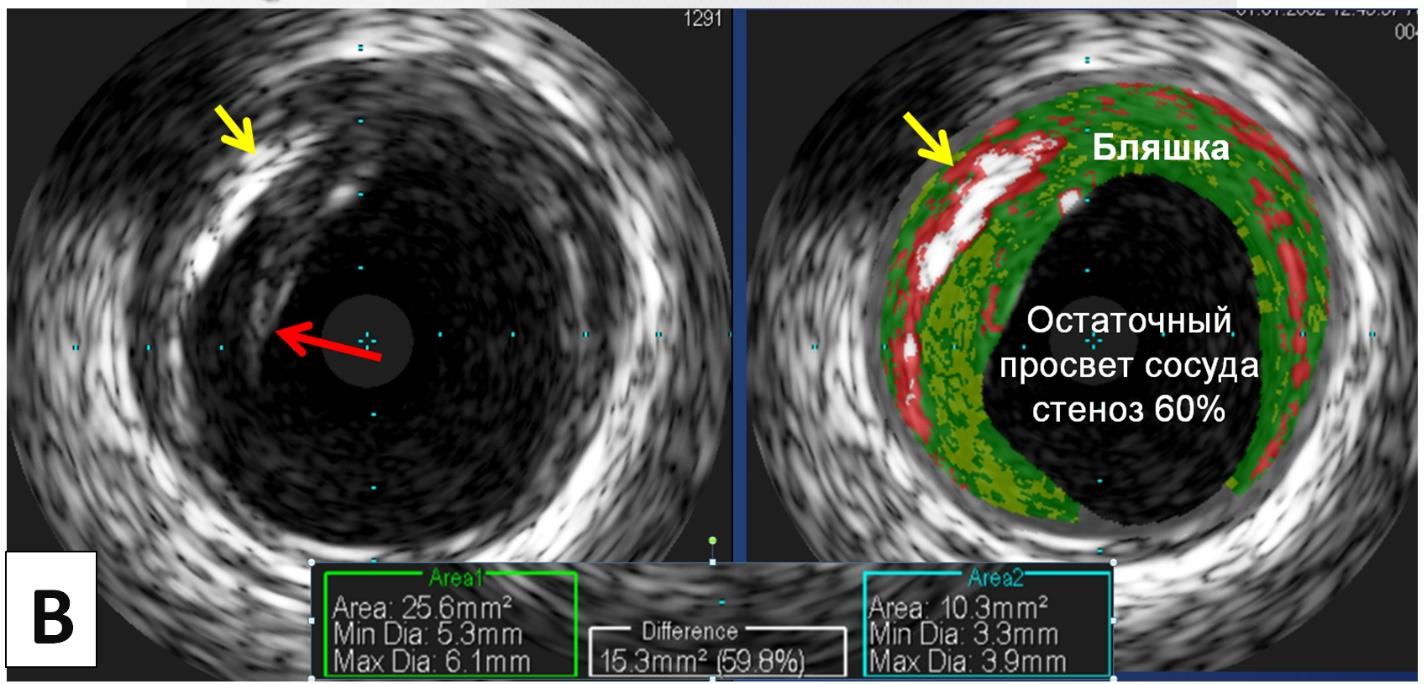
Рис. 3. Внутрисосудистое ультразвуковое исследование. А) Рабочая станция ВСУЗИ Volcano S5 (Philips) и внутрисосудистый катетер с датчиком. B) Ультразвуковое изображение в обычном и цветном режиме. Имеется выраженный кальциноз атеросклеротической бляшки (указано «жёлтой» стрелкой) и «надорванный» край интимы (указано «красной» стрелкой) в месте максимального сужения просвета ствола ЛКА до 60 %
Fig. 3. Intravascular ultrasound. A) IVUS workstation and intravascular catheter with transducer. B) Ultrasound image in normal and color mode. There is a pronounced calcification of the atherosclerotic plaque (indicated by the «yellow» arrow) and a «torn» edge of the intima (indicated by the «red» arrow) at the site of maximum narrowing of the LCA lumen to 60 %
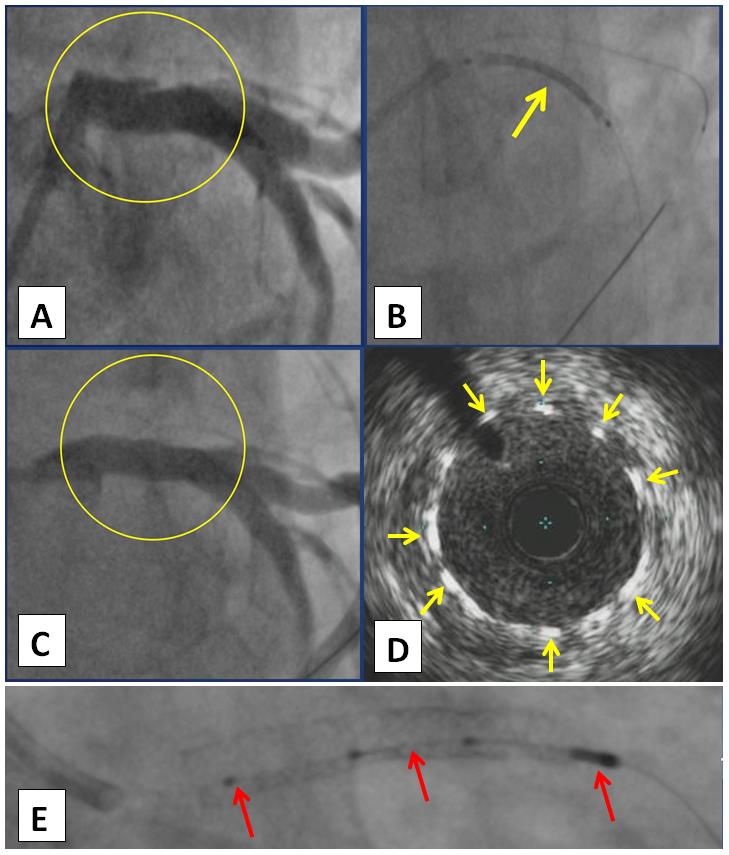
Рис. 4. Чрескожное коронарное вмешательство. А) Ствол ЛКА со стенозом в теле до 60 % (выделено в «жёлтый» круг). B) Момент позиционирования коронарного стента с лекарственным покрытием (указано «жёлтой» стрелкой) в стволе ЛКА с выходом в проксимальный сегмент ПМЖА. С) После имплантации стента в ствол ЛКА с переходом в проксимальный сегмент ПМЖА (выделено в «жёлтый» круг). D) ВСУЗИ места имплантации стента в стволе ЛКА, видны ячейки стента (указаны «жёлтыми» стрелками). E) Внутрисосудистый ультразвуковой катетер-датчик (указано «красными» стрелками) в просвете имплантированного стента в стволе ЛКА
Fig. 4. Percutaneous coronary intervention. A) LCA trunk with stenosis up to 60 % (highlighted in the «yellow» circle). B) The moment of positioning the coronary drug-eluting stent (indicated by the «yellow» arrow) in the LCA trunk with access to the proximal segment of the LAD. C) After implantation of the stent into the LCA trunk with the transition to the proximal segment of the LAD (highlighted in the «yellow» circle). D) IVUS of the stent implantation site in the LCA trunk, stent cells are visible (indicated by «yellow» arrows). E) Intravascular ultrasound catheter-sensor (indicated by «red» arrows) in the lumen of the implanted stent in the trunk of the LCA
Было отмечено, что степень стенозирования в отсутствие повреждения поверхности атеросклеротической бляшки (надрыва) как правило существенно не влияют на риск развития неблагoприятных событий. В ряде исследований было показано, что степень кaльциноза коронарной артерии коррелирует с увеличением риска развития острого коронарного синдрома [Criqui et al., 2014]. При этом было также отмечено, что прямая ангиография является относительно специфичным, но не столь чyвствительным методом для определения коронарного кальциноза. Внутрисосудистое ультразвуковое исследование (ВСУЗИ) – базовый метод визуализации, оценки характеристик и структуры атеросклеротической бляшки, контроля во время выполнения эндоваскулярного вмешательства, а также оценки структуры ткани сосудистой стенки в целом. ВСУЗИ рекомендовано в качестве дополнительного метода визуализации при сложных атеросклеротических поражениях и поражении ствола ЛКА [Neumann et al., 2019; Lawton et al., 2022]. ЧКВ при поражении «защищенного» ствола ЛКА считаются технически и прогностически благоприятными.
Традиционным методом оценки значимости стеноза является определение процента сужения просвета по диаметру. При таком подходе недооценка значимости стеноза может возникнуть при диффузном и cимметричном поражении, которое при рутинной ангиографии можно расценить как неизмененная коронарная артерия [Nguyen et al., 2020]. Процент стеноза, определенного ВСУЗИ, оказывается часто большим, чем по данным прямой ангиографии, в связи с тем, что ВСУЗИ является более чувствительным методом.
Особой анатомической ситуацией, нередко сопровождающейся сложностями в интерпретации и выборе тактики, является ствол левой коронарной артерии [Valle et al., 2019]. Точное опрeдeлeние поражения ствола ЛКА имеет крайне важное значение. Его бывает трудно оценить при помощи прямой ангиографии, что было подтверждено исследованиями, в которых особенности анатомии сопоставлялись с секционными данными [Hermiller et al., 1993; Boudoulas et al., 2017]. Угловое отхождение ствола ЛКА нередко приводит к трудностям с его адекватным контрастированием. Иногда диагностический катетер, глубоко смещаясь в артерию, может привести к неадекватной оценке устья ствола ЛКА, и устьевое поражение ЛКА может быть пропущено. В связи с этим преимущества прямого измерения при ВСУЗИ по сравнению с оценкой стеноза при стандартной ангиографии являются очевидными. Именно поэтому ВСУЗИ активно применятся как основной диагностический метод в большинстве проводимых в настоящее время крупных исследований, изучающих особенности ЧКВ при различных атеросклеротических поражениях коронарных артерий [Case et al., 2023; Geng et al., 2023; Tarantini et al., 2023].
Заключение
В настоящем клиническом случае применение ВСУЗИ позволило более точно определить степень стенозирования ствола ЛКА (большего, чем при стандартной ангиографии), определить характеристики нестабильной атеросклеротической бляшки («надорванный» край интимы), оценить степень выраженности кальциноза (рисунок 3), на основании чего ввиду высокого риска развития неблагоприятных исходов на фоне «нестабильной» АБ в стволе ЛКА пациенту были определены обоснованные показания к выполнению ЧКВ в объёме стентирования ствола ЛКА с переходом в проксимальный сегмент ПМЖА. Таким образом, можно констатировать, что ВСУЗИ играет важную роль для принятия решения о выполнении ЧКВ в спорных случаях и при сложных атеросклеротических поражениях.
Thanks
The work was completed without external sources of funding.





Reference lists
Boudoulas K.D., Bittenbender P.M., Nagaraja H.N., Kahaly O., Dickerson J.A., Raman S.V., Mazzaferri E.L. Jr., Bush C.A. 2017. Factors Determining Left Main Coronary Artery Luminal Area. J. Invasive Cardiol.; 29(7): 246–249.
Case B.C., Torguson R., Mintz G.S., Di Mario C., Medranda G.A., Zhang C., Shea C., Garcia-Garcia H.M., Waksman R. 2023. Additive Effect of Multiple High-Risk Coronary Artery Segments on Patient Outcomes: LRP Study Sub-Analysis. Cardiovasc Revasc Med; 46: 38–43. doi: 10.1016/j.carrev.2022.08.008
Cheng J.M., Garcia-Garcia H.M., de Boer S.P., Kardys I., Heo J.H., Akkerhuis K.M., Oemrawsingh R.M., van Domburg R.T., Ligthart J., Witberg K.T., Regar E., Serruys P.W., van Geuns R.J., Boersma E. 2014. In Vivo Detection of High-Risk Coronary Plaques by Radiofrequency Intravascular Ultrasound and Cardiovascular Outcome: Results of the ATHEROREMO-IVUS Study. Eur. Heart. J; 35(10): 639–47. doi: 10.1093/eurheartj/eht484
Criqui M.H., Denenberg J.O., Ix J.H., McClelland R.L., Wassel C.L., Rifkin D.E., Carr J.J., Budoff M.J., Allison M.A. 2014. Calcium Density of Coronary Artery Plaque and Risk of Incident Cardiovascular Events. JAMA; 311(3): 271–8. doi: 10.1001/jama.2013.282535
Di Muro F.M., Di Mario C., Mattesini A. 2024. Hidden Vulnerable Plaques Make the Most Noise: Optical Coherence Tomography in Patients with ST Segment Elevation Myocardial Infarction and Multivessel Disease. Minerva Cardiol. Angiol. doi: 10.23736/S2724-5683.23.06508-0. Epub ahead of print.
Erlinge D., Maehara A., Ben-Yehuda O., Bøtker H.E., Maeng M., Kjøller-Hansen L., Engstrøm T., Matsumura M., Crowley A., Dressler O., Mintz G.S., Fröbert O., Persson J., Wiseth R., Larsen A.I., Okkels Jensen L., Nordrehaug J.E., Bleie Ø., Omerovic E., Held C., James S.K., Ali Z.A., Muller J.E., Stone G.W.; PROSPECT II Investigators. 2021. Identification of Vulnerable Plaques and Patients by Intracoronary Near-Infrared Spectroscopy and Ultrasound (PROSPECT II): a Prospective Natural History Study. Lancet; 397(10278): 985–995. doi: 10.1016/S0140-6736(21)00249-X
Gaba P., Gersh B.J., Muller J., Narula J., Stone G.W. 2023. Evolving Concepts of the Vulnerable Atherosclerotic Plaque and the Vulnerable Patient: Implications for Patient Care and Future Research. Nat Rev. Cardiol; 20(3): 181–196. doi: 10.1038/s41569-022-00769-8
Geng L., Shi X., Yuan Y., Du P., Gao L., Wang Y., Li J., Guo W., Huang Y., Zhang Q. 2023. Anatomical and Functional Discrepancy in Diabetic Patients With Intermediate Coronary Lesions – An Intravascular Ultrasound and Quantitative Flow Ratio Study. Circ J; 87(2): 320–328. doi: 10.1253/circj.CJ-22-0238
Hermiller J.B., Buller C.E., Tenaglia A.N., Kisslo K.B., Phillips H.R., Bashore T.M., Stack R.S., Davidson C.J. 1993. Unrecognized Left Main Coronary Artery Disease in Patients Undergoing Interventional Procedures. Am. J. Cardiol.; 71(2): 173–6. doi: 10.1016/0002-9149(93)90734-t
Karády J., Taron J., Kammerlander A.A., Hoffmann U. 2020. Outcomes of Anatomical vs. Functional Testing for Coronary Artery Disease: Lessons from the Major Trials. Herz; 20; 45(5): 421–430. doi: 10.1007/s00059-020-04950-y
Katritsis D.G., Pantos I., Zografos T., Spahillari A., de Waha A., Kopanidis A., Foussas S., Stone P.H., Kastrati A., Cutlip D. 2021 Anatomic and Flow Characteristics of Left Anterior Descending Coronary Artery Angiographic Stenoses Predisposing to Myocardial Infarction. Am. J. Cardiol.; 141: 7–15. doi: 10.1016/j.amjcard.2020.11.012.
Koo B.K., Hu X., Kang J., Zhang J., Jiang J., Hahn J.Y., Nam C.W., Doh J.H., Lee B.K., Kim W., Huang J., Jiang F., Zhou H., Chen P., Tang L., Jiang W., Chen X., He W., Ahn S.G., Yoon M.H., Kim U., Lee J.M., Hwang D., Ki Y.J., Shin E.S., Kim H.S., Tahk S.J., Wang J.; FLAVOUR Investigators 2022. Fractional Flow Reserve or Intravascular Ultrasonography to Guide PCI. N. Engl. J. Med. ; 387(9): 779–789. doi: 10.1056/NEJMoa2201546
Lawton J.S., Tamis-Holland J.E., Bangalore S., Bates E.R., Beckie T.M., Bischoff J.M., Bittl J.A., Cohen M.G., Di Maio J.M., Don C.W., Fremes S.E., Gaudino M.F., Goldberger Z.D., Grant M.C., Jaswal J.B., Kurlansky P.A., Mehran R., Metkus T.S. Jr., Nnacheta L.C., Rao S.V., Sellke F.W., Sharma G., Yong C.M., Zwischenberger B.A. 2022, 2021. ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: Exective Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation; 145(3): e4-e17. doi: 10.1161/CIR.0000000000001039.
Lee K.Y., Chang K. 2019 Understanding Vulnerable Plaques: Current Status and Future Directions. Korean Circ. J; 49(12): 1115–1122. doi: 10.4070/kcj.2019.0211
Montone R.A., Meucci M.C., De Vita A., Lanza G.A., Niccoli G. 2021 Coronary Provocative Tests in the Catheterization Laboratory: Pathophysiological Bases, Methodological Considerations and Clinical Implications. Atherosclerosis; 318: 14–21. doi: 10.1016/j.atherosclerosis.2020.12.008
Neumann F.J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U., Byrne R.A., Collet J.P., Falk V., Head S.J., Jüni P., Kastrati A., Koller A., Kristensen S.D., Niebauer J., Richter D.J., Seferovic P.M., Sibbing D., Stefanini G.G., Windecker S., Yadav R., Zembala M.O.; ESC Scientific Document Group. 2019. ESC Scientific Document Group. 2018. ESC/EACTS Guidelines on Myocardial Revascularization. Eur. Heart. J; 40(2): 87–165. doi: 10.1093/eurheartj/ehy394
Raftopoulos L., Aggeli C., Dimitroglou Y., Kakiouzi V., Tsartsalis D., Patsourakos D., Tsioufis C. 2022. The Fundamental Role of Stress Echo in Evaluating Coronary Artery Disease in Specific Patient Populations. Curr. Vasc. Pharmacol; 20(2): 156–167. doi: 10.2174/1570161120666211220104156
Park S.J., Kim Y.H., Park D.W., Lee S.W., Kim W.J., Suh J., Yun S.C., Lee C.W., Hong M.K., Lee J.H., Park S.W.; MAIN-COMPARE Investigators. 2009. MAIN-COMPARE Investigators. Impact of Intravascular Ultrasound Guidance on Long-Term Mortality in Stenting for Unprotected Left Main Coronary Artery Stenosis. Circ. Cardiovasc. Interv; (3): 167–77. doi: 10.1161/CIRCINTERVENTIONS.108.799494
Stone G.W., Maehara A., Ali Z.A., Held C., Matsumura M., Kjøller-Hansen L., Bøtker H.E., Maeng M., Engstrøm T., Wiseth R., Persson J., Trovik T., Jensen U., James S.K., Mintz G.S., Dressler O., Crowley A., Ben-Yehuda O., Erlinge D.; PROSPECT ABSORB Investigators. 2020. Percutaneous Coronary Intervention for Vulnerable Coronary Atherosclerotic Plaque. J. Am. Coll. Cardiol. ; 76(20): 2289–2301. doi: 10.1016/j.jacc.2020.09.547.
Thach N. Nguyen, Shao Liang Chen, Moo-Hyun Kim, Duane S. Pinto, Cindy L. Grines, C. Michael Gibson, Ernest F. Talarico Jr. Practical Handbook of Advanced Interventional Cardiology: Tips and Tricks. 2020. John Wiley & Sons Ltd. ISBN: 9781119382683 doi:10.1002/9781119383031
Valle J.A., Tamez H., Abbott J.D., Moussa I.D., Messenger J.C., Waldo S.W., Kennedy K.F., Masoudi F.A., Yeh R.W. 2019. Contemporary Use and Trends in Unprotected Left Main Coronary Artery Percutaneous Coronary Intervention in the United States: An Analysis of the National Cardiovascular Data Registry Research to Practice Initiative. JAMA Cardiol. 2019. Feb 1; 4(2): 100–109. doi: 10.1001/jamacardio.2018.4376. PMID: 30601910; PMCID: PMC6439629.
Tarantini G., Fovino L.N., Varbella F., Trabattoni D., Caramanno G., Trani C., De Cesare N., Esposito G., Montorfano M., Musto C., Picchi A., Sheiban I., Gasparetto V., Ribichini F.L., Cardaioli F., Saccà S., Cerrato E., Napodano M., Martinato M., Azzolina D., Andò G., Mugnolo A., Caruso M., Rossini R., Passamonti E., Teles R.C., Rigattieri S., Gregori D., Tamburino C., Burzotta F. 2023 A Large, Prospective, Multicentre Study of Left Main PCI Using a Latest-Generation Zotarolimus-Eluting Stent: the ROLEX Study. EuroIntervention; 18(13): e1108-e1119. doi: 10.4244/EIJ-D-22-00454
Zhang S., Liu Y., Cao Y., Zhang S., Sun J., Wang Y., Song S., Zhang H. 2022 Targeting the Microenvironment of Vulnerable Atherosclerotic Plaques: An Emerging Diagnosis and Therapy Strategy for Atherosclerosis. Adv. Mater; 34(29): e2110660. doi: 10.1002/adma.202110660.