Modern Therapeutic Approaches to the Treatment of Alcoholic Hepatitis
Annotation
Treatment of alcoholic hepatitis is critical to improve survival and prevent progression to cirrhosis and liver failure. Traditional treatments, such as alcohol abstinence and symptomatic drug therapy, remain the cornerstones of treatment. However, in recent years, new drugs have emerged that have shown promise in improving outcomes in patients with alcoholic hepatitis. The purpose of this review is to present the most relevant non-drug, drug-based approaches in the treatment of this group of patients, as well as address the issue of the need for early liver transplantation. The objectives of the work included collecting modern scientific data; discussion of the specifics of each treatment method, possible limitations in the context of use in this group of patients, main advantages for patients with alcoholic hepatitis; analysis of research results that highlight the importance of the drugs used in routine practice depending on the severity of the disease. The results of the work emphasize the continued need to use non-drug methods and, based on the results of using validated scales, prescribe individual drug therapy, as well as the need for further research to optimize results in this group of patients.
Keywords: alcoholic liver disease, alcoholic hepatitis, cirrhosis, liver failure, pentoxifylline, larsucosterol
Unfortunately, the article is available only in Russian
Введение
Злоупотребление алкогольными напитками ведет к возникновению множества тяжелых заболеваний, таких как цирроз печени, ишемическая болезнь сердца, инфаркт миокарда в молодом возрасте, гипертонические кризы с развитием летальных осложнений, онкологические заболевания различной локализации и травматизм. Высокая смертность при заболеваниях печени достигается злоупотреблением алкогольсодержащих напитков, которое приводит к развитию алкогольной болезни печени. Алкоголизм остается одной из значимых проблем во всем современном мире, и, кроме того, отмечается его рост в популяции как у мужчин, так и у женщин.
Изучение данной проблемы актуально в различных сферах – медицинской, экономической и социальной, так как результат злоупотребления алкогольными напитками не только заболевание, но и утрата трудоспособности с дальнейшим развитием экономических проблем. Высокая медико-социальная значимость алкоголизма привела к высокому интересу и изучению, а соответственно, появилось большее количество научных публикаций как в отечественной, так и в зарубежной литературе.
Алкогольная болезнь печени (АБП) является причиной 10 % потерянных здоровых лет жизни у мужчин и до 40 % всех смертей от заболеваний печени [Jepsen, Younossi, 2015].
В связи с этим целью данной работы является рассмотрение противоречивых вопросов в лечении алкогольного гепатита и выделение наиболее актуальных методов лечения.
Материалы обзора
При сборе научных данных использовались научно-теоретические, научно-практические, обзорные и научно-исследовательские статьи из базы поиска литературных источников PubMed, PubMed Central, cyberleninka.ru (ключевые слова: алкогольная болезнь печени, алкогольный гепатит, цирроз, печеночная недостаточность, лечение алкогольного гепатита).
АБП представляет собой широкий спектр клинических проявлений с различными гистопатологическими особенностями. АБП включает стеатоз, алкогольный гепатит (АГ) и цирроз. Алкогольный гепатит представляет собой тяжелый некро-воспалительный процесс c высокой 90-дневной смертностью, составляющей 30–50 % от всех случаев данной патологии [Gao, Bataller, 2011]. Клиническая картина алкогольного гепатита может варьироваться от быстрого начала желтухи до развития печеночной недостаточности.
Диагностические критерии алкогольного гепатита, предложенные Национальным институтом по злоупотреблению алкоголем и алкоголизмом (National Institute on Alcohol Abuse and Alcoholism – NIAAA), включают:
1) употребление алкоголя более двух напитков у женщин и более трех напитков у мужчин в течение не менее шести месяцев;
2) последний прием алкоголя в предыдущие 60 дней до начала желтухи;
3) повышенные уровни аспартат-аминотрансферазы (АСТ) и аланин-аминотрансферазы (АЛТ) более 50 МЕ/л, но менее 400 МЕ/л, с соотношением АСТ/АЛТ более 1,5;
4) внезапное начало с развитием желтухи (уровень билирубина в сыворотке > 3 мг/дл);
5) исключение других причин заболеваний печени, кроме употребления алкоголя [Louvet et al., 2022].
Тяжелая форма, определяемая по шкале MELD ≥ 21 (Model for End-Stage Liver Disease) или дискриминантной функции (шкала DF) > 32, связана с высокой краткосрочной смертностью (до 30 % через 28 дней, между 30 % и 50% через 90 дней и долгосрочной смертностью – более 50 % через 1 год) [Seitz et al., 2018]. Большинство исследований по лечению и определению прогноза у пациентов с алкогольным гепатитом проведены именно в этой группе пациентов. А пациенты с DF < 32 и MELD < 21 традиционно считаются имеющими «нетяжелый» или «умеренный» алкогольный гепатит. У этой группы пациентов смертность составляет до 3 % – 7 % в среднесрочной перспективе и 13 % – 20 % через 1 год от начала заболевания [Clemente-Sánchez et al., 2021].
Проблема алкогольного гепатита остается плохо изученной, вероятно, в связи с её недооцененной распространенностью. Наше понимание патогенеза и основных механизмов алкогольного гепатита продолжает улучшаться, однако, поскольку нет специфического лечения, меры, такие как воздержание от алкоголя и питательная поддержка, продолжают быть основой немедикаментозной терапии [Arab et al., 2019]. Можно отметить высокую пользу, хотя со значительным риском развития осложнений, в спектре медикаментозного лечения от кортикостероидов у пациентов с тяжелыми формами алкогольного гепатита, которые снижают 30-дневную смертность.
Для оценки целесообразности и решения вопроса о необходимости назначений кортикостероидов в мире разработано несколько моделей шкал, чтобы выявить группы пациентов с наибольшей вероятностью хорошего эффекта при применении кортикостероидов, и определить когорту пациентов, где преждевременное прекращение кортикостероидов необходимо для предотвращения различных осложнений. Кроме того, в последние годы появилось много новых терапевтических схем лечения и продолжаются несколько клинических исследований в этом направлении, что, безусловно, актуализирует разработки в данном направлении.
Актуальным остается проведение обзора обновленной сводки текущего лечения алкогольного гепатита и обсуждения новых терапевтических подходов для этого состояния.
Первоочередная и одна из основных терапевтических мер при любой форме и стадии АБП – абстиненция. Продолжение приема алкоголя значительно ухудшает жизненный прогноз пациента: существует риск прогрессирования заболевания печени, развития выраженного фиброза и цирроза, осложнений портальной гипертензии, гепатоцеллюлярной карциномы и рака других локализаций (колоректального, верхних отделов желудочно-кишечного тракта, поджелудочной железы и т. д.). При полном отказе от приема алкоголя возможны нормализация гистологической картины ткани печени, снижение давления в воротной вене, прекращение прогрессирования цирроза, предотвращение осложнений и улучшение жизненного прогноза пациента. При невозможности полного отказа от приема алкоголя уменьшение его дозы также несет в себе положительный потенциал. Врач любого профиля должен уделить внимание алкогольному анамнезу пациента.
Важной составляющей в терапии алкогольного гепатита остаются вопросы питания. У пациентов с алкогольной болезнью печени (АБП) существуют различные механизмы, влияющие на недостаточное питание, такие как снижение усвоения макроэлементов, анорексия, тошнота, рвота, дисгезия и нарушение уровня сознания. Недостаточное питание является частым осложнением АБП и может наблюдаться у основной массы пациентов с алкогольным гепатитом [McClain et al., 2021]. Исследование, проведенное в США на группе ветеранов в период с 1978 по 1983 годы, показало, что 62 % пациентов со злоупотреблением алкоголя даже в отсутствии признаков печеночной патологии имели недостаток белково-калорийного питания [Mendenhall et al., 1995]. Другое подобное исследование, включающее 363 пациента с алкогольным гепатитом, показало, что 86 % из них имели недостаток калорий и 100 % – белков [Hammad et al., 2017]. Как осложнение алкогольного гепатита недостаточное питание может оказывать существенное влияние на прогрессирование заболевания, увеличивать риск инфекций и смерти, особенно у пациентов с признаками декомпенсированной печеночной недостаточности [Periyalwar, Dasarathy, 2012]. Пациенты с циррозом, которые перенесли тяжелый алкогольный гепатит, имеют еще более выраженные недостатки питания, что указывает на то, что развитие продвинутой стадии заболевания связано с более серьезным недостатком питания [McClain, et al., 2021]. Саркопения – одно из основных последствий недостаточного питания у пациентов с печеночными заболеваниями [Nevens et al., 2016]. Проявления, такие как хроническая гипергаммоглобулинемия, недостаток аминокислот, а также недостаток физической активности, чрезмерное потребление алкоголя, инсулинорезистентность, снижение синтеза белка мышц и повышение его катаболизма, предрасполагают пациентов к развитию саркопении. Последняя является результатом гиперкатаболического состояния, вызванного повышенной проницаемостью кишечника, эндотоксемией, высвобождением повреждающих и патоген-ассоциированных молекулярных веществ и портосистемного шунтирования [Allen et al., 2021]. Особую роль, по-видимому, играет гипераммонемия, так как она приводит к усилению автофагии и нарушению синтеза белка мышц [Meza et al., 2022]. Попытки увеличить адекватное поступление питательных веществ и адекватную физическую активность, как правило, не вызывают ожидаемого увеличения синтеза белка и ингибирования протеолиза, что в конечном счете способствует развитию саркопении [Singal, Shah, 2016]. Скрининг на предмет недостаточного питания следует проводить в приоритетном порядке у пациентов с алкогольным гепатитом. Для этого рекомендуется использовать инструменты оценки, такие как критерии «Глобальной инициативы по недостаточному питанию» (GLIM), оценка риска снижения питания у пациентов (NUTRIC score) или инструмент приоритетизации питания в Royal Free Hospital (RFH-NPT), в зависимости от тяжести алкогольного гепатита [Mayr et al., 2020].
При положительных результатах скрининга необходимо провести дальнейшую оценку, используя антропометрические показатели, например: индекс массы тела (ИМТ), изменение веса, толщина складки кожи на трицепсе, биологические параметры (суточная экскреция мочевины в моче за 24 часа), двухэнергетическую рентгеновскую абсорбциометрию (DEXA) и анализ изображений компьютерной томографии (КТ) мышц на уровне третьего поясничного позвонка (L3) [McClain et al., 2021]. Последний является специфическим методом для количественной оценки потери мышц в параспинальной области и брюшной стенке, относительно независимым от активности и задержки воды и может использоваться для диагностики саркопении.
При тяжелом алкогольном гепатите (определенном как показатель MELD ≥ 21) интенсивное энтеральное питание сложно реализовать, и, к сожалению, доказательства не показывают увеличения выживаемости. За исключением противопоказаний, питательная поддержка через рот или энтеральным путем должна предпочитаться всем пациентам с алкогольным гепатитом [Bischoff et al., 2020]. Парентеральное питание имеет более высокий риск осложнений, включая инфекции, и может рассматриваться только в случае, если пациенты не могут достичь калорийных и белковых целей другими способами [Hassanein et al., 2023]. Большинство клинических рекомендаций и экспертов рекомендуют суточное энергетическое потребление 30–35 ккал/кг и белковое потребление 1,2–1,5 г/кг при алкогольном гепатите [Hassanein et al., 2019].
В спектре медикаментозного лечения также необходимо затронуть патогенетические механизмы формирования алкогольного гепатита. Патогенез алкогольного гепатита частично объясняется повышенной проницаемостью кишечника, вызванной чрезмерным употреблением алкоголя. Это, в свою очередь, приводит к эндотоксемии, вызванной в основном липополисахаридом. Эндотоксемия может стимулировать клетки Купферова и приводить к усиленному освобождению противовоспалительных цитокинов. В результате возникает повреждение гепатоцитов, что приводит к некротическим и воспалительным изменениям и развитию алкогольного гепатита [Mathurin et al., 2000]. А блокировать цитотоксические пути могут в первую очередь кортикостероиды, обладающие противовоспалительным и иммуномодулирующим эффектами.
Множество шкал показали свою полезность для прогнозирования исходов, таких как шкала ABIC (Age-Bilirubin-International normalized ratio-Creatinine), шкала GAHS (Glasgow Alcoholic Hepatitis Score), дискриминантная функция Маддрея (MDF) и шкала MELD (Model for End-Stage Liver Disease), которая показала лучшую производительность в прогнозировании краткосрочной смертности [Morales-Arráez et al., 2022].
Пациенты с показателем MELD выше 20 имеют повышенный риск развития острой недостаточности печени и множественной органной недостаточности и должны рассматриваться для назначения стероидов [Singal, Mathurin, 2021]. Максимальная польза наблюдается у пациентов с показателем MELD от 25 до 39 [Arab et al., 2021]. Однако пациенты, находящиеся в тяжелом состоянии (показатель MELD выше 51), не получают пользы от стероидов и имеют повышенный риск развития инфекций при лечении. Следует отметить, что увеличение показателя MELD на ≥ 2 балла в течение первой недели госпитализации является фактором риска повышенной смертности в стационаре. Шкалы MELD, GAHS и ABIC также полезны для прогнозирования смертности через 30 и 90 дней у пациентов с алкогольным гепатитом, и оценка функции почек должна быть учтена [Dominguez et al., 2008]. Кроме того, недавнее исследование, проведенное Kezer и др., позволило разработать и проверить в эффективности новую шкалу, называемую индексом смертности при алкогольном гепатите (MIAAH), которая превосходит существующие шкалы в прогнозировании смертности через 30 дней при АГ [Heimbach et al., 2018].
Другое значимое исследование STOPAH включало более чем тысячи пациентов и изучало смертность через 28 дней. Наилучший эффект у пациентов, получавших преднизолон в сравнении с пентоксифиллином – плацебо и плацебо – плацебо (14 % – против 19 % – против 17 % соответственно). Лечение преднизолоном привело к отношению шансов (OR) 0,72 (95 % ДИ: 0,52–1,01; p = 0,06). Однако этот эффект не был статистически значимым через 28 дней [Galvin et al., 2010]. Специфическая терапия алкогольного гепатита тяжелого течения проводится, если индекс Мэддрея ≥ 32, MELD ≥ 18, GAHS ≥ 8, и назначается преднизолон для приема внутрь в дозе 40 мг/сут на период 28 дней (в случае невозможности приема препаратов внутрь, можно использовать метилпреднизолон внутривенно).
Оценку эффективности терапии (например, метилпреднизолоном) можно проводить на 7-й день от ее начала с помощью индекса Лилль (Lille model). Если индекс Лилль < 0,45, то лечение преднизолоном в указанной дозе продолжают в течение 28 дней с последующей полной отменой препарата в течение не менее 16 дней. При индексе Лилль ≥ 0,45 лечение преднизолоном прекращают ввиду его неэффективности (рис. 1.) [Dingwall et al., 2022].
В настоящее время большое внимание уделяют лекарственным препаратам с регенераторными свойствами. Фактор колонии гранулоцитов (Г-КСФ) обладает регенеративным действием на печень у пациентов с тяжелым алкогольным гепатитом, которые не реагируют на стероиды. Были проведены мета-анализы, в которых изучалась эффективность Г-КСФ при алкогольном гепатите: 5 исследований в Азии показали 90-дневную выживаемость, а 2 исследования в Европе показали отсутствие преимущества в выживаемости, а скорее, тенденцию к увеличению смертности [Baig et al., 2020]. Комбинация Г-КСФ и преднизолона также дала неоднозначные результаты: недавнее исследование в США показало эквивалентную
90-дневную выживаемость по сравнению с лечением преднизолоном (0,73 [95 % ДИ
0,44–0,89] против 0,83 [95 % ДИ 0,57–0,94]; P . 0,05) [Tayek et al., 2022]. В то время как исследование из Азии, в котором сравнивались эффект отдельного приема Г-КСФ, отдельного приема преднизолона и преднизолон в комбинацию с Г-КСФ, показали 64,3 %, 78,6 % и 88,1 %
90-дневную эффективность в снижении смертности при алкогольном гепатите соответственно.
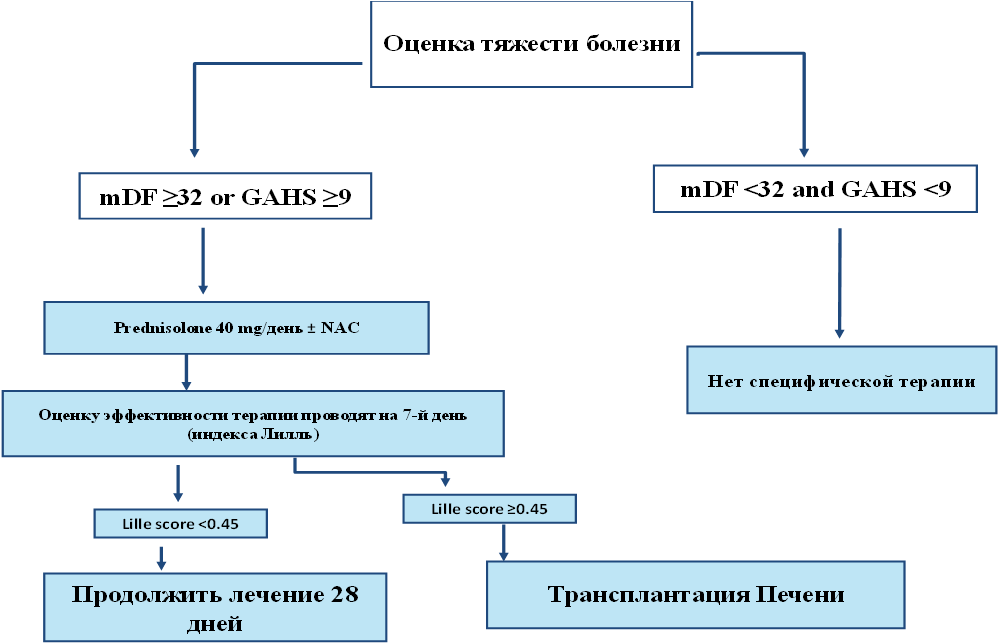
Рис. 1. Алгоритм ведения пациентов с алкогольным гепатитом [Dingwall et al., 2022]
Fig. 1. Algorithm for the management of patients with alcoholic hepatitis [Dingwall et al., 2022]
Известно, что выраженными противовоспалительными свойствами обладает интерлейкин-22 (IL-22), который относится к семейству цитокинов IL-10 [Gao, 2015, p. 1121]. Он способствует регенерации путем пролиферации печеночных стволовых клеток и индукции экспрессии антиапоптотических, антиоксидантных, пролиферативных и антибактериальных генов в гепатоцитах, снижая фиброз без развития иммуносупрессии [Xiang et al., 2020]. Исследования на мышах показали, что производство IL-22 снижалось при этиловом дисбиозе, и наоборот, когда использовали бактерии, способные производить IL-22, наблюдалось снижение алкогольного повреждения. Недавнее фаза IIb исследование показало применение аналога IL-22, называемого F-652, у 18 пациентов (9 – средняя и 9 – тяжелая форма алкогольного гепатита) показало значительное снижение показателя MELD, показателя Лилль на 7-й день и снижение цитокиновых воспалительных маркеров и уровня аминотрансфераз в сыворотке и также увеличение маркеров регенерации на 28-й и 42-й день от базового значения (p < 0,05). Концептуально эти регенеративные свойства также могут влиять на злокачественные клетки, увеличивая вероятность развития гепатоцеллюлярной карциномы. Поэтому в настоящее время проводятся дальнейшие исследования для определения безопасности и эффективности применения IL-22 при алкогольном гепатите [Hendrikx et al., 2019].
Спорным остается вопрос применения некоторых лекарственных препаратов, среди которых обетихолевая кислота (ОКА), являющаяся селективным агонистом фарнезоидного Х-рецептора с антихолестатическими и гепатопротективными свойствами и богатый иммуноглобулинами коровий колострум. ОКА играет роль в регуляции синтеза и транспорта желчных кислот, обмене липидов и глюкозе. ОКА обладает противовоспалительной и антиоксидантной активностью и также показала положительный эффект у пациентов с портальной гипертензией на фоне алкогольного гепатита [Hartmann et al., 2018]. Однако этот препарат имеет побочный эффект в виде гепатотоксичности, в связи с чем недавнее фазовое II клиническое исследование пациентов с алкогольным гепатитом, леченных ОКА, было отменено. Пациентам с умеренными и тяжёлыми поражениями печени (B и C по Чайлд – Пью) следует начинать терапию по 5 мг один раз в неделю (по 5 мг в день для других пациентов с первичным билиарным холангитом), и при необходимости можно увеличить до максимальной дозы 10 мг два раза в неделю. Врачи должны постоянно наблюдать за пациентами и при прогрессировании заболевания снижать частоту приема один раз или два раза в неделю у пациентов, которые прогрессируют до умеренных или тяжелых нарушений функций печени [Nevens et al., 2016].
Богатый иммуноглобулинами коровий колострум имеет иммуномодулирующий эффект и снижает уровень эндотоксинов в сыворотке крови. В открытом клиническом исследовании, включающем 20 пациентов с тяжелым алкогольным поражением и MDF, равный или больше 54, богатый иммуноглобулинами коровий колострум и кортикостероиды демонстрировали значительное снижение MDF, бактериальной транслокации и увеличения уровня антител, нацеленных на ЛПС. Однако аналогичное фазовое IIa клиническое исследование у пациентов с индексом MELD от 20 до 28 не продемонстрировало изменений в уровне эндотоксинов в плазме или смертности после шести месяцев приема богатого иммуноглобулинами коровьего колострума. В настоящее время проводится фаза III плацебо-контролируемого рандомизированного исследования сроком в три месяца у тяжелобольных пациентов [Eslamian et al., 2019].
В запуске клеточной смерти методом активации Толл-подобных рецепторов (TLR-4) важную роль играет Каспаза-1. На моделях мышей эмрикасан (ингибитор панкаспазы) смог продемонстрировать снижение фиброза при неалкогольном стеатогепатите и улучшение функции печени у пациентов с циррозом по сравнению с плацебо. К сожалению, фаза II клинического исследования была досрочно завершена (зарегистрировано всего пять пациентов) из-за неблагоприятного фармакокинетического эффекта препарата, что затруднило разработку безопасной дозировочной схемы во избежание превышения терапевтической концентрации препарата в сыворотке крови. Точно так же селонсертиб (ингибитор апоптотической сигнальной киназы) изначально показал положительные результаты у пациентов с неалкогольной жировой болезнью печени. Однако у пациентов с тяжелым алкогольным гепатитом добавление селонсертиба к стандартной терапии не показало никаких преимуществ в отношении выживаемости, показателей функции печени по сравнению с глюкокортикостероидами в качестве монотерапии [Frenette et al., 2019].
На сегодняшний день наиболее многообещающей терапией в этой области является использование антагониста Х-рецепторов печени (ларсукостерол). Данный препарат снижает метаболизм липидов, воспалительные реакции, уменьшая противовоспалительные цитокины и стабилизируя митохондрии. С целью изучения эффективности, безопасности и фармакокинетического профиля ларсукостерола (антагонист Х-рецепторов печени (LXR)) у пациентов с алкогольным гепатитом было проведено мультицентровое открытое исследование фазы 2a с включением 19 пациентов с алкогольным гепатитом. Основываясь на индексе MELD (Model for End-stage Liver Disease), 7 пациентов имели поражение умеренной степени тяжести и 12 – тяжелой степени тяжести [Hassanein et al., 2019]. Пациенты получали 1 или 2 в/в инфузии (с разницей в 72 часа) в дозе 30, 60, 90 или 150 мг. Период наблюдения составил 28 дней. Эффективность терапии сравнивали с 2 когортами, в которых применялась стандартная тактика ведения или кортикостероиды. Результаты были следующие: 74 % пациентов (67 % пациентов с тяжелым гепатитом) получили только одну инфузию и были выписаны ≤ 72 ч после первой инфузии. По данным анализа безопасности, не выявлено серьезных нежелательных явлений и терапия не была прекращена раньше времени по причине побочных эффектов. На фармакокинетический профиль ларсукостерола не оказывала влияние тяжесть заболевания. Обращало на себя внимание снижение уровня билирубина к 7 дню и к 28 дню и снижение индекса MELD на 28 день. Индекс Лилль (используется для оценки эффективности терапии на 7 день, выживаемость при < 0,45 составляет 85 %) составил < 0,45 у 89 % пациентов. Таким образом, можно сказать, что ларсукостерол демонстрирует хорошую переносимость у пациентов с алкогольным гепатитом. Учитывая обещающие результаты исследования фазы 2a, в настоящее время проводится рандомизированное двойное слепое плацебо-контролируемое исследование фазы 2b [Hassanein et al., 2023].
Еще одним из используемых лекарственных препаратов, обладающим множеством положительных механизмов действия, включая антиоксидантные свойства, является метадоксин. Действие препарата было изучено в одном исследовании с участием 70 пациентов с тяжелым алкогольным гепатитом, которые получали метадоксин в комбинации с глюкокортикостероидами по сравнению с монотерапией глюкокортикостероидами в течение 30 дней. Добавление метадоксина увеличило выживаемость на 30-й день (74,3 % против 45,7 %, p = 0,02) и на 90-й день (68,6 % против 20,0 %, p = 0,0001). Кроме того, было меньше развития или прогрессирования энцефалопатии (28,6 % против 60,0 %, p = 0,008) и гепаторенального синдрома с острым повреждением почек (31,4 % против 54,3 %, p = 0,05), а также лучше ответ на лечение, определенный по шкале Лилль (0,63 против 0,38, p = 0,001). Эти результаты согласуются с результатами аналогичного исследования с участием 135 пациентов [Hassanein et al., 2019].
Данные об эффективности глюкокортикоидов + N-ацетилцистеина (NAC) показали преимущество в выживаемости в течение 1 месяца (в основном за счет снижения риска гепаторенального синдрома), но не показали преимущества в выживаемости в более длительные сроки, такие как трех- или шестимесячное наблюдение. N-ацетилцистеин действительно оказывает положительное влияние на снижение частоты инфекций при сочетании со стандартной терапией глюкокортикоидами (ОР 0,45; 95 % ДИ: 0,27–0,75; p = 0,002. Таким образом, необходимо провести больше рандомизированных контролируемых испытаний, прежде чем можно будет дать четкие рекомендации.
Пентоксифиллин – ингибитор фосфодиэстеразы, который оценивался у пациентов с алкогольным гепатитом на предмет его способности подавлять выработку фактора некроза опухоли (TNF). Однако нет никаких доказательств, подтверждающих пользу для выживаемости при использовании пентоксифиллина. Аналогичные результаты были получены при сочетании пентоксифиллина с кортикостероидами. Доказательства пользы для выживаемости терапии пентоксифиллина у пациентов с тяжелым алкогольным гепатитом очень слабы, и поэтому пентоксифиллин больше не может быть рекомендован при алкогольном гепатите [Swart, Zillikens, 1989].
Многие исследования на мышах показали, что добавки пробиотиков снижают острое алкоголь-индуцированное воспаление печени и улучшают метаболизм алкоголя. В небольшом исследовании пациентов с легкой и средней степенью тяжести алкогольного гепатита добавки Bifidobacterium bifidum и Lactobacillus plantarum улучшили лабораторные маркеры повреждения печени [Zhang et al., 2019]. У пациентов с алкогольным гепатитом повышена доля цитолитической E. faecalis, которая, как было показано ранее, коррелирует с тяжестью заболевания и смертностью. Этот штамм выделяет цитолизин, который вызывает образование пор и лизис клеток. Бактериофаги, нацеленные на цитолитический E. faecalis, используют специфичность для нацеливания, отбора и редактирования микробиома пациента. На мышиных моделях показано, что бактериофаги снижают уровень цитолизина в печени и отменяют вызванное этанолом заболевание печени. Однако в этом направлении все еще требуются разнонаправленные исследования.
Интересным направлением является трансплантация фекальной микробиоты (ФМТ микробиоты – AH FMT) от здоровых доноров к пациентам с АБП в качестве возможного терапевтического метода. В одном из пилотных исследований с участием 195 пациентов с АБП 51 пациент получил данную терапию. Результаты показали увеличение выживаемости в группе (87,5 % против 33,3 %, p = 0,018) и снижение таких показателей, как билирубин, асцит, печеночная энцефалопатия и балл MELD [Heimbach et al., 2018].
Особого внимания заслуживают пациенты с тяжелым алкогольным гепатитом, не реагирующие на системную стероидную терапию, оцениваемую по шкале Лилль в течение семи дней, имеют высокую краткосрочную смертность, а шестимесячная выживаемость составляет всего 20–30 %. Было показано, что трансплантация печени значительно повышает выживаемость в этой группе пациентов – до 77 % через 6 месяцев после операции [Galvin et al., 2010]. По этой причине в последние годы правило «6 месяцев» предварительного воздержания было отвергнуто в качестве критерия трансплантации, поскольку оно не только не имеет убедительных научных доказательств, но и не соответствует прогностическим реалиям пациентов с тяжелым алкогольным гепатитом. Поэтому в настоящее время отсутствие ответа на ГКС у пациентов с алкогольным гепатитом стало показанием к трансплантации печени. В недавно проведенном исследовании было продемонстрировано улучшение показателей выживаемости, связанное с ранней трансплантацией печени при тяжелом алкогольном гепатите. В ходе анализа была выявлена одинаковая двухлетняя выживаемость после трансплантации в группах ранней и стандартной трансплантации [Galvin, et al., 2010].
Обсуждение
Одним из важнейших условий благоприятного прогноза алкогольного гепатита является полный отказ пациента от употребления алкоголя. Но при невозможности выполнения данного условия в полном объеме стоит отметить, что снижение количества алкогольсодержащий напитков также положительно влияет на течение и прогноз заболевания. Особое внимание стоит уделить питанию данных пациентов. Рекомендуется максимальное сохранение энтерального питания, а назначение парентерального питания только при невозможности получения первого, т. к. имеет место развитие инфекционных осложнений.
В современной медицине практикующие врачи таких специальностей, как терапевты, гастроэнтерологи, гепатологи, инфекционисты, для определения тактики лечения и его эффективности у пациентов с алкогольным гепатитом используют различные шкалы – индекс Мэддрея, MELD, GAHS, Lille model. Например, для оценки целесообразности и решения вопроса о необходимости назначений кортикостероидов применяются данные шкалы, чтобы выявить группы пациентов с наибольшей вероятностью хорошего эффекта при применении кортикостероидов и определить когорту пациентов, где преждевременное прекращение кортикостероидов необходимо для предотвращения различных осложнений. Кроме того, в последние годы появилось много новых терапевтических схем лечения и продолжаются несколько клинических исследований в этом направлении, что, безусловно, актуализирует разработки в данном направлении.
В настоящее время активно обсуждается, но по-прежнему остается открытым вопрос перспективного направления в терапии пациентов с алкогольным гепатитом. Сохраняется актуальность продолжения исследования эффективности таких фармакологических препаратов, как Г-КСФ, ларсукостерол, ГКС + N-ацетилцистеин, бифидо- и лактобакерии, учитывая их положительные результаты на течение и исход данного заболевания. Достаточно хорошо зарекомендовали себя в качестве высокоэффективных средств лечения различных форм алкогольной болезни печени такие препараты, как ФМТ и ГКС в комбинации с метадоксином. Однако подтверждаются факты нецелесообразности применения лекарственных препаратов, таких как интеролейкин-22, ОКА, каспаза-1 и пентоксифиллин в группах пациентов с данной патологией. Основанием данного заключения являются неблагоприятные результаты – гепатотоксичность, плохая фармакокинетика, риск развития карциномы, а также отсутствие доказательной эффективности, полученные при проведении ряда различных исследований.
Следует отметить, что прогноз течения АБП напрямую зависит от длительности периода воздержания от употребления алкогольных напитков, тяжести поражения печени и наличия дополнительных факторов, повреждающих печень.
Прогрессирование алкогольного повреждения печени, развитие цирроза требуют решения вопроса о трансплантации. В настоящее время вопрос о трансплантации печени при алкогольном поражении печени проводится уже на ранних стадиях заболевания. Стоит отметить, что сейчас не требуется выполнения условия отказа от приема алкогольных напитков в течение не менее 6 месяцев перед операцией, поскольку оно не только не имеет убедительных научных доказательств, но и не соответствует прогностическим реалиям пациентов с тяжелым алкогольным гепатитом.
Выводы
Алкогольный гепатит – тяжелое и потенциально фатальное осложнение запойного и хронического употребления алкоголя. Лечение алкогольного гепатита должно включать полный отказ от алкоголя, тщательную оценку питания и пищевую поддержку в комплексе с медикаментозными препаратами, включенными в стандарты оказания медицинской помощи. В тяжелых случаях, определяемых с помощью моделей шкал, можно использовать кортикостероиды, которые снижают краткосрочную смертность. Другие варианты медикаментозного лечения в настоящее время изучаются, но результаты противоречивы (например, по Г-КСФ и IL-22). Иные стимуляторы регенерации печени, такие как ОКА, богатый иммуноглобулинами коровий колострум и ингибиторы каспазы, пока, к сожалению, не показали достоверных положительных результатов. Противовоспалительное лечение же антиоксидантами, NAC, метадоксином и блокаторами рецепторов IL-1 в настоящее время изучено, но с неоднозначными результатами.
Для выбора правильной тактики лечения алкогольного гепатита рекомендуется более активное внедрение шкал (индекс Мэддрея, DF, MELD, GAHS, Lille model) в работу практикующего врача.
Необходима разработка новых подробных алгоритмов лечения данного заболевания с учетом степени тяжести заболевания и индивидуальных особенностей пациента.
На основании проанализированных материалов можно утверждать, что ранняя трансплантация печени в современной практике всегда должна рассматриваться у пациентов с тяжелым алкогольным гепатитом, не реагирующих на системную стероидную терапию.
Thanks
The work was performed without external sources of funding.





Reference lists
Allen S.L., Quinlan J.I., Dhaliwal A., Armstrong M.J., Elsharkawy A.M., Greig C.A., Lord J.M., Lavery G.G., Breen L. 2020. Sarcopenia in Chronic Liver Disease: Mechanisms and Countermeasures. American Journal of Physiology. Gastrointestinal and Liver Physiology. 320(3): 241–257. https://doi.org/10.1152/ajpgi.00373.2020
Arab J.P., Roblero J.P., Altamirano J., Bessone F., Chaves Araujo R., Higuera-De la Tijera F., Restrepo J.C., Torre A., Urzua A., Simonetto D.A., Abraldes J.G., Méndez-Sánchez N., Contreras F., Lucey M.R., Shah V.H., Cortez-Pinto H., Bataller R. 2019. Alcohol-Related Liver Disease: Clinical Practice Guidelines by the Latin American Association for the Study of the Liver (ALEH). Annals of Hepatology. 18(3): 518–535. https://doi.org/10.1016/j.aohep.2019.04.005
Arab J.P., Díaz L.A., Baeza N., Idalsoaga F., Fuentes-López E., Arnold J., Ramírez C.A., Morales-Arraez D., Ventura-Cots M., Alvarado-Tapias E., Zhang W., Clark V., Simonetto D., Ahn J.C., Buryska S., Mehta T.I., Stefanescu H., Horhat A., Bumbu A., Dunn W., Bataller R. 2021. Identification of Optimal Therapeutic Window for Steroid Use in Severe Alcohol-Associated Hepatitis: A Worldwide Study. Journal of Hepatology. 75(5): 1026–1033. https://doi.org/10.1016/j.jhep.2021.06.019
Baig M., Walayat S., Dhillon S., Puli S. 2020. Efficacy of Granulocyte Colony Stimulating Factor in Severe Alcoholic Hepatitis: A Systematic Review and Meta-Analysis. Cureus. 12(9): 10474. https://doi.org/10.7759/cureus.10474
Bischoff S.C., Bernal W., Dasarathy S., Merli M., Plank L.D., Schütz T., Plauth M. 2020. ESPEN Practical Guideline: Clinical Nutrition in Liver Disease. Clinical Nutrition (Edinburgh, Scotland). 39(12): 3533–3562. https://doi.org/10.1016/j.clnu.2020.09.001
Clemente-Sánchez A., Oliveira-Mello A., Bataller R. 2021. Moderate Alcoholic Hepatitis. Clinics in Liver Disease. 25(3): 537–555. https://doi.org/10.1016/j.cld.2021.03.001
Dingwall K.M., Delima J.F., Binks P., Batey R., Bowden S.C. 2022. What is the Optimum Thiamine Dose to Treat or Prevent Wernicke's Encephalopathy or Wernicke-Korsakoff Syndrome? Results of a Randomized Controlled Trial. Alcoholism, Clinical and Experimental Research. 46(6): 1133–1147. https://doi.org/10.1111/acer.14843
Dominguez M., Rincón D., Abraldes J.G., Miquel R., Colmenero J., Bellot P., García-Pagán J.C., Fernández R., Moreno M., Bañares R., Arroyo V., Caballería J., Ginès P., Bataller R. 2008. A New Scoring System for Prognostic Stratification of Patients with Alcoholic Hepatitis. The American Journal of Gastroenterology. 103(11): 2747–2756. https://doi.org/10.1111/j.1572-0241.2008.02104.x
Eslamian G., Ardehali S.H., Baghestani A.R., Vahdat Shariatpanahi Z. 2019. Effects of Early Enteral Bovine Colostrum Supplementation on Intestinal Permeability in Critically Ill Patients: A Randomized, Double-Blind, Placebo-Controlled Study. Nutrition (Burbank, Los Angeles County, Calif.). 60: 106–111. https://doi.org/10.1016/j.nut.2018.10.013
Frenette C.T., Morelli G., Shiffman M.L., Frederick R.T., Rubin R.A., Fallon M.B., Cheng J.T., Cave M., Khaderi S.A., Massoud O., Pyrsopoulos N., Park J.S., Robinson J.M., Yamashita M., Spada A.P., Chan J.L., Hagerty D.T. 2019. Emricasan Improves Liver Function in Patients with Cirrhosis and High Model for End-Stage Liver Disease Scores Compared with Placebo. Clinical Gastroenterology and Hepatology: the Official Clinical Practice Journal of the American Gastroenterological Association. 17(4): 774–783. https://doi.org/10.1016/j.cgh.2018.06.012
Galvin R., Bråthen G., Ivashynka A., Hillbom M., Tanasescu R., Leone M.A., 2010. EFNS Guidelines for Diagnosis, Therapy and Prevention of Wernicke Encephalopathy. European Journal of Neurology. 17(12): 1408–1418. https://doi.org/10.1111/j.1468-1331.2010.03153.x
Gao B. 2015. Interplay of Interleukin-22 and its Binding Protein in Controlling Liver Scarring. Hepatology (Baltimore, Md.). 61(4): 1121–1123. https://doi.org/10.1002/hep.27688
Gao B. Bataller R. 2011. Alcoholic Liver Disease: Pathogenesis and New Therapeutic Targets. Gastroenterology. 141(5): 1572–1585. https://doi.org/10.1053/j.gastro.2011.09.002
Hammad A., Kaido T., Aliyev V., Mandato C., Uemoto S. 2017. Nutritional Therapy in Liver Transplantation. Nutrients. 9(10): 1126. https://doi.org/10.3390/nu9101126
Hartmann P., Hochrath K., Horvath A., Chen P., Seebauer C.T., Llorente C., Wang L., Alnouti Y., Fouts D.E., Stärkel P., Loomba R., Coulter S., Liddle C., Yu R.T., Ling L., Rossi S.J., DePaoli A.M., Downes M., Evans R.M., Brenner D.A., Schnabl B. 2018. Modulation of the Intestinal Bile Acid/Farnesoid X Receptor/Fibroblast Growth Factor 15 Axis Improves Alcoholic Liver Disease in Mice. Hepatology (Baltimore, Md.). 67(6): 2150–2166. https://doi.org/10.1002/hep.29676
Hassanein T., McClain C.J., Vatsalya V., Stein L.L., Flamm S.L., Martin P., Cave M.C., Mitchell M. Jr., Barton B., Nagy L., Szabo G., McCullough A., Dasarathy S., Shah J., Blevins C., Scott D., Krebs W., Brown J.E., Lin W. 2024. Safety, Pharmacokinetics, and Efficacy Signals of Larsucosterol (DUR-928) in Alcohol-Associated Hepatitis. The American Journal of Gastroenterology. 119(1): 107–115. https://doi.org/10.14309/ajg.0000000000002275
Hassanein T., Stein L.L., Flamm S.L., Martin P., Cave M.C., Blevins C., Scott D., Krebs W., Lin W. 2019. Safety and Efficacy of DUR-928: a Potential New Therapy for Acute Alcoholic Hepatitis. Hepatology. 70: 1483A-1484A.
Heimbach J.K., Kulik L.M., Finn R.S., Sirlin C.B., Abecassis M.M., Roberts L.R., Zhu A.X., Murad M.H., Marrero J.A. 2018. AASLD Guidelines for the Treatment of Hepatocellular Carcinoma. Hepatology (Baltimore, Md.). 67(1): 358–380. https://doi.org/10.1002/hep.29086.
Hendrikx T., Duan Y., Wang Y., Oh J.H., Alexander L.M., Huang W., Stärkel P., Ho S.B., Gao B., Fiehn O., Emond P., Sokol H., van Pijkeren J.P., Schnabl B. 2019. Bacteria Engineered to Produce IL-22 in Intestine Induce Expression of REG3G to Reduce Ethanol-Induced Liver Disease in Mice. Gut. 68(8): 1504–1515. https://doi.org/10.1136/gutjnl-2018-317232
Jepsen P., Younossi Z.M. 2021. The Global Burden of Cirrhosis: A Review of Disability-Adjusted Life-Years Lost and Unmet Needs. Journal of Hepatology. 75(1): 3–13. https://doi.org/10.1016/j.jhep.2020.11.042
Louvet A., Trabut J.B., Moreno C., Moirand R., Aubin H.J., Ntandja Wandji L.C., Nourredine M., Ningarhari M., Ganne-Carrié N., Pageaux G.P., Bailly F., Boursier J., Daeppen J.B., Luquiens A., Nguyen-Khac E., Anty R., Orban T., Donnadieu-Rigole H., Mallat, A., Bureau C., for the Groupe Collaboratif AFEF-SFA Maladie du foie liée à l'alcool 2022. Management of Alcohol-Related Liver Disease: the French Association for the Study of the Liver and the French Alcohol Society Clinical Guidelines. Liver International : Official Journal of the International Association for the Study of the Liver. 42(6): 1330–1343. https://doi.org/10.1111/liv.15221
Mathurin P., Deng Q.G., Keshavarzian A., Choudhary S., Holmes E.W., Tsukamoto H. 2000. Exacerbation of Alcoholic Liver Injury by Enteral Endotoxin in Rats. Hepatology (Baltimore, Md.). 32(5): 1008–1017. https://doi.org/10.1053/jhep.2000.19621
Mayr U., Pfau J., Lukas M., Bauer U., Herner A., Rasch, S., Schmid, R.M., Huber W., Lahmer T.,
Batres-Baires G. 2020. NUTRIC and Modified NUTRIC are Accurate Predictors of Outcome in End-Stage Liver Disease: A Validation in Critically ill Patients with Liver Cirrhosis. Nutrients. 12(7): 2134. https://doi.org/10.3390/nu12072134
McClain C.J., Rios C.D., Condon S., Marsano L.S. 2021. Malnutrition and Alcohol-Associated Hepatitis. Clinics in Liver Disease. 25(3): 557–570. https://doi.org/10.1016/j.cld.2021.03.002
Mendenhall C., Roselle G.A., Gartside P., Moritz T. 1995. Relationship of Protein Calorie Malnutrition to Alcoholic Liver Disease: a Reexamination of Data from Two Veterans Administration Cooperative Studies. Alcoholism, Clinical and Experimental Research. 19(3): 635–641. https://doi.org/10.1111/j.1530-0277.1995.tb01560.x
Meza V., Arnold J., Díaz L.A., Ayala Valverde M., Idalsoaga F., Ayares G., Devuni D., Arab J.P. 2022. Alcohol Consumption: Medical Implications, the Liver and Beyond. Alcohol and Alcoholism (Oxford, Oxfordshire). 57(3): 283–291. https://doi.org/10.1093/alcalc/agac013
Mishra A.K., Shasthry S.M., Vashishtha C. 2022. GCSF Increases the Steroid Responsiveness and 90 Day Survival in Severe Alcoholic Hepatitis Patients: A Randomised Control Trial. Hepatology. 76: 150.
Morales-Arráez D., Ventura-Cots M., Altamirano J., Abraldes J.G., Cruz-Lemini M., Thursz M.R., Atkinson S.R., Sarin S.K., Kim W., Chavez-Araujo R., Higuera-de la Tijera M.F., Singal A.K., Shah V.H., Kamath P.S., Duarte-Rojo A., Charles E.A., Vargas V., Jager M., Rautou P.E., Rincon D., Bataller R. 2022. The MELD Score Is Superior to the Maddrey Discriminant Function Score to Predict Short-Term Mortality in Alcohol-Associated Hepatitis: A Global Study. The American journal of gastroenterology. 117(2): 301–310. https://doi.org/10.14309/ajg.0000000000001596
Nevens F., Andreone P., Mazzella G., Strasser S.I., Bowlus C., Invernizzi P., Drenth J.P., Pockros P.J., Regula J., Beuers U., Trauner M., Jones D.E., Floreani A., Hohenester S., Luketic V., Shiffman M., van Erpecum K.J., Vargas V., Vincent C., Hirschfield G.M., POISE Study Group. 2016. A Placebo-Controlled Trial of Obeticholic Acid in Primary Biliary Cholangitis. The New England Journal of Medicine. 375(7), 631–643. https://doi.org/10.1056/nejmoa1509840
Periyalwar P., Dasarathy S. 2012. Malnutrition in Cirrhosis: Contribution and Consequences of Sarcopenia on Metabolic and Clinical Responses. Clinics in Liver Disease. 16(1): 95–131. https://doi.org/10.1016/j.cld.2011.12.009
Seitz H.K., Bataller R., Cortez-Pinto H., Gao B., Gual A., Lackner C., Mathurin P., Muelle, S., Szabo G., Tsukamoto H. 2018. Alcoholic Liver Disease. Nature Reviews. Disease Primers. 4(1): 16. https://doi.org/10.1038/s41572-018-0014-7
Singal A.K., Shah V.H. 2016. Therapeutic Strategies for the Treatment of Alcoholic Hepatitis. Seminars in Liver Disease. 36(1): 56–68. https://doi.org/10.1055/s-0036-1571297
Singal A.K., Mathurin P. 2021. Diagnosis and Treatment of Alcohol-Associated Liver Disease: A Review. JAMA. 326(2), 165–176. https://doi.org/10.1001/jama.2021.7683
Subramaniyan V., Chakravarthi S., Jegasothy R., Seng W.Y., Fuloria N. K., Fuloria S., Hazarika I., Das A. 2021. Alcohol-Associated Liver Disease: A Review on its Pathophysiology, Diagnosis and Drug Therapy. Toxicology Reports. 8: 376–385. https://doi.org/10.1016/j.toxrep.2021.02.010
Swart G.R., Zillikens M.C., van Vuure J.K., van den Berg J.W. 1989. Effect of a Late Evening Meal on Nitrogen Balance in Patients with Cirrhosis of the Liver. BMJ (Clinical Research Ed.). 299(6709): 1202–1203. https://doi.org/10.1136/bmj.299.6709.1202
Tayek J.A., Stolz A.A., Nguyen D.V., Fleischman M.W., Donovan J.A., Alcorn J.M., Chao D.C., Asghar A., Morgan T.R. Southern California Alcoholic Hepatitis (SCAH) Consortium 2022. A Phase II, Multicenter, Open-Label, Randomized Trial of Pegfilgrastim for Patients with Alcohol-Associated Hepatitis. E. Clinical Medicine, 54: 101689. https://doi.org/10.1016/j.eclinm.2022.101689
Xiang X., Hwang S., Feng D., Shah V.H., Gao B. 2020. Interleukin-22 in Alcoholic Hepatitis and Beyond. Hepatology International. 14(5): 667–676. https://doi.org/10.1007/s12072-020-10082-6
Zhang Y., Ma J., Jing N., Zhang H., Xie Y., Liu H., Shan X., Ren J., Jin J. 2023. Bifidobacterium animalis A12 and Lactobacillus salivarius M18-6 Alleviate Alcohol Injury by keap1-Nrf2 Pathway and Thioredoxin System. Foods (Basel, Switzerland). 12(3): 439. https://doi.org/10.3390/foods12030439