Aortic Dissection: Classification, Etiology, Pathogenesis and Clinical Picture
Annotation
Aortic dissection is a pathological process in which the aortic wall is divided into inner and outer layers under the action of hemodynamic forces. The process can be localized in various parts of the aorta, and also can be cause of blood supply disorders not only of organs which are located along the vessel (orthograde), but also organs which are located retrogradely. Risk factors for aortic dissection may include age, gender, atherosclerosis, inflammatory diseases, chest injuries, heart surgery, hereditary predisposition, congenital defects of the cardiovascular system and hereditary connective tissue disorders. The most often complication of aortic dissection is malperfusion syndrome, which can manifest itself as symptoms of upper and lower limb ischemia, syncope, ischemic stroke, prerenal azotemia (with decreased renal perfusion), abdominal ischemia syndrome (with occlusion of mesenteric arteries), spinal ischemic stroke. Knowledge of the totality of etiological factors, risk factors, pathogenesis, various manifestations and complications of aortic dissection allows you not to miss the beginning of the pathological process and provide timely assistance.
Keywords: aortic dissection, aortic aneurysm, malperfusion syndrome, atherosclerosis, Marfan syndrome
Unfortunately, the article is available only in Russian
Введение
Расслоение аорты (РА) представляет собой патологический процесс, при котором происходит продольное разделение стенки аорты на внутренний и наружный слои под действием гемодинамических сил. Это может происходить вследствие разрыва внутренней ее оболочки (интимы), а также из-за разрыва питающих сосудов (vasa vasorum), после чего кровь под высоким давлением проникает в среднюю оболочку (медию), вызывая образование или внутристеночной гематомы, при этом происходит увеличение внешнего диаметра сосуда или дополнительного внутристеночного канала (ложного просвета), из которого кровь может вернуться далее в собственно канал сосуда (истинный просвет). Процесс может идти как антероградно (дистально), так и ретроградно (проксимально).
Если кровь длительное время скапливается в ложном просвете, может образоваться аневризма, однако чаще это бывает умеренно выражено или вовсе отсутствует. Поэтому термин «расслоение аорты» в последние несколько лет стал общепринятым и распространённым в зарубежной литературе и заменил термины «расслаивающая аневризма» (введённый в клиническую практику Лаэннеком в 1819 г.) и «расслаивающая гематома», употреблявшийся позднее [Разумова и др., 2001].
Расслоение аорты может происходить в различных её отделах и сопровождаться широким спектром осложнений. Поэтому существует несколько различных классификаций данной патологии [Наднациональные (международные) рекомендации…, 2018].
Классификация
Стэнфордская классификация (Stanford, USA, рис. 1):
Тип А: Расслоение включает восходящую аорту (восходящее рассечение).
Тип В: Расслоение включает нисходящую аорту дистальнее отхождения левой подключичной артерии (нисходящее рассечение).
Классификация по De Bakey:
Тип I: Разрыв интимы локализуется в восходящей аорте, расслоение распространяется через дугу на нисходящую аорту и всю брюшную аорту.
Тип II: Расслоение захватывает только восходящую аорту.
Тип III: Расслоение захватывает только нисходящую аорту.
Тип IIIa: Разрыв интимы локализуется дистальнее левой подключичной артерии, расслоение может распространяться проксимально, дистально – в пределах нисходящей грудной аорты.
Тип IIIb: Разрыв интимы локализуется дистальнее левой подключичной артерии, расслоение распространяется дистально на нисходящую грудную и брюшную аорту.

Рис. 1. Классификации расслоения аорты по анатомической локализации
Fig. 1. Classification of aortic dissection by anatomical localization
В 1994 году фон Сегессер и соавт. предложили классификацию расслоения аорты, при котором расслоение захватывает только дугу аорты или локализуется в нисходящей части аорты с ретроградным распространением в дугу аорты, не затрагивая восходящую часть (классификация «не-А, не-В») (рис. 2) [Koechlin et al., 2021]. Данная классификация обусловлена необходимостью в обосновании хирургического лечения.

Рис. 2. Расположение разрыва интимы при расслоении дуги аорты.
Примечание: 1 – сегменты дуги аорты; 2 (2A) – разрыв в области перехода восходящей части аорты в ее дугу; 3 (2B) – в пространстве между левой общей сонной артерией и левой подключичной артерией; 4 (2C) – в дистальном сегменте дуги, после корня левой подключичной артерии
Fig. 2. The location of the intima rupture during the dissection of the aortic arch.
Note: 1 – Segments of the aortic arch; 2 (2A) – A gap in the area of transition of the ascending part
of the aorta into its arc; 3 (2B) – In the space between the left common carotid artery and the left subclavian artery; 4 (2C) – In the distal segment of the arch after the root of the left subclavian artery
Разрыв интимы, в свою очередь, образуется в наиболее гемодинамически уязвимых участках стенки аорты. В большинстве случаев это восходящая аорта – в пределах нескольких сантиметров от аортального клапана (65 %) и нисходящая аорта – чуть дистальнее места отхождения левой подключичной артерии (20 %). Возможно также изолированное расслоение дуги (10 %) и брюшной аорты (5 %) [Разумова и др., 2001]. У беременных женщин и родильниц может встречаться изолированное расслоение отдельных артерий, отходящих от аорты, особенно сонной и коронарной.
По времени возникновения заболевания выделяют острое (14 дней), подострое (15–90 дней), хроническое (> 90 дней) РА [Наднациональные (международные) рекомендации…, 2018].
С расслоением аорты тесно связано явление острого аортального синдрома (ОАС), который представляет собой общее понятие для описания состояний, вызванных острым прогрессирующим нарушением целостности стенки аорты.
Классификация острого аортального синдрома при расслоении аорты (рис. 3, [Косицина и др., 2019]). Класс 1: классическое РА с истинным и ложным просветом с или без связи между двумя просветами. Класс 2: интрамуральные гематомы. Класс 3: малозаметное или дискретное РА с выпячиванием стенки аорты. Класс 4: язва области атеросклеротической бляшки аорты с последующим разрывом бляшки. Класс 5: ятрогенное или травматическое РА.
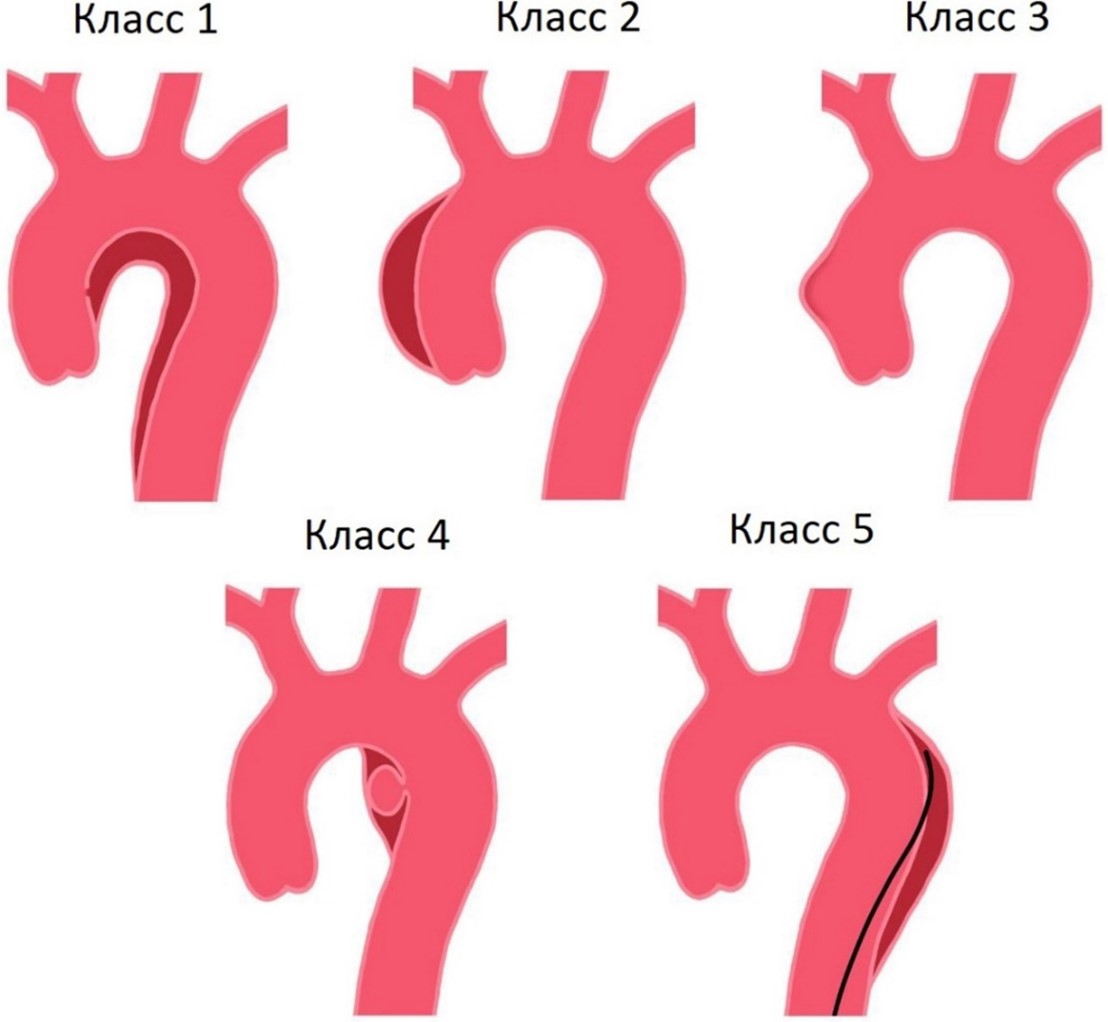
Рис. 3. Классификация острого аортального синдрома.
Примечание: Класс 1 – классический тип. Класс 2 – интрамуральная гематома.
Класс 3 – малозаметное или дискретное РА. Класс 4 – пенетрация аортальной язвы.
Класс 5 – ятрогенное или травматическое РА (РА – расслоение аорты)
Fig. 3. Classification of acute aortic syndrome.
Note: Class 1 – Classical type. Class 2 – Intramural hematoma. Class 3 – Subtle or discrete AD.
Class 4 – Aortic ulcer penetration. Class 5 – Iatrogenic or traumatic AD (AD – aorta dissection)
Данное явление заслуживает особого внимания. Смертность при ОАС составляет 1 % каждый час, приводя к 50 % смертности в первые двое суток. Связано это с тем, что клинически ОАС проявляется под различными «масками»: неврологический вариант, гастралгический вариант, сосудистый вариант с явлениями ишемии нижних конечностей, пневмонический вариант, перикардитический вариант и инфарктоподобный вариант, который встречается наиболее часто [Косицина и др., 2019].
Этиология и факторы риска
Основа этиологии РА – это дегенерация или травматическое разрушение медиального слоя стенки аорты. Однако факторы риска развития данных процессов довольно обширны, и каждый из них имеет своеобразный механизм воздействия на стенку аорты, поэтому появилась необходимость в их классификации по схожим критериям.
Выделяют факторы риска – классические и связанные с наследственным компонентом заболевания. В патологии грудного отдела аорты большое значение имеет наследственность (до 20 %), в отличие от патологии брюшного отдела аорты, для которой ведущей причиной являются классические факторы риска (в частности атеросклероз) [Наднациональные (международные) рекомендации…, 2018].
Классические факторы риска
Пик частоты РА приходится на 6–7 десятилетие жизни, патология у мужчин возникает в 2–3 раза чаще, чем у женщин [Разумова и др., 2001]. У пожилых пациентов отмечается преимущественная утрата и дегенерация ГМК, что приводит к нарушению их метаболической функции (в том числе синтеза внеклеточного матрикса) и дезорганизации средней оболочки аорты [Наднациональные (международные) рекомендации…, 2018].
Артериальная гипертензия является самым распространённым приобретённым фактором риска РА. До 70 % больных с расслоением аорты имеют повышенное артериальное давление [Аронов и др., 2021]. Причем риск развития РА не зависит от того, вызвана ли гипертензия экзогенным или эндогенным фактором. Например, такое состояние вызывают сильные физические нагрузки, если они были совершены за короткое время.
Атеросклероз представляет собой вариабельную комбинацию изменений внутренней оболочки (интимы) артерий, включающий накопление липидов, сложных углеводов, фиброзной ткани, компонентов крови, кальцификацию и сопутствующие изменения медии данных сосудов. Помимо повреждения интимы и медии как важных индукторов расслоения аорты, при атеросклерозе могут повреждаться и питающие сосуды – vasa vasorum [Аронов и др., 2021].
Аневризма аорты как фактор риска развития РА имеет особое место, так как оба заболевания являются взаимными факторами риска. При истончении стенки при РА повышается риск развития аневризмы из-за образования внутристеночных гематом (если ложный просвет не сообщается с истинным), а при развитии расширения полости аорты повышается риск развития РА вследствие истончения стенок сосуда и меньшим их гидродинамическим сопротивлением [Yuan et al., 2022]. Таким образом, если имеют место обе патологии, развивается расслаивающая аневризма аорты, а степень риска развития осложнений потенциируется. Степень риска определяется индексом размера аорты, а также наличием фоновых заболеваний, поэтому следует уделять внимание и риску развития аневризмы, исследуя риск развития РА [Наднациональные (международные) рекомендации…, 2018].
Аортоартериит Такаясу и гигантоклеточный аортоартериит (болезнь Хортона) – гранулематозные артерииты, поражающие аорту и ее ветви, – приводят к дегенерации стенки аорты, что, в свою очередь, способствует более легкому разрыву внутренней оболочки, например, при резком повышении кровяного давления, и развитию расслоения аорты [de Boysson et al., 2021; Roy, Singhal, 2022]. Болезнь Бехчета, представляющая собой системный васкулит с поражением сосудов преимущественно среднего и мелкого калибра, в редких описанных случаях может поражать аорту с развитием дегенеративных изменений [Wu et al, 2023].
Сифилитический аортит возникает с частотой около 44,1 % среди больных сифилисом. Преимущественная локализация поражения: корень аорты, створки аортального клапана и устье коронарных артерий, питающие сосуды (vasa vasorum) [Крупин, Недугов, 2019].
Системная красная волчанка (СКВ) является воспалительным заболеванием с аутоиммуным механизмом патогенеза и вовлечением многих органов и систем. Поражение сердечно-сосудистой системы ограничивается возникновением артериальной гипертензии, миокардитов и перикардитов, эндокардита Либмана – Сакса, венозными тромбозами, васкулитами и высокой частотой атеросклероза у беременных женщин, получающих глюкокортикостероиды. В патогенезе повреждения сосудистой стенки при СКВ большая роль отводится нейтрофильным внеклеточным ловушкам, накопление которых оказывает повреждающее воздействие на эндотелий и нарушает процесс эндотелий-зависимой вазодилатации, что повышает риск развития атеросклероза при СКВ. В свою очередь, такие ловушки вызывают деградацию внеклеточного матрикса, матриксных металлопротеиназ и индуцирование протеолиза [Мравян и др., 2017]. Таким образом, СКВ является фактором риска развития РА как напрямую, так и посредством индукции атерогенеза.
Расслоение аорты у беременных встречается очень редко, может носить как спонтанный характер, так и являться осложнением заболеваний, сопровождающихся поражением соединительной ткани. При беременности чаще происходит расслоение аорты типа А по Стэнфордской классификации в третьем триместре (51 % случаев) и в послеродовом периоде (20 % случаев) [Braverman et al., 2021]. Патогенез РА при беременности связан с гиперэстрогенией, повреждением эластических волокон аорты и компрессией маткой аорты и дистальных отделов артерий таза, увеличением объема циркулирующей крови, ударного объема, частоты сердечных сокращений, повышением артериального давления.
Любые оперативные вмешательства на сердце и сосудах увеличивают риск расслоения аорты, причем как интраоперационно, так и в последующем. Пациенты с ятрогенной диссекцией аорты имеют высокую летальность, которая колеблется от 20 до 75 % в зависимости от времени диагностики [Скопин и др., 2016].
Повреждение аорты является второй по частоте причиной смерти пострадавших с закрытой травмой груди, а летальность может составлять > 80 % [Richens et al., 2003], при этом расслоение не является единственным осложнением травматического повреждения аорты, однако судить об истинной частоте развития РА сложно.
Доказана связь между РА и употреблением кокаина. Во-первых, при его приеме повышается АД вследствие центральной симпатической стимуляции, во-вторых, он провоцирует развитие ангиопатий – дилатации, снижения податливости и растяжимости, повышения индекса жесткости и скорости пульсовой волны, деформации и острого расслоения. Таким образом, кокаин провоцирует расслоение аорты напрямую и косвенно, а также может вызывать острое РА, что на фоне общей его фармакодинамики может спровоцировать летальный исход [Зыбалова и др., 2022].
Среди лекарственных средств наиболее изучено воздействие на стенку аорты фторхинолонов. Основным механизмом развития патологии аорты в данном случае считается увеличение экспрессии матриксных металлопротеиназ за счет снижения активности их эндогенных тканевых ингибиторов, что ведет к деградации внеклеточного матрикса [Изможерова и др., 2021].
Идиопатический кистозный медионекроз аорты (сидром Гзеля – Эрдгейма) также выступает в качестве редкого, но серьезного фактора риска разрыва и расслоения аорты [Komatsu et al., 2023].
Наследственные факторы риска
Мутация гена FBN1 при синдроме Марфана приводит к нарушению синтеза белка фибриллина-1. Основные сердечно-сосудистые проявления заключаются в дилатации аорты, предрасположенности ее к разрыву на уровне синусов Вальсальвы, пролапс митрального, трикуспидального клапанов, расширение проксимальной легочной артерии, расслоение аорты, особенно у беременных женщин с данным синдромом [Доброхотова, Боровкова, 2017; Наднациональные (международные) рекомендации…, 2018].
Синдром Элерса – Данло, тип IV (сосудистый) характеризуется нарушением синтеза коллагена типа III. Расслоение или разрыв возникают чаще в артериях среднего размера, реже это аорта, поражаются сосуды грудного и брюшного отдела [Asanad et al., 2022].
Синдром Луиса – Дитца, в частности типы 1, 2, 3, 5, 6 и тип с болезнью митрального клапана, приводит к нарушению TGF-бета-сигналинга и характеризуется повышенным риском развития аневризма аорты и РА [Regalado et al., 2011; Heald et al., 2015; Cannaerts et al., 2019], схожие изменения наблюдаются при синдроме артериальной извилистости.
Синдром мультисистемной дисфункции гладкой мускулатуры имеет синдромное проявление, которое увеличивает риск развития РА и аневризмы аорты (вследствие дегенерации ГМК), открытого аортального протока, стеноза и расширения сосудов головного мозга, легочной гипертензии, врожденного мидриаза, гипотонии кишечника и мочевого пузыря [Regalado et al., 2018].
Поликистоз почек, X-сцепленная перивентрикулярная гетеротопия, синдром Альпорта, синдром Нунан, кардиальная форма болезни Фабри, наследственная геморрагическая телеангиэктазия первого типа (синдром Рандю – Ослера – Вебера), синдром вялой кожи типа В ассоциированы с невысоким риском развития РА.
При представленных разновидностях синдрома Луиса – Дитца, а также при синдроме Элерса – Данлоса IV типа наблюдается самый большой риск раннего развития РА по сравнению с другими наследственными патологиями соединительной ткани [Schievink et al., 1995].
Мутация в гене АСТА2 являются самой частой причиной острой диссекции аорты (14 % случаев) среди всех семейных форм. Собственно, болезнь мойя-мойя представляет собой редкий цереброваскулярный синдром с поражением концевых ветвей внутренних сонных артерий, также отмечается повышенный риск расслоения грудной аорты [Schievink et al., 1995].
Синдром Шерешевского – Тернера сопровождается высоким разнообразием клинических признаков, среди которых двустворчатый аортальный клапан (15 % случаев), коарктация аорты (5–10 % случаев), повышенное артериальное давление (17 % случаев), дилатация корня аорты (8,8–42 %), РА (1–2 %) [Chaer et al., 2012].
Врожденные пороки сердечно-сосудистой системы
Двустворчатый аортальный клапан может быть ассоциирован с другими наследсвенными патологиями: коарктацией аорты (50 % случаев), надклапанным аортальным стенозом (30 % случаев) и др., что повышает риск развития сосудистых осложнений. В частности, риск расслоения аорты в 9 раз выше, чем у пациентов с трехстворчатым аортальным клапаном [Fatehi Hassanabad et al., 2019]. Сама корактация аорты, в свою очередь, также является фактором риска РА.
При дистальном смещении брахиоцефальной артерии и проксимальном смещении левой общей сонной артерии с формированием общего ствола риск РА I типа по De Bakey ниже на 89 % вследствие иного распределения гемодинамических сил [Шаданов и др., 2020], а значит, что отхождение от дуги аорты трех артериальных стволов в норме, в определенной степени способствует более эффективному (в негативном плане) воздействию других факторов риска.
Патогенез РА
На аорту приходится наибольший гидродинамический удар после систолы левого желудочка, но при наличии определенных факторов риска ее целостность нарушается, и от небольших изменений в гемодинамике может возникнуть дефект стенки. Кровь без препятствий течет по сосуду, но со временем, при наличии даже небольшого разрыва интимы, она может проникать в пространство интима-медиа. При этом кровь, с одной стороны, продолжает течь в просвете сосуда, а с другой – часть ее может накапливаться между внутренней и средней оболочками [Разумова и др., 2001], формируя ложный просвет.
Кровь из ложного просвета может вернуться в истинный через другой подобный разрыв интимы. Если этого не происходит, ложный просвет постепенно увеличивается, но наличие разветвления аорты может служить препятствием, а кровь начинает скапливаться с образованием интрамуральной гематомы. Гематома может спровоцировать расширение и истончение стенок аорты, а при высоком давлении это даже может спровоцировать разрыв стенок и сильные кровотечения [Гапонов и др., 2017].
Клиническая картина, последствия РА
Если образование гематомы происходит постепенно, то со временем она достигает достаточного (относительно диаметра ветви) размера, и сосуд сдавливается вплоть до окклюзии. В зависимости от характера непроходимости ветвей аорты (периодическая или постоянная) окклюзия может быть классифицирована как статическая, динамическая или смешанная. Статическая окклюзия возникает, когда интим-лоскут при расслоении закупоривает просвет артерии, причем ни гемодинамические силы, ни медикаментозная терапия не способны устранить ее, что приводит к тромбозу сосуда. При динамической окклюзии происходит компрессия истинного просвета, и из-за действия гемодинамических сил она имеет преходящий характер. Смешанная окклюзия возникает, когда в ветви аорты формируется статическая окклюзия, но кровь начинает поступать в эту артерию через ложный просвет вследствие неплотного прилегания интим-лоскута [Yang et al., 2016].
Само по себе ретроградное расслоение аорты является в определенной степени осложнением РА, так как процесс происходит на основе первоначального расслоения другой анатомической локализации. Например, расслоение аорты может распространяться ретроградно на основание аорты и полость перикарда, и, если происходит разрыв аорты, формируется гемоперикард и тампонада сердца [O'Gara, DeSanctis, 1995].
Если при расслоении типа A по Стэнфордской классификации процесс идет ретроградно, через корень аорты он распространяется и на коронарные артерии. Это может привести как к мальперфузии соответствующих областей сердца и развитию инфаркта миокарда, отрыву устья коронарной артерии и развитию кровотечения, в том числе в полость перикарда [Augoustides et al., 2009].
При восходящем расслоении аорты возможно развитие аортальной регургитации, что может привести к сердечной недостаточности. Ключевые аспекты данного осложнения основаны на расширении корня аорты, рассечении корня аорты с последующей мальперфузией створок аортального клапана или пролапса лоскута интимы через аортальный клапан [Movsowitz et al., 2000].
Динамическая или статическая окклюзия может возникать и относительно ветвей дуги аорты. Чаще всех поражается плечеголовной ствол – до 52,1 % случаев, реже – левая общая сонная артерия, до 34,7 % случаев, левая подключичная артерия – до 33,6 % случаев. Следует отметить возможность развития синдрома позвоночно-каротидного обкрадывания (steal – синдром) [Джоржикия и др., 2020].
Необычным осложнением РА является аорто-пищеводный свищ. Он может развиться при длительной компрессии пищевода со стороны аневризмы грудной клетки или при наличии сопутствующего повреждения стенки пищевода (например, во время операции) [Муслимов и др., 2020].
Нисходящее расслоение аорты может захватывать почечные артерии, что сопровождается снижением перфузии почек, перфузионного давления и, как следствие, снижение диуреза, то есть преренальной острой почечной недостаточности; возможно и развитие инфарктов почек [Аронов и др., 2021].
При окклюзии чревного ствола и мезентериальных артерий развивается синдром абдоминальной ишемии. Симптомы начинаются с боли в животе и нарушений перистальтики, и в худшем случае возникает гангрена кишечника. Окклюзия чревного ствола сопровождается ишемией печени и острой печеночной недостаточности [O'Gara, DeSanctis, 1995].
Расслоение, распространяющееся через левые задние межреберные артерии IX–XII, может затрагивать и артерию Адамкевича с развитием синдрома передней спинномозговой артерии. При критическом нарушении кровообращения может возникнуть спинальный ишемический инсульт [Магомедов и др., 2016].
При окклюзии подвздошных или бедренных артерий страдают нижние конечности [Разумова и др., 2001]. Симптоматика аналогична ишемии верхней конечности и также зависит от степени повреждения артерий. Ишемия нижних конечностей часто наблюдается в сочетании с ишемией внутренних органов [O'Gara, DeSanctis, 1995].
Заключение
Все многообразие и вся опасность осложнений расслоения аорты заключается в том, что изначально ограниченный лишь маленьким участком аорты процесс может распространяться дальше, в том числе по ветвям аорты, особенно при наличии широкой артериальной сети и обилия анастомозов. Вовлечение ветвей аорты в процесс расслоения чревато развитием органных поражений. По этим причинам трудно заранее предполагать развитие осложнений, особенно если это происходит под различными «масками». Опасность расслоения аорты дополняет и обилие его факторов риска. Возвращаясь к первым звеньям патогенеза, сложно поверить, что под небольшим дефектом стенки аорты скрывается такое многообразие заболеваний – как его формирующих, так и возникающих по его причине.
Thanks
The work was carried out without external sources of funding.





Reference lists
Aronov D.M., Bubnova M.G., Drapkina O.M. 2021. Patogenez ateroskleroza cherez prizmu narusheniya funkcij mikrososudov [Atherosclerosis Pathogenesis from the Perspective of Microvascular Dysfunction]. Kardiovaskulyarnaya terapiya i profilaktika, 20(7): 3076. doi: 10.15829/1728-8800-2021-3076
Gaponov D.P., Gorbunov M.G., Larionov A.A., Korzh D.A., Tarasov D.G. 2017. Endoprotezirovanie pri ostrom rassloenii grudnoj aorty, oslozhnivshemsya razryvom aorty [Thoracic Endovascular Aortic Repair in Acute Dissection of the Thoracic Aorta Complicated by Aortic Rupture]. Endovaskulyarnaya khirurgiya, 4(4): 307–311. doi: 10.24183/2409-4080-2017-4-4-307-311
Dzhorzhikiya RK, Akhmetzyanov R.V., Kamaltdinov R.R., Mirolyubov L.M. 2020. Rasprostranennost' porazheniya brahiocefal'nyh arterij pri ostrom rassloenii aorty tipa A [Prevalence of Brachiocephalous Arteries Lesions at Acute Aortic Dissection of Type A]. Vestnik meditsinskogo instituta «Reaviz», 4: 84–87.
Dobrokhotova Y.E., Borovkova E.I. Pregravidarnaya podgotovka i vedenie beremennosti u pacientok s displaziej soedinitel'noj tkani [Pregravid Preparation and Management of Pregnancy in Patients with Connective Tissue Dysplasia]. Ginekologiya, 19(5): 44–49.
Zybalova T.S., Dostanko N.Y., Yagur V.E., Boris A.M. 2022. Kokain kak faktor riska zabolevanij serdca i sosudov [Сocaine as a Risk Factor for Heart and Vascular Diseases]. Part 1. Kardiologiya v Belarusi, 14(1): 52–66. doi: 10.34883/PI.2022.14.1.006
Izmozherova N.V., Popov A.A., Bakhtin V.M., Markova E.V. 2021. Porazhenie aorty pri terapii ftorhinolonami. Bezopasnost' i risk farmakoterapii [Fluoroquinolone-Induced Aortic Injury]. Bezopasnost' i risk farmakoterapii. 2021; 9(2): 69–74. doi: 10.30895/2312-7821-2021-9-2-69-74
Kositsyna I.V., Snitsar' A.V., Golubev A.V., Patlachuk M.V., Varfolomeev S.I. 2019. Rassloenie aorty pod maskoj ostrogo koronarnogo sindroma: klinicheskie nablyudeniya [Aortic Dissection Under the Mask of Acute Coronary Syndrome: Clinical Observations]. Neotlozhnaya kardiologiya, 1: 13–18. doi: 10.25679/EMERGCARDIOLOGY.2019.26.36.002
Krupin K.N., Nedugov G.V. 2019. Sifiliticheskij aortit s letal'nym iskhodom v molodom vozraste [Syphilitic Aortitis with Fatal Outcome in Young Age]. Sudebnaya meditsina, 5(4): 34–38. doi: 10.19048/2411-8729-2019-5-4-34-38
Magomedov M.P., Gadzhiev A.N., Shikhabidov N.R., Alkhasov A.I., Saidov M.A. 2016. Rassloenie aorty, oslozhnennoe spinal'nym ishemicheskim insul'tom [Aortic Dissection Complicated by Spinal Ischemic Stroke]. Meditsinskiy vestnik MVD. 3(82): 25–29.
Mravyan S., Efanov A., Stepanova E., Podrez D. 2017. Razryv aorty u beremennoj s SKV [Aortic Dissection in Pregnant with SLE]. Vrach, 10: 43–49.
Muslimov R.S., Danielyan S.N., Popova I.E., Chernaya N.R. 2020. Aortopishchevodnyj svishch: etiopatogenez i diagnostika (obzor literatury) [Aotric Esophageal Fistula: Etiopathogenesis and Diagnostics (Review of Literature)]. Vestnik khirurgii imeni I.I. Grekova, 179(6): 89–93. doi: 10.24884/0042-4625-2020-179-6-89-93
Nadnacional'nye (mezhdunarodnye) rekomendacii po nasleduemym anevrizmam i rassloeniyam grudnoj aorty [Supranational (International) Guidelines for Heritable Thoracic Aortic Aneurysm and Dissection]. Meditsinskiy vestnik Severnogo Kavkaza. 2018; 13(1–2): 210–258. doi: 10.14300/ mnnc.2018.13038
Razumova E.T., Lusov V.A., Kokorin V.A. 2001. Rassloenie aorty [Aortic Dislayering]. Russian Journal of Cardiology, 5: 88–94.
Skopin I.I., Kakhktsyan P.V., Sokol'skaya N.O., Kopylova N.S. 2016. Sluchaj intraoperacionnoj dissekcii aorty posle operacii plastiki mitral'nogo i trikuspidal'nogo klapanov [Case of Intraoperative Aortic Dissection after Plastic Surgery of the Mitral and Tricuspid Valves]. Klinicheskaya fiziologiya krovoobrashcheniya, 13(2): 108–111.
Shadanov A.A., Sirota D.A., Bergen T.A., Lyashenko M.M., Chernyavskiy A.M. 2020. Anatomicheskaya variabel'nost' stroeniya dugi i grudnogo otdela aorty i ee vliyanie na patologicheskie sostoyaniya aorty [Anatomical Variability in the Structure of the Arch and Thoracic Aorta and its Influence on Aorta Related Pathological Conditions]. Patologiya krovoobrashcheniya i kardiokhirurgiya, 24(4): 72–82. doi: 10.21688/1681-3472-2020-4-72-82
Asanad S., Bayomi M., Brown D., Buzzard J., Lai E., Ling C., Miglani T., Mohammed T., Tsai J., Uddin O., Singman E. 2022. Ehlers-Danlos Syndromes and Their Manifestations in the Visual System. Front. Med, 9: 996458. doi: 10.3389/fmed.2022.996458
Augoustides J.G., Geirsson A., Szeto W.Y., Walsh E.K., Cornelius B., Pochettino A., Bavaria J.E. 2009. Observational Study of Mortality Risk Stratification by Ischemic Presentation in Patients with Acute Type A Aortic Dissection: the Penn Classification. Nat. Clin. Pract. Cardiovasc. Med, 6(2): 140–146. doi: 10.1038/ncpcardio1417
Braverman A.C., Mittauer E., Harris K.M., Evangelista A., Pyeritz R.E., Brinster D., Conklin L., Suzuki T., Fanola C., Ouzounian M., Chen E., Myrmel T., Bekeredjian R., Hutchison S., Coselli J., Gilon D., O'Gara P., Davis M., Isselbacher E., Eagle K. 2021. Clinical Features and Outcomes of Pregnancy-Related Acute Aortic Dissection. JAMA Cardiol, 6(1): 58-66. doi: 10.1001/jamacardio.2020.4876
Cannaerts E., Kempers M., Maugeri A., Marcelis C., Gardeitchik T., Richer J., Micha D., Beauchesne L., Timmermans J., Vermeersch P., Meyten N., Chenier S., van de Beek G., Peeters N., Alaerts M., Schepers D., Van Laer L., Verstraeten A., Loeys B. 2019. Novel Pathogenic SMAD2 Variants in Five Families with Arterial Aneurysm and Dissection: Further Delineation of the Phenotype. J. Med. Genet., 56(4): 220–227. doi: 10.1136/jmedgenet-2018-105304
Chaer R.A., Vasoncelos R., Marone L.K., Al-Khoury G., Rhee R.Y., Cho J.S., Makaroun M.S. 2012. Synchronous and Metachronous Thoracic Aneurysms in Patients with Abdominal Aortic Aneurysms. J. Vasc. Surg., 56(5): 1261–1265. doi: 10.1016/j.jvs.2012.04.056
de Boysson H., Espitia O., Samson M., Tieulié N., Bachmeyer C., Moulinet T., Dumont A., Deshayes S., Bonnotte B., Agard C., Aouba A. 2021. French Study Group for Large-Vessel Arteritis (GEFA). Giant Cell Arteritis-Related Aortic Dissection: A Multicenter Retrospective Study. Semin Arthritis Rheum, 51(2): 430–435. doi: 10.1016/j.semarthrit.2021.03.001
Fatehi Hassanabad A., Feindel C.M., Verma S., Fedak P.W.M. 2019. Evolving Surgical Approaches to Bicuspid Aortic Valve Associated Aortopathy. Front. Cardiovasc. Med., 6: 19. doi: 10.3389/fcvm.2019.00019
Heald B., Rigelsky C., Moran R., LaGuardia L., O'Malley M., Burke C.A., Zahka K. 2015. Prevalence of Thoracic Aortopathy in Patients with Juvenile Polyposis Syndrome-Hereditary Hemorrhgic Telangiectasia Due to SMAD4. Am. J. Med. Genet., 167A (8): 1758–1762. doi: doi:10.1002/ajmg.a.37093
Koechlin L., Schuerpf J., Bremerich J., Sommer G., Gahl B., Reuthebuch O., Gurke L., Mujagic E., Eckstein F., Berdajs D.A. 2021. Acute Aortic Dissection with Entry Tear at the Aortic Arch: Long-Term Outcome. Interact. Cardiovasc. Thorac. Surg., 32(1): 89–96. doi: 10.1093/icvts/ivaa228
Komatsu S., Takahashi S., Yutani C., Takewa M., Ohara T., Kodama K. 2023. Multiple and Multidirectional Fissure Bleedings in a Patient with a Spontaneous Isolated Dissection of the Iliac Artery. Cureus, 15 (5): e38374. doi:10.7759/cureus.38374
Movsowitz H.D., Levine R.A., Hilgenberg A.D., Isselbacher E.M. 2000. Transesophageal Echocardiographic Description of the Mechanisms of Aortic Regurgitation in Acute Type A Aortic Dissection: Implications for Aortic Valve Repair. J. Am. Coll. Cardiol., 36(3): 884–890. doi: 10.1016/s0735-1097(00)00766-x
O'Gara P.T., DeSanctis R.W. 1995. Acute Aortic Dissection and its Variants. Toward a Common Diagnostic and Therapeutic Approach. Circulation, 92(6): 1376–1378. doi: 10.1161/01.cir.92.6.1376
Regalado E.S., Guo D., Villamizar C., Avidan N., Gilchrist D., McGillivray B., Clarke L., Bernier F., Santos-Cortez R.L., Leal S.M., Bertoli-Avella A.M., Shendure J., Rieder M.J., Nickerson D.A., Milewicz D.M. 2011. Exome Sequencing Identifies SMAD3 Mutations as a Cause of Familial Thoracic Aortic Aneurysm and Dissection with Intracranial and Other Arterial Aneurysms. Circ. Res., 109(6): 680–686. doi: 10.1161/CIRCRESAHA.111.248161
Regalado E.S., Mellor-Crummey L., De Backer J., Braverman A.C., Ades L., Benedict S., Bradley T.J., Brickner M.E., Chatfield K.C., Child A., Feist C., Holmes K.W., Iannucci G., Lorenz B., Mark P., Morisaki T., Morisaki H., Morris S.A., Mitchell A.L., Ostergaard J.R., Richer J., Sallee D., Shalhub S., Tekin M, Estrera A., Musolino P., Yetman A., Pyeritz R., Milewicz D.M. 2018. Clinical History and Management Recommendations of the Smooth Muscle Dysfunction Syndrome Due to ACTA2 Arginine 179 Alterations. Genet. Med., 20(10): 1206–1215. doi: 10.1038/gim.2017.245
Richens D., Kotidis K., Neale M., Oakley C., Fails A. 2003. Rupture of the Aorta Following Road Traffic Accidents in the United Kingdom 1992–1999. The Results of the Cooperative Crash Injury Study. Eur. J. Cardiothorac. Surg, 23: 143–148. doi: 10.1016/S1010-7940(02)00720-0
Roy A.T., Singhal A.B. 2022. Pulse on Stroke in Pulseless Disease (Takayasu Arteritis). Stroke, 53 (5): 1558–1559. doi: 10.1161/STROKEAHA.121.036596
Schievink W.I., Michels V.V., Mokri B., Piepgras D.G., Perry H.O. 1995. A Familial Syndrome of Arterial Dissections with Lentiginosis. N. Engl. J. Med., 332(9): 576–579. doi: 10.1056/NEJM199503023320905
Wu P., Yu S., Zeng J., Yang L. 2023. Aortic Sinus Aneurysm Invading Ventricular Septum and Dissection Caused by Behcet's Disease: a Case Report and Literature Review. BMC Cardiovasc. Disord., 23(1): 429. doi: 10.1186/s12872-023-03420-7
Yang B., Patel H.J., Williams D.M., Dasika N.L., Deeb G.M. 2016. Management of Type A Dissection with Malperfusion. Ann. Cardiothorac. Surg., 5(4): 265–274. doi: 10.21037/acs.2016.07.04
Yuan X., Mitsis A., Nienaber C.A. 2022. Current Understanding of Aortic Dissection. Life (Basel), 12(10): 1606. doi: 10.3390/life12101606