Study of the Activity of Indicators of Systemic Inflammation and Surfactant Protein D in Chronic Obstructive Pulmonary Disease, their Relationship with the Nutritional Status of Patients
Annotation
Studying the levels of biomarkers of inflammation and surfactant protein D (SDP) in the peripheral blood of patients with chronic obstructive pulmonary disease (COPD) depending on the nutritional status (NS) of patients is relevant, since they are important factors in the progression of the disease.
Aim. To study the relationship between tumor necrosis factor-α (TNF-α), transforming growth factor β1 (TGFβ1), C-reactive protein (CRP), surfactant protein D (SPD) and NS in patients with COPD.
Materials and methods. 210 patients with COPD with different body mass index (BMI) were examined. Laboratory, instrumental (spirography, bioimpedansometry, pulse oximetry), spectrophotometric and immunoenzyme research methods were used.
Results. It is shown that in patients with COPD during an exacerbation of the disease, regardless of NS, there is an increase in the levels of TNFα, TGFβ1, CRP, as well as SDP in the blood serum, which is most pronounced when COPD is combined with obesity. A moderate correlation has been established between the level of SDP in the blood serum and the duration of smoking, as well as between SDP and BMI in patients with COPD; a negative correlation has been established between the level of SDP and indicators of external respiratory function.
Conclusion. The degree of increase in serum levels of TNF-α, TGFβ1 and CRP directly correlates with concomitant obesity in patients with COPD. The level of SDP in COPD depends on the patient’s NS and can serve as a diagnostic marker of the disease. Multivariate analysis confirms the dependence of the level of SDP in the blood serum on the parameters of bioimpedance analysis in COPD.
Keywords: chronic obstructive pulmonary disease, biomarkers, systemic inflammation, obesity, body mass index, surfactant protein D, transforming growth factor β1, C-reactive protein, bioimpedance measurement
Unfortunately, the article is available only in Russian
Введение
Хроническая обструктивная болезнь легких (ХОБЛ) – важная медицинская, социальная и экономическая проблема для всего мирового сообщества, в том числе для России, которая на сегодняшний день осложняется, прежде всего из-за несвоевременного выявления заболевания, а часто и вследствие неадекватного лечения [Christenson et al., 2022]. ХОБЛ является четвертой ведущей причиной смерти в мире и представляет серьезную угрозу здоровью населения. По подсчетам Всемирной организации здравоохранения ХОБЛ страдает 210 миллионов человек [Аgustí et al., 2023].
ХОБЛ связана с высоким риском возникновения сопутствующей патологии и системных проявлений, в частности артериальной гипертензии (АГ), сахарного диабета (СД), болезней сердца, остеопороза, рака и других заболеваний [Ефремова и др., 2016; Урясьев и др., 2020; Kahnert et al., 2023], которые могут существенно ухудшить прогноз [Драпкина и др., 2022].
Воспалительный процесс при ХОБЛ рассматривают не только в пределах бронхиального дерева, но и как хроническое системное субклиническое воспаление [Урясьев и др., 2020; Khatib et al., 2022; Almagro et al., 2024]. Неспецифическими маркерами обострения ХОБЛ считаются СРБ, амилоид А сыворотки крови, прокальцитонин, копептин, рост уровня которых может обусловливаться имеющимися коморбидными состояниями [Khatib et al., 2022; Kahnert et al., 2023].
В последнее время одним из потенциальных легочно-специфических показателей считается сурфактантный белок D. Предыдущие исследования продемонстрировали нарушение регуляции некоторых отдельных компонентов сурфактанта при ХОБЛ [Hristova et al., 2022]. Достоверное повышение его уровня в плазме крови больных ХОБЛ независимо от статуса курения свидетельствует, что СБД может рассматриваться как специфический маркер поражения респираторной системы при этом заболевании [Nandy et al., 2019; Rai et al., 2023].
Хотя потеря веса является обычным явлением у людей с ХОБЛ, в нескольких исследованиях сообщалось, что более половины населения с ХОБЛ классифицируются как люди с избыточным весом или ожирением [Щепихин и др., 2022; Yang et al., 2023]. Что еще более важно, пациенты с ХОБЛ с избыточным весом или ожирением имеют более высокий уровень распространенности сопутствующих заболеваний, включая гипертонию, диабет, остеоартрит и сердечную недостаточность, по сравнению с пациентами с ХОБЛ с нормальным весом [Machado et al., 2023; Almagro et al., 2024]. Ожирение при ХОБЛ коррелирует с ухудшением показателей здоровья, включая ухудшение одышки, качества жизни и способности к физической нагрузке по сравнению с пациентами с ХОБЛ, не страдающими ожирением [Щепихин и др., 2022; Ellulu et al., 2017]. Ожирение связано не только с субъективными результатами, но и с высоким риском острого обострения ХОБЛ, что приводит к увеличению количества госпитализаций и увеличению числа назначаемых лекарств [Yang et al., 2023; Alqarni et al., 2024].
Хотя снижение объема форсированного выдоха (ОФВ1) считается важным прогностическим маркером при ХОБЛ, исследования показали, что воспалительные маркеры могут предоставлять ценную информацию для диагностики и мониторинга ХОБЛ [Ташметова, 2022; Khatib et al., 2022; Rai et al., 2023]. Уже давно сообщалось, что снижение функции легких связано с наличием нескольких факторов, включая увеличение частоты обострений ХОБЛ. Снижение ФЖЕЛ также связано с ожирением, которое уменьшает пространство для расширения легких во время вдоха. Менделевское рандомизированное исследование показало, что ожирение увеличивает риск большинства респираторных заболеваний [Yang et al., 2023]. Однако данные о влиянии ожирения и его связи с клиническими исходами у пациентов с ХОБЛ ограничены. Учитывая большую распространенность ХОБЛ в России [Клинические рекомендации, 2023] и неоднозначные данные о влиянии нутритивного статуса на показатели провоспалительных цитокинов, сурфактантный белок D (СБД) в сыворотке крови при ХОБЛ, это исследование стремилось изучить их взаимосвязь и значимость для диагностики ХОБЛ у больных с ожирением.
Цель иследования: изучить взаимосвязь между фактором некроза опухолей-α (ФНО-α), трансформирующим фактором роста β1 (ТФРβ1), С-реактивным белком (СРБ), сурфактантным белком D (СБД) и нутритивным статусом больных ХОБЛ.
Материалы и методы
Исследование проводилось на базе терапевтического и пульмонологического отделений Областного государственного бюджетного учреждения здравоохранения «Городская больница № 2 г. Белгорода» на протяжении 2021–2023 гг.
В исследование были включены 210 пациентов, имеющих ХОБЛ по данным спирометрии (ОФВ1/ФЖЕЛ (%) < 70%) в возрасте от 50 до 79 лет. Продолжительность ХОБЛ на момент включения в исследование составляла от 2 до 15 лет. Среди исследуемых мужчин было 169 (80,5 %), женщин – 41 (19,5 %). Контрольная группа включала 30 практически здоровых лиц (ПЗЛ), группу сравнения составили 20 больных ожирением І и ІІ степени без ХОБЛ. Критерии включения в исследование: мужчины и женщины в возрасте ≥ 50 лет со стажем курения ≥ 10 лет; прогнозируемый объем форсированного выдоха после бронходилататоров в первую секунду (ОФВ1, %) < 80 % и при лечении хронической ХОБЛ. Пациенты, получавшие пероральные кортикостероиды или антибиотики по поводу недавнего обострения ХОБЛ, были исключены. Также исключены были больные с профессиональным или доказанным наследственным/врожденным характером заболевания и с сопутствующей тяжелой патологией других органов и систем.
Диагноз ХОБЛ устанавливался согласно Клиническим рекомендациям «Хроническая обструктивная болезнь легких» 2023 г. [Клинические рекомендации, 2023]. По данным спирографического обследования с проведением бронходилатационного теста, со ІІ стадией ХОБЛ было 111 больных (52,9 %), с ІІІ стадией – 83 больных (39,5 %), с ІV стадией – 16 больных (7,6 %). Индекс массы тела (ИМТ) рассчитывался с использованием формулы Кетле, и, согласно клиническим рекомендациям по ожирению [Клинические рекомендации, 2020], больные были распределены на следующие группы в зависимости от степени: 14 больных ХОБЛ с дефицитом массы тела (ИМТ < 18,5) составили 1 группу (гр.), 72 больных ХОБЛ с нормальным ИМТ = 18,5–24,9 – 2 гр.; 52 больных ХОБЛ с избыточной массой тела, ИМТ = 25,0–29,9 – 3 гр.; 72 больных ХОБЛ с ожирением, ИМТ > 30 – 4 гр. При этом с ожирением I степени при ИМТ = 30,0–34,9 был 51 пациент (подгруппа 4А), II степени (ИМТ = 35,0–39,9) – 13 пациентов (подгруппа 4Б) и ІІІ степени (ИМТ ≥ 40) – 8 пациентов (подгруппа 4В).
Клиническая картина обследованных больных представлена в табл.1.
Таблица 1
Table 1
Характеристика лиц, включенных в анализ (М ± SD; Ме [CI 25 % – 75 %], n (%))
Characteristics of persons included in the analysis (М ± SD; Ме [CI 25 % – 75 %], n (%))
Показатели | Дефицит массы тела, | Нормальная масса тела, | Избыточная масса тела, | Ожирение | ||
Ожирение I степени, | Ожирение II степени, | Ожирение III степени, | ||||
Возраст (лет) | 66,1 ±9,4 | 64,9 ± 9,1 | 63,7 ± 8,5 | 62,0 ± 8,1 | 59,5 ± 7,6 | 58,5 ± 8,6 |
Мужчины (%) | 10 (71,4) | 68 (94,4) | 36 (69,2) | 40 (78,4) | 8 (61,5) | 7 (87,5) |
Длительность ХОБЛ (лет) | 11,1 ± 2,4 | 12,6 ± 2,3 | 10,4 ± 2,1 | 9,4 ± 3,7 ^ | 8,5 ± 2,6 ^ | 7,5 ± 3,3 ^ |
Длительность курения (лет) | 31,9 ± 7,3 | 28,9 ± 6,7 | 21,9 ± 7,1 | 18,2 ± 7,8 *^ | 18,4 ± 5,2 *^ | 12,3 ± 3,5 *^ |
Курение, n (%) | 8 (57,1) | 46 (63,9) | 26 (50) | 21 (41,2) | 7 (53,8) | 4 (50) |
ИМТ (кг/м2) | 16,2 ± 2,0 | 20,8 ± 2,2 | 27,1 ± 1,8 | 32,7 ± 2,1 *^ | 37,4 ± 1,9 *^ | 42,3 ± 1,6 *^ |
Артериальная гипертензия, n (%) | 1 (7,1) | 18 (25) * | 35 (67,3) * ^ | 49 (96,1) *^ | 12 (92,3) *^ | 8 (100) *^ |
СД, типа 2, n (%) | 0 | 1 (1,4) | 4 (7,69) | 16 (31,4) * ^ | 5 (38,5) * ^ | 4 (50) * ^ |
ОФВ1 (%) | 53,5 [49,1–65,4] | 61,9 [57,3–66,2] | 62,7 [57,4–67,9] | 56,3 [51,7–60,2] | 54,4 [49,2–58,1] | 52,4 [48,6–57,4] |
ОФВ1/ФЖЕЛ (%) | 47,6 [40,5–54,3] | 52,4 [48,9–67,3] | 52,5 [46,3–57,1] | 50,5 [45,7–55,8] | 48,4 [43,1–53,5] | 47,3 [39,5–52,7] |
SaO2 | 82,1 [78,3–88,7] | 88,5 [85,4–92,6] | 70,4 [66,3–76,2] | 77,4 [74,3–83,9] | 76,4 [74,0–78,2] | 77,4 [70,5–79,1] |
Тест с 6-минутной ходьбой | 300 [280–390] | 350 [300–470] | 320 [290–510] | 310 [280–450] | 290 [250–310] | 290 [230–350] |
Примечание. * – достоверность различий по сравнению с группой больных ХОБЛ с дефицитом массы тела; ^ – достоверность различий по сравнению с группой больных ХОБЛ с нормальной массой тела.
В работе использованы следующие методы исследования: общеклинические, инструментальные (спирография, пульсоксиметрия), лабораторные (общий анализ крови и мочи, глюкоза крови, С-реактивный белок (СРБ)), спектрофотометрические (липидный спектр крови). Кроме этого, всем больным при поступлении и при выписке приводилось определение уровней фактора некроза опухоли альфа (ФНО-α), трансформирующего фактора роста бета-1 (ТФРβ1) и сурфактантного белка-D (СБД) в сыворотке крови с помощью иммуноферментных методов (ELISA). Статус курения был классифицирован как «действующий некурящий» или «действующий курильщик» согласно информации, сообщаемой самими пациентами. Сахарный диабет (СД) определялся в соответствии с предыдущим диагнозом или показателями глюкозы натощак ≥ 7,0 ммоль/л.
Работа выполнена в соответствии с этическими принципами проведения биомедицинских исследований, отраженными в Хельсинкской декларации Всемирной медицинской ассоциации. Одобрена этической комиссией медицинского института Белгородского государственного университета (протокол № 47 от 21.11.2021). Все лица, участвующие в исследовании, подписали добровольное информированное согласие.
Статистика. Непрерывные данные с нормальным распределением выражались как среднее значение ± стандартное отклонение (SD), а данные с ненормальным распределением отображались как медиана (межквартильный размах). Уровень статистической значимости различий между группами рассчитывался по критерию Вилкоксона. Категориальные переменные представлены в виде частоты (в процентах). Различия в категориальных переменных сравнивались между группами с использованием критерия хи-квадрат. Линейный регрессионный анализ и двумерный анализ Спирмена использовались для выявления взаимосвязи между каждым показателем. Дискриминантный анализ использовался для подтверждения полученных результатов. Все статистические анализы проводились с использованием StatSoft STATISTICA 10.0.1011 Eneterpise (×86/×64). Значение p < 0,05 считалось статистически значимым.
Результаты
Изучение показателей системного воспаления показало, что у больных ХОБЛ наблюдается повышенный уровень ФНО-α, ТФРβ1 и СРБ в сыворотке крови независимо от индекса массы тела (табл. 2). Содержание ФНО-α в сыворотке крови всех обследованных превышало таковое у практически здоровых лиц: в 2,4 раз (р < 0,001) – в 1 группе; в 1,9 раз (р < 0,001) – во 2 группе, в 3,1 раз (р < 0,001) – в 3-й группе, в 3,6 раз (р < 0,001) – в 4-й группе. Наибольшим уровень ФНО-α оказался у больных ХОБЛ с ожирением, у которых он превышал соответствующий показатель у лиц с ожирением без ХОБЛ – в 2,7 раз (р < 0,05), у больных ХОБЛ с нормальной массой тела – в 1,9 раз (р < 0,001), у больных ХОБЛ с избыточной массой тела – в 1,2 раза (р < 0,001).
Следует также отметить достоверное повышение уровня ТФРβ1 у всех больных ХОБЛ. У лиц с ХОБЛ с избыточным ИМТ (3 группа) он превышал таковой у практически здоровых лиц в 2,8 раз (р < 0,01), с 4 группой – в 2,8 раз (р < 0,01), с 4а группой – в 2,2 раза (р < 0,001), с 4б группой – в 2,7 раз (р < 0,001). При этом у больных ХОБЛ с ожирением (4 группа) содержание ТФРβ1 было больше такого во 2 группе в 1,5 раз (р < 0,05). Наивысший показатель указанного цитокина обнаружен у больных ХОБЛ с дефицитом массы тела, однако он не отличался от соответствующих величин в 4В группе.
При оценке уровня С-реактивного белка установлено, что у больных ХОБЛ с дефицитом массы тела и ожирением этот показатель был наибольшим. При этом у пациентов 4 группы он достоверно превышал таковой у лиц с ожирением без ХОБЛ (в 2,5 раз, р < 0,001). Эта же 4 группа имела в 1,4 раза (р < 0,001) выше уровень СРБ по сравнению со 2 группой и в 1,5 раза (р < 0,001) – по сравнению с 3 группой. При проведении корреляционного анализа у больных ХОБЛ с сопутствующим ожирением установлена слабая положительная корреляционная связь между содержанием ФНО-α в сыворотке крови и уровнем висцерального жира (r = 0,32, p < 0,05). Следовательно, у больных ХОБЛ в период обострения заболевания независимо от нутритивного статуса происходит рост уровня цитокинов в кровотоке, что является проявлением системного воспаления, наиболее выраженного при сочетании ХОБЛ с ожирением, которое связано с уровнем висцерального жира (подтверждается наличием положительной корреляции между содержанием висцерального жира и ФНО-α).
Таблица 2
Table 2
Уровни провоспалительных факторов больных ХОБЛ в зависимости от ИМТ (М ± SD)
Levels of pro-inflammatory factors in patients with COPD depending on BMI (M ± SD)
Показатели | ПЗЛ | Группа сравнения | 1 группа | 2 группа | 3 группа | 4 группа |
ФНО-α, | 5,6 ± 2,6 | 7,5 ± 3,6 | 13,4 ± 3,1 | 10,7 ± 2,4 | 17,1±4,2 | 20,0 ± 3,1 |
ТФРβ1, | 5520,4 ± 799,0 | 8406,5 ± 1022,3 | 20505,8 ± 2927,1 | 10166,6 ± 1496,1 | 11664,9 ± 1532,7 | 15423,3 ± |
CРБ, | 1,7 ± 0,3 | 3,4 ± 0,5 | 8,00 ± 0,9 | 5,9±0,9 | 5,6±0,8 | 8,4 ± 0,6 |
Примечание. р – достоверность различий по сравнению с группой здоровых лиц; р1 – достоверность отличий по сравнению с группой лиц с ожирением без ХОБЛ; р2 – достоверность различий по сравнению с группой больных ХОБЛ с дефицитом массы тела; р3 – достоверность различий по сравнению с группой больных ХОБЛ с нормальной массой тела; р4 – достоверность различий по сравнению с группой больных ХОБЛ с избыточной массой тела.
Актуален поиск специфических маркеров повреждения легких, одним из которых является сурфактантный белок D. Анализ результатов исследования содержания СБД в сыворотке крови практически здоровых лиц показал, что он зависел от статуса курения (был в 2 раза выше у курящих). В то же время следует отметить достоверное возрастание уровня СБД во всех группах больных ХОБЛ, степень которого зависела от нутритивного статуса пациента. Также уровень СБД в группах больных с ХОБЛ достоверно отличался от показателей СБД группы сравнения, которые не имели ХОБЛ (табл. 3).
Таблица 3
Table 3
Уровень сурфактантного белка D в сыворотке крови (нг/мл) (Ме [CI 25 % – 75 %])
Serum surfactant protein D level (ng/ml) (Ме [CI 25 %– 75 %])
Группы | Среднее значение | n | Ме [CI 25 % – 75 %] |
ПЗЛ | 70,4 | 35 | 70,0 [61–81] |
Группа сравнения | 113,2 | 26 | 112,5 [100–128] |
1 | 133,1 | 14 | 132,0 [128–138] |
2 | 173,0 | 72 | 179,0 [152–193] |
3 | 207,6 | 52 | 205,0 [197–216] |
4 | 250,8 | 72 | 242,0 [234,5–254] |
4А | 239,2 | 51 | 240,0 [231–245] |
4Б | 263,6 | 13 | 263,0 [253–271] |
4В | 304,4 | 8 | 301,5 [278–336] |
Примечание. Уровни СБД 4 группы и подгрупп (4А, 4Б и 4В) достоверно отличались от уровней 1, 2 и 3 групп, группы ПЗЛ и группы сравнения (р < 0,001). ПЗЛ – практически здоровые люди.
Диаграмма размаха сурфактантного белка D в сыворотке крови по группам наблюдения наглядно показывает повышенный уровень этого белка в группе больных, страдающих ХОБЛ (рисунок).
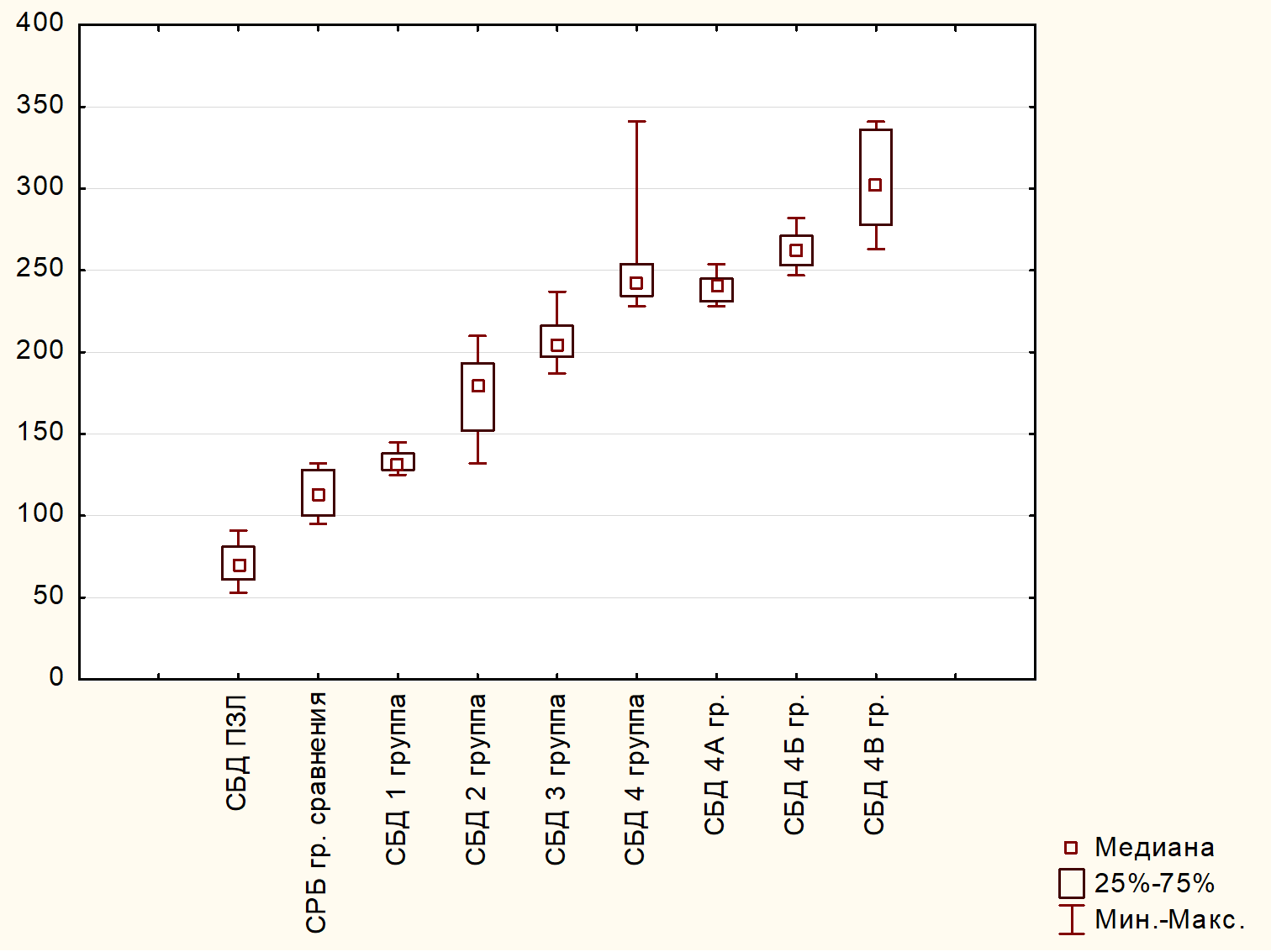 Диаграмма размаха сурфактантного белка D в сыворотке крови (нг/мл) по группам наблюдения
Диаграмма размаха сурфактантного белка D в сыворотке крови (нг/мл) по группам наблюдения
Diagram of the range of surfactant protein D in blood serum (ng/ml) by observation groups
В частности, у больных ХОБЛ с дефицитом массы тела содержание СБД в сыворотке крови увеличилось в 1,9 раза (р < 0,001), у больных ХОБЛ с нормальной массой тела – в 2,5 раз (р < 0,001), у больных ХОБЛ с избыточной массой тела – в 3 раза (р < 0,001) по сравнению с группой практически здоровых некурящих людей. При ХОБЛ с сопутствующим ожирением (4 группа) уровень СБД был выше уровня этого белка у пациентов с нормальной массой тела в 1,5 раза (p < 0,001), с дефицитом массы тела – в 1,9 раз (p < 0,001). По сравнению с группой практически здоровых лиц его содержание в сыворотке крови было выше в 3,6 раз (р < 0,001).
При проведении корреляционного анализа (табл. 4) у больных ХОБЛ установлена прямо пропорциональная зависимость средней силы между концентрацией СБД в сыворотке крови и длительностью курения (r = 0,421; p = 0,004).
В то же время уровень СБД положительно коррелировал с показателями биоимпедансного анализа: с ИМТ (r = 0,534; p = 0,0002), с процентом жира (r = 0,449; p = 0,003), с уровнем висцерального жира (r = 0,398; p = 0,008). Отрицательная связь установлена с мышечной массой (r = -0,301; p= 0,052). Установлена также обратно пропорциональная зависимость между содержанием СБД в сыворотке крови и показателями функции внешнего дыхания (ОФВ1 – r = -0,313; p = 0,039; ОФВ1/ФЖЕЛ – r = -0,331; p = 0,031). Следует отметить, что при наличии ХОБЛ у больных с ожирением наблюдалась положительная корреляционная связь средней силы между уровнем СБД и индексом BODE (r = 0,540; p = 0,121).
Таблица 4
Table 4
Корреляция Спирмена между исследуемыми показателями и СБД
Spearman correlation between the studied indicators and surfactant protein D
Показатели | Коэффициент корреляции | р |
Возраст | 0,109 | 0,459 |
Длительность курения | 0,421 | 0,003 |
Рост | 0,181 | 0,239 |
ИМТ | 0,534 | 0,0002 |
Процент жира | 0,449 | 0,003 |
Мышечная масса | -0,301 | 0,052 |
Уровень висцерального жира | 0,398 | 0,008 |
ОФВ1 | -0,313 | 0,039 |
ОФВ1/ФЖЕЛ | -0,331 | 0,031 |
ФЖЕЛ | -0,030 | 0,849 |
SaO2 | -0,110 | 0,491 |
Тест с 6-минутной ходьбой | -0,039 | 0,795 |
mMRC | 0,192 | 0,233 |
Индекс BODE | 0,540 | 0,021 |
Примечание. Шкала Medical Research Council (MRC) (mMRC) – шкала одышки; индекс BODE (Body mass index, Obstruction, Dyspnea, Exercise capacity).
Проведение многофакторного анализа подтверждает зависимость уровня СБД в сыворотке крови от показателей биоимпедансного анализа при ХОБЛ, что описывается следующим уравнением:
СБД = 83,7 + 3,8923 * ИМТ + 0,5041 * Процент жира - 0,8706 * Мышечная масса + 3,3856 * Уровень висцерального жира
(R2 = 0,250, R2adj = 0,175, p=0,019)
Результаты отдельных исследований показали, что уровень СБД в сыворотке крови является маркером заболевания легких у людей [Hristova et al., 2022; Hinata et al., 2023; Hsieh et al., 2023]. В последнее время изучается возможность использования данного показателя как специфического для поражения респираторной системы при ХОБЛ. В нашем исследовании подтверждается, что при обострении ХОБЛ наблюдается существенный рост содержания СБД в сыворотке крови. Поэтому, учитывая, что ХОБЛ на сегодняшний день рассматривается как «хронический системный воспалительный синдром», а СБД продуцируется в основном клетками легочной ткани (пневмоциты II типа и клетки Клара), повышение уровня СБД в сыворотке крови может служить диагностическим маркером заболевания.
Обсуждение
Последними эпидемиологическими, патофизиологическими и клиническими данными подтверждается, что ХОБЛ – это «хронический системный воспалительный синдром». Установлено, что ХОБЛ часто ассоциируется с существенными внелегочными изменениями, в которых участвуют медиаторы воспаления, вызывающие «системные эффекты»: кахексию, атрофию мышц и т. д. [Khatib et al., 2022; Аgustí et al., 2023].
Широко также обсуждается концепция системного воспаления как механизма «spillover» – попадания медиаторов воспаления из легких в системное кровообращение [Christenson et al., 2022; Hristova et al., 2022; Hinata et al., 2023]. Многочисленные исследования свидетельствуют о повышении уровня циркулирующих цитокинов и белков острой фазы в периферической крови у больных ХОБЛ, в частности ФНО-α и его рецепторов (TNFR-55 и TNFR-75), IL-6,8, СРБ, LPS-связывающего белка, Fas и Fas-L [Ташметова, 2022; Щепихин и др. 2022; Ellulu et al., 2017]. Эти нарушения наблюдались у пациентов с клинически стабильным течением болезни и усугублялись во время обострений заболевания [Ефименко и др., 2016]. Повысился интерес к дальнейшему установлению причин и механизмов развития обострений ХОБЛ, поскольку они являются важным фактором прогрессирования и смертности этого заболевания.
Исследование нами показателей системного воспаления позволило выявить, что у больных ХОБЛ в период обострения заболевания, независимо от нутритивного статуса, происходит существенный рост уровня ФНОα, ТФРβ1 и СРБ в сыворотке крови. Это является проявлением системного воспаления, наиболее выраженного при сочетании ХОБЛ с ожирением. Наиболее существенные изменения уровня ТФРβ1 в сыворотке крови при ХОБЛ у больных с дефицитом массы тела являются показателем не только системного воспаления, но и более выраженного фиброзирования легочной ткани [Романцова, 2021; Mulas et al., 2023].
При проведении корреляционного анализа между показателями системного воспаления и клиническими параметрами в нашем исследовании установлено, что ФНОα имеет взаимосвязь с уровнем висцерального жира (положительная корреляция, r = 0,310, p < 0,05). В ряде предыдущих работ также показано, что у людей с ожирением наблюдается двух- трехкратное увеличение циркулирующих уровней СРБ, ФНОα и интерлейкина-6 по сравнению с их нормальным весом. Ключевым источником воспаления, связанного с ожирением, является белая жировая ткань. При метаболическом стрессе белые адипоциты производят множество воспалительных цитокинов и молекул хемоаттрактантов, которые активируют и рекрутируют резидентные и нерезидентные иммунные клетки. Эти иммунные клетки, например, Т-лимфоциты и макрофаги, поддерживают воспалительное состояние в белой жировой ткани [Романцова, 2021; Mulas et al., 2023]. Cheng с соавторами обосновали связь между отложением эктопического и висцерального жира при ожирении и развитием идиопатического фиброза легких тем, что отложение жира в дыхательных путях и легких, перикарде, скелетных мышцах и поджелудочной железе прямо или косвенно способствует повреждению легких и фиброзу их [Cheng et al., 2023].
Актуален также поиск специфических маркеров повреждения легких, одним из которых может быть СБД – гидрофильный мультимерный гликопротеин из семейства коллагенообразных лектинов (коллектинов) [Hsieh et al., 2023]. СБД секретируется преимущественно пневмоцитами II типа и клетками Клара, а также в небольшом количестве – эндотелиальными клетками и железистыми клетками пищеварительного канала. В то же время он играет важную роль в гомеостазе сурфактанта, в обеспечении врожденного иммунитета и иммунной защиты от аллергенов, вирусов, бактерий и грибков, в удалении апоптотических клеток (эффероцитоз) и устранении воспаления. Роль СБД при ХОБЛ активно изучается. Однако результаты проведенных исследований по его связи с курением, с тяжестью ХОБЛ, с функциональными показателями внешнего дыхания противоречивы [Khatib et al., 2022; Au et al., 2023; Hsieh et al., 2023]. Анализ результатов наших исследований содержания СБД в сыворотке крови показал вероятное возрастание его уровня во всех группах больных ХОБЛ независимо от нутритивного статуса пациента. Максимальные показатели СБД наблюдались у больных ХОБЛ с ожирением III степени.
При проведении корреляционного анализа у больных ХОБЛ установлена прямо пропорциональная зависимость средней силы между концентрацией СБД в сыворотке крови и длительностью курения. Также уровень СБД положительно коррелировал с показателями биоимпедансного анализа (индексом массы тела, процентом жира, уровнем висцерального жира). Установлена также обратно пропорциональная зависимость между содержанием СБД в сыворотке крови и показателями функции внешнего дыхания (ОФВ1 и ОФВ1/ФЖЕЛ).
Результаты проведенного исследования свидетельствуют, что повышение уровня СБД в сыворотке крови может быть следствием курения, а также служить критерием обострения болезни. Корреляция между повышенными уровнями СБД в сыворотке и тяжестью ХОБЛ объясняется просачиванием альвеолярного СБД через воспаленную или поврежденную альвеолярно-капиллярную мембрану. Можно также утверждать, что уровень СБД при ХОБЛ зависит от нутритивного статуса больного. Установление прямо пропорциональной зависимости уровня СБД в сыворотке крови от тяжести заболевания, определяемой путем подсчета интегрального индекса BODE, обуславливает важность усовершенствования указанного показателя путем его корректировки с учетом показателей биоимпедансометрии.
Выводы
Хроническая обструктивная болезнь легких сопровождается системным воспалением, что сопровождается повышением содержания фактора некроза опухолей-α, трансформирующего фактора роста-β1 и С-реактивного белка в сыворотке крови, степень проявления которых наиболее выражена при наличии сопутствующего ожирения.
Уровень СБД при ХОБЛ зависит от нутритивного статуса больного и может служить диагностическим маркером заболевания (средней силы связь СБД с ИМТ, r = 0,534; p = 0,0002). Проведение многофакторного анализа также подтверждает зависимость уровня СБД в сыворотке крови от показателей биоимпедансного анализа при ХОБЛ.
Thanks
The work was carried out without external sources of funding.





Reference lists
Drapkina O.M., Kontsevaya A.V., Mukaneeva D.K., Smirnova M.I., Antsiferova A.A., Lukyanov M.M., Myrzamatova A.O., Mokhovikov G.I., Khudyakov M.B., Avdeev S.N. 2022. Forecast of the Socio-Economic Burden of Chronic Obstructive Pulmonary Disease in the Russian Federation in 2022. Pulmonology (in Russian). 32(4): 507–516. doi: 10.18093/0869-0189-2022-32-4-507-516
Efimenko E.V., Efremova O.A., Khodosh E.M. 2016. Diagnostic Features for probabilistic Risk Assessment of Exacerbations of Chronic Obstructive Pulmonary Disease. Scientific Bulletins of Belgorod State University. Series: Medicine. Pharmacy (in Russian). 5(226): 15–20.
Efremova O.A., Kamyshnikova L.A., Shelyakina E.V. Shkileva I.Yu., Khodosh E.M. 2016. The Role of Chronic Obstructive Pulmonary Disease in the Development of Multimorbid Pathology. Scientific Result. Medicine and Pharmacy (in Russian). 2(4): 13–18.
Clinical guidelines “Obesity” 2020 (17.02.2021) – Approved by the Ministry of Health of the Russian Federation (in Russian). Available at: http://disuria.ru/_ld/9/990_kr20E66mz.pdf (accessed: 05.12.2023)
Clinical recommendations «Chronic obstructive pulmonary disease» of the Russian Respiratory Society and the Russian public organization «Russian Scientific Medical Society of Therapists» 2023 (in Russian). Available at: https://spulmo.ru/upload/kr/HOBL_2023_draft.pdf (accessed: 15.01.2024)
Romantsova TI. 2021. Adipose Tissue: Colors, Depots and Functions. Obesity and Metabolism. 18(3): 282–301 (in Russian). doi: https://doi.org/10.14341/omet12748
Tashmetova G.T. 2022. The Importance of Cytokines in the Progression of Chronic Obstructive Pulmonary Disease. Central Asian Research Journal for Interdisciplinary Studies (CARJIS). 2(2): 232–241 (in Russian). doi: 10.24412/2181-2454-2022-2-232-241
Shchepikhin E.I., Shmelev E.I., Zaitseva A.S. 2022. Respiratory Diseases and Obesity: Distinct Phenotype or Independent Events. Therapeutic Archive. 94(3): 442–447 (in Russian). doi:10.26442/00403660.2022.03.201412
Uryasev O.M., Panfilov Yu.A., Granatkin M.A., Pyko A.A. 2020. Comorbid Pathology in Chronic Obstructive Pulmonary Disease. Bulletin of Volgograd State Medical University. 2 (74): 174–177 (in Russian).
Almagro P., Soler-Cataluña J.J., Huerta A., González-Segura D., Cosío B.G. 2024. CLAVE Study Investigators. Impact of Comorbidities in COPD Clinical Control Criteria. The CLAVE Study. BMC Pulm Med. 24(1): 6. doi: 10.1186/s12890-023-02758-0
Alqarni A.A., Badr O.I., Aldhahir A.M., Alqahtani J.S., Siraj R.A., Naser A.Y., Alghamdi A.S., Majrshi M., Alghamdi S.M., Alyami M.M., Alghamdi S.A., Alwafi H. 2024. Obesity Prevalence and Association with Spirometry Profiles, ICU Admission, and Comorbidities Among Patients with COPD: Retrospective Study in Two Tertiary Centres in Saudi Arabia. Int. J. Chron. Obstruct. Pulmon. Dis. 2024 Jan 16;19: 111–120. doi: 10.2147/COPD.S442851
Аgustí A., Celli B.R., Criner G.J., Halpin D., Anzueto A., Barnes P., Bourbeau J., Han M.K., Martinez F.J., de Oca M.M., Mortimer K., Papi A., Pavord I., Roche N., Salvi S., Sin D.D., Singh D., Stockley R., Victorina M., Varela L., Wedzicha J.A., Vogelmeier C.F. 2023. Global Initiative for Chronic Obstructive Lung Disease 2023 Report: GOLD Executive Summary. Eur. Respir. J. Mar 3:2300239. doi: 10.1183/13993003.00239-2023
Au D.H., Gleason E., Hunter-Merrill R., Barón A.E., Collins M., Ronneberg C., Lv N., Rise P., Wai T.H., Plumley R., Wisniewski S.R., Sciurba F.C., Kim D.Y., Simonelli P., Krishnan J.A., Wendt C.H., Feemster L.C., Criner G.J., Maddipati V., Mohan A., Ma J. 2023. Lifestyle Intervention and Excess Weight in Chronic Obstructive Pulmonary Disease (COPD): INSIGHT COPD Randomized Clinical Trial. Ann. Am. Thorac. Soc. 20(12): 1743–1751. doi: 10.1513/AnnalsATS.202305-458OC.
Cheng X., Jiang S., Pan B., Xie W., Meng J. Ectopic and Visceral Fat Deposition in Aging, Obesity, and Idiopathic Pulmonary Fibrosis: an Interconnected Role. Lipids Health Dis. 2023 Nov 24;22(1): 201. doi: 10.1186/s12944-023-01964-3
Christenson S.A., Smith B.M., Bafadhel M., Putcha N. 2022. Chronic Obstructive Pulmonary Disease. Lancet. Jun 11;399(10342): 2227–2242. doi: 10.1016/S0140-6736(22)00470-6
Ellulu M.S., Patimah I., Khaza'ai H., Rahmat A., Abed Y. 2017. Obesity and Inflammation: the Linking Mechanism and the Complications. Arch. Med. Sci. 13(4): 851–863. doi: 10.5114/aoms.2016.58928
Hinata D., Fukuda R., Okiyoneda T. 2023. The COPD-Associated Polymorphism Impairs the CFTR Function to Suppress Excessive IL-8 Production upon Environmental Pathogen Exposure. Int. J. Mol. Sci. 24(3): 2305. doi:10.3390/ijms24032305
Hristova V.A., Watson A., Chaerkady R., Glover M.S., Ackland J., Angerman B., Belfield G., Belvisi M.G., Burke H., Cellura D., Clark H.W., Etal D., Freeman A., Heinson A.I., Hess S., Hühn M., Hall E., Mackay A., Madsen J., McCrae C., Muthas D., Novick S., Ostridge K., Öberg L., Platt A., Postle A.D., Spalluto C.M., Vaarala O., Wang J., Staples K.J., Wilkinson T.M.A.; MICA II Study Group. 2022. Multiomics Links Global Surfactant Dysregulation with Airflow Obstruction and Emphysema in COPD. ERJ Open. Res. 2022 May 15;9(3): 00378–2022. doi: 10.1183/23120541.00378-2022.
Hsieh M.H., Chen P.C., Hsu H.Y., Liu J.C., Ho Y.S., Lin Y.J., Kuo C.W., Kuo W.S., Kao H.F., Wang S.D., Liu Z.G., Wu L.S., Wang J.Y. 2023. Surfactant Protein D Inhibits Lipid-Laden Foamy Macrophages and Lung Inflammation in Chronic Obstructive Pulmonary Disease. Cell. Mol. Immunol. 20(1): 38–50. doi: 10.1038/s41423-022-00946-2
Kahnert K., Jörres R.A., Behr J., Welte T. 2023. The Diagnosis and Treatment of COPD and Its Comorbidities. Dtsch. Arztebl. Int. 120(25): 434–444. doi: 10.3238/arztebl.m2023.027
Khatib S., Sabobeh T., Jaber F., Abdalla K., Singh S., Salzman G. 2022. Use of Laboratory Tests and Their Prognostic Value in Patients with Stable Chronic Obstructive Pulmonary Disease. Mo Med. 119(6): 545–552. PMID: 36588649; PMCID: PMC9762209
Machado F.V.C, Vogelmeier C.F., Jörres R.A., Watz H., Bals R., Welte T., Spruit M.A., Alter P., Franssen F.M.E. 2023. Differential Impact of Low Fat-Free Mass in People with COPD Based on BMI Classifications: Results from the COPD and Systemic Consequences-Comorbidities Network. Chest. 163(5): 1071–1083. doi: 10.1016/j.chest.2022.11.040
Mulas A., Cienfuegos S., Ezpeleta M., Lin S., Pavlou V., Varady K.A. Effect of Intermittent Fasting on Circulating Inflammatory Markers in Obesity: A Review of Human Trials. Front Nutr. 2023 Apr 17;10: 1146924. doi: 10.3389/fnut.2023.1146924
Nandy D., Sharma N., Senapati S. Systematic Review and Meta-Analysis Confirms Significant Contribution of Surfactant Protein D in Chronic Obstructive Pulmonary Disease. Front Genet. 2019;10:339. doi: 10.3389/fgene.2019.00339
Rai M., Parthasarathi A., Beeraka N.M., Kaleem Ullah M., Malamardi S., Padukudru S., Siddaiah J.B., Uthaiah C.A., Vishwanath P., Chaya S.K., Ramaswamy S., Upadhyay S., Ganguly K., Mahesh P.A. 2023. Circulatory Serum Krebs von Den Lungen-6 and Surfactant Protein-D Concentrations Predict Interstitial Lung Disease Progression and Mortality. Cells. 12(9): 1281. doi: 10.3390/cells12091281
Yang W., Yang Y., Guo Y., Guo J., Ma M., Han B. Obesity and Risk for Respiratory Diseases: a Mendelian Randomization Study. Front Endocrinol (Lausanne). 2023 Aug 29;14: 1197730. doi: 10.3389/fendo.2023.1197730