The Operation of Laparoscopic Isolation of the Portal Blood Flow as a Method for the Prevention of Post-Resection Liver Failure
Annotation
Over the past ten years, the incidence of cancer of various localization has been steadily increasing, liver neoplasms of both malignant and benign etiology are no exception. The fact remains undeniable that resection remains the radical method of treating liver neoplasms. However, to achieve radical treatment, it is often necessary to perform extended liver resections. Despite this, in some cases, large volumes of resection are not feasible due to the high risk of developing liver failure against the background of a low functional status of the liver, a small volume of the future liver residue. To this end, there are many techniques that allow to carry out a radical volume of the operation, but they all have their drawbacks. In our work, we used the method of minimally invasive, effective and safe prevention of post-resection liver failure. We operated on 36 patients with different etiologies of the disease, with an extremely low volume of remnant, which did not allow safe liver resection. At the first stage, all patients underwent laparoscopic isolation of the portal blood flow of the right lobe of the liver in order to form vicarious hypertrophy of the contralateral lobe of the liver. By the second stage, a sufficient volume of the future liver remnant to perform a safe resection was achieved in 33 cases (91 %). In the subsequent 33 patients, extended liver resection was performed: in 28 (84,8 %) cases, right-sided hemihepatectomy, in 5 (15,2 %) cases, extended right-sided hemihepatectomy. There were no lethal outcomes, post-resection liver failure developed in 3 cases (13 %).
Keywords: post-resection liver failure, remnant, planned liver remnant, extended resection, laparoscopic
Unfortunately, the article is available only in Russian
Введение
Актуальность. Благодаря широкому использованию лучевых методов диагностики в рутинной клинической практике в настоящее время диагностируется значительное число поражений печени. Большинство из этих поражений являются случайными находками у пациентов, проходящих обследование по поводу других состояний.
Поражения печени могут происходить из всех видов клеток печени, включая гепатоциты, мезенхимальную, а также холангиоцеллюлярную линию, и надежное выявление и характеристика поражений печени имеет решающее значение для оптимального ведения пациента. К счастью, большинство поражений печени, возникающих при нецирротическом ее поражении, являются доброкачественными. Кисты, гемангиомы печени, фокальные узловые гиперплазии и аденомы печени являются одними из наиболее часто встречающихся доброкачественных поражений [Baker et al., 2020].
Следует отметить, что заболеваемость первичным раком печени за последнее десятилетие выросла: в 2020 году было зарегистрировано 905 677 новых случаев и 830 180 смертей. Согласно самому высокому годовому коэффициенту смертности, рак печени является третьей по значимости причиной смерти от рака во всем мире, за последние 10 лет рядом авторов отмечен рост заболеваемости новообразованиями печени как злокачественной, так и доброкачественной (ФНГ, гепатоаденома, гемангиома) этиологии [Карпин и др., 2020; Estes et al., 2018; Global Burden of Disease Cancer Collaboration, 2019].
Колоректальный рак является одним из самых распространенных злокачественных новообразований во всем мире. Наиболее частым органом-мишенью метастазирования является печень, при этом у 40 % пациентов в течение жизни развиваются колоректальные метастазы в печень [Albati et al., 2019].
Хирургическая резекция является основным методом лечения и гарантией долгосрочного выживания у этой группы больных, однако не более чем у 25 % пациентов радикальное хирургическое вмешательство выполнимо. В настоящее время разработаны новейшие хирургические концепции, методы междисциплинарного ведения, включая процедуры интервенционной радиологии, которые улучшают возможности хирургического лечения [Chansangrat et al., 2021].
Вполне очевидно, что радикальным методом лечения является R0 резекция печени, её выполнение позволяет в ряде случаев достичь пятилетней выживаемости [Каниев и др., 2018; Galle et al., 2018; Mazzaferro et al., 2020].
Однако часто для достижения радикальной резекции необходимо прибегать
к расширенным объемам операции в виду частых признаков билобарного
поражения. Как следствие, зачастую обширные объемы резекций печени сопровождаются тяжелыми осложнениями, которые приводят к удлинению сроков
послеоперационного периода, а также нередко приводят к неблагоприятному исходу [Jin et al., 2013].
Хирургическое вмешательство с целью излечения является методом выбора
при опухолях печени, поскольку обеспечивает долгосрочную выживаемость. Однако только 20 % пациентов с метастатическим поражением печени могут быть
излечены радикальной резекцией печени. В большинстве случаев гемигепатэктомия невозможна из-за недостаточности будущего остатка печени (FLR). Двухэтапная
гемигепатэктомия рекомендуется для достижения технической возможности для резекции печени у пациентов, которые считаются не подходящими для выполнения радикальной операции.
Процедуры поэтапной гемигепатэктомии включают обычную двухэтапную гемигепатэктомию, эмболизацию воротной вены и ALLPS [Albati et al., 2019].
Значительные успехи в хирургических методах, а также прорывы в химиотерапии и биологических агентах привели к значительному улучшению прогноза.
Появление лапароскопической резекции печени в течение последних трёх десятилетий добавило совершенно новое измерение в лечение этого состояния. Сегодня метастазы колоректального рака являются одним из наиболее частых показаний к лапароскопической резекции печени во всем мире, однако выполнение резекционного вмешательства лапароскопическим способом может быть ограничено за счет предшествующей ALLPS, таким образом, с целью последующего лечения лапароскопическим способом оптимальным является выполнение 1 этапом ОЛИВК.
Одним из наиболее часто встречающихся и грозных осложнений обширных резекций печени является пострезекционная печеночная недостаточность [Глухов и др., 2020; Шабунин и др., 2020; Asenbaum et al., 2018].
Причинами развития данного вида осложнения являются малый объем планируемого остатка печени (FLR) и функционально неполноценная паренхима печени на фоне проведения химиотерапии, сопутствующих патологий (фиброз/цирроз печени, хронические гепатиты, стеатоз). При наличии данных факторов пациенты считаются хирургически неперспективными. Эмпирическим путем доказано, что необходимым безопасным значением является объем планируемого остатка печени более 20–30 % и 30–40 % (при скомпрометированной печени) исходного общего объема функционирующей паренхимы [Guglielmi et al., 2012].
Для профилактики пострезекционной печеночной недостаточности имеются множество технологий для создания викарной гипертрофии: открытое лигирование правой ветви воротной вены, рентгенэндоваскулярные методы, разделение паренхимы печени с лигированием правой ветви воротной вены и с сохранением оттока желчи, венозной крови и притока артериальной крови (ALLPS) [Schnitzbauer et al., 2012; Guiu et al., 2017; Müller et al., 2021].
Осложнения и летальность после двухэтапных резекций печени (портэмболизация + обширная резекция печени) – летальные исходы отмечены в единичных случаях, осложнения по Clavien-Dindo IIIA составляли 10–31 %, а послеоперационная печеночная недостаточность развивалась не более чем в 5 % случаев, согласно критериям IGILS и критерию 50–50 [Heil, Schadde, 2013].
Несмотря на разнообразие и количество литературных данных, единого консенсуса о лучшей методике профилактики пострезекционной печеночной недостаточности как в плане ее онкологической состоятельности, так и в безопасности нет.
Авторы констатируют, что в настоящее время в доступных базах медицинской литературы структурированных и систематизированных публикаций, касаемо непосредственных и отдаленных результатов применения и технологии ОЛИВК нет.
Цель. Провести анализ непосредственных результатов применения операции лапароскопической изоляции воротного кровотока (ОЛИВК) как способа формирования викарной гипертрофии ремнанта и профилактики развития тяжелой пострезекционной печеночной недостаточности.
Объект и методы исследования
За период с 2018 года по 2021 год в Кузбасском областном гепатологическом центре путем применения двухэтапной схемы подготовки к резекции печени пролечены 36 пациентов с диагностированными опухолями печени доброкачественной и злокачественной этиологией (табл. 1).
Таблица 1
Table 1
Характеристика пациентов
Characteristics of patients
Нозология | Пол | Средний возраст, лет ±σ | |
М | Ж | ||
Гемангиома (n=5) | 2 | 3 | 44,5 ± 10,3 |
Гепатоаденома (n=2) | 1 | 1 | 53,2 ± 10,7 |
ФНГ (n=3) | 1 | 2 | 38 ± 7,2 |
Колоректальные метастазы (n=18) | 11 | 7 | 59,5 ± 12,4 |
Гепатоцеллюлярный рак (n=7) | 4 | 3 | 53,2 ± 13,1 |
Холангиоцеллюлярный рак (n=1) | – | 1 | 47 |
всего | 19 | 17 | 52,1 ± 12,7 |
Мужчин было 19 (52,8 %), женщин 17 (47,2 %), средний возраст составил 52,1 ± 12,7 лет. По этиологическому признаку заболевания пациенты распределены следующим образом: колоректальные метастазы печени – 18 (50 %), эхинококкоз печени – 5 (13,8 %), гепатоцеллюлярный рак печени – 7 (20,2 %), гемангиома печени – 5 (13,8 %), холангиоцеллюлярный рак – 1 (2,2 %). Как видно из приведенных данных в таблице № 1, наибольшее количество пациентов в группе злокачественных новообразований печени (ЗНО) – 26 пациентов (72,2 %). В группе доброкачественных новообразований (ДНО) печени преобладает более молодой возраст по сравнению с группой ЗНО печени. Статистических различий в соотношениях мужчин и женщин не отмечено.
Во всех случаях пациентам показана была расширенная резекция печени: правосторонняя гемигепатэктомия в 30 случаях (83,3 %), расширенная правосторонняя гемигепатэктомия в 6 случаях (16,7 %). Всем пациентам предоперационно выполнялось комплексное обследование: общий анализ крови, мочи, развернутый биохимический анализ крови, электрофорез белков крови, определение группы крови с фенотипированием, коагулограмма, серологические анализы крови на гепатиты В и С, ВИЧ, сифилис, электрокардиограмма, флюорография, УЗИ органов брюшной полости, малого таза, в ряде случаев для определения функциональности паренхимы печени выполнялся ICG тест. В качестве дообследования выполнены КТ волюмометрия печени с помощью программного приложения «Volume» путем выделения контуров зоны интереса на последовательных аксиальных срезах и суммированием объема на каждом срезе для определения общего объема печени [Suzuki et al., 2011] и УЗИ волюмометрия печени по формуле M. Zoli [Zoli et al., 1989], по данным которых во всех случаях имелся недостаточный объем планируемого остатка печени (табл. 2).
Таблица 2
Table 2
Волюмометрия печени
Volumemetry of the liver
Нозология | Волюмометрия печени | FLR, % | ||
Правая доля, | Левая доля, | Объемное образование, | ||
Гемангиома (n=5) | 1135,5 ± 142,12 | 156,4 ± 24,43 | 293,2 ± 56,76 | 18,5 |
Гепатоаденома (n=2) | 852,4 ± 98,54 | 130,1 ± 31,65 | 312,7 ± 68,12 | 19,3 |
ФНГ (n=3) | 899,1 ± 99,54 | 142,2 ± 28,71 | 256,4 ± 87,62 | 18 |
Колоректальные метастазы (n=18) | 1005,4 ± 103,27 | 157,7 ± 45,65 | 269,4 ± 61,72 | 17,5 |
Гепатоцеллюлярный рак (n=7) | 985,2 ± 125,45 | 225,4 ± 27,82 | 345,7 ± 58,92 | 26,0 |
Холангиоцеллюлярный рак (n=1) | 1242 | 198 | 176 | 18,5 |
Объем планируемого остатка печени составлял в среднем 19,4 %, что являлось недостаточным для безопасного выполнения расширенной резекции печени. Наибольший объем ремнанта был в группе больных гепатоцеллюлярным раком печени, однако во всех случаях по результатам ICG теста функциональный статус печени был снижен на фоне стеатоза печени, вирусных гепатитов, проведенных курсов химиотерапии.
Результаты и их обсуждение
Всем пациентам первым этапом выполнена лапароскопическая изоляция воротного кровотока правой доли печени.
Протокол операции: Под ЭТН накладывается карбоксиперитонеум. В брюшную полость вводятся троакары, расположение которых характерно для холецистэктомии. Выполняется тракция за дно желчного пузыря краниально. Мобилизируется правая ветвь воротной вены, вена 4 сегмента, затем данные вены клипируются (рис. 1 и рис. 2), в анатомических пределах формируется демаркационная линия. Левая ветвь воротной вены прослеживается до уровня вхождения в паренхиму печени. Эвакуируется пневмоперитонеум.
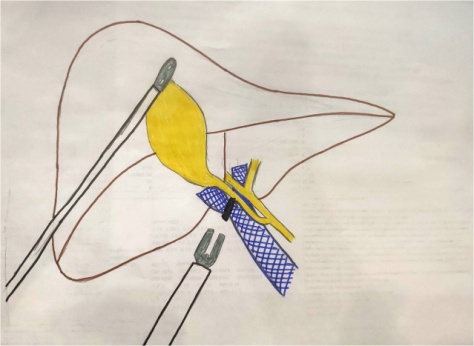
Рис. 1. Схема лапароскопического клипирования правой ветви воротной вены
Fig. 1. Scheme of laparoscopic clipping of the right branch of the portal vein
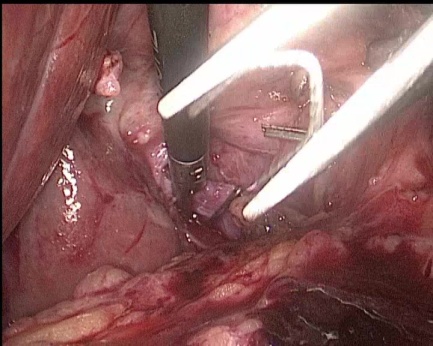
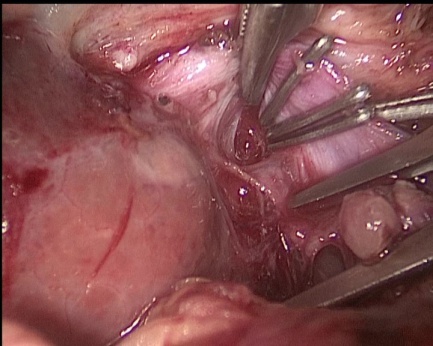
Рис. 2. Интраоперационные фотографии. Клипирование правой ветви воротной вены (ПВВВ)
Fig. 2. Intraoperative photographs. Clipping of the right branch of the portal vein (RBPV)
Среднее время операции составило 79,3 ± 29,86 минуты. Объем кровопотери расценивался как незначительный. В послеоперационном периоде на первые сутки в ряде случаев отмечено повышение ферментов АЛТ и АСТ до 2–3 норм. На фоне консервативного медикаментозного лечения явления цитолиза нивелировались. Осложнения оценивались по шкале Clavien – Dindo, во всех случаях составил I.
Летальных исходов не было. Срок пребывания в стационаре в среднем составил 4,5 ± 0,5 койко-дня (табл. 3).
При динамической УЗИ и КТ-волюмометрии печени через 4–6 недель в 33 случаях (91 %) имелся прирост планируемого остатка печени в среднем на 34 %.
Условия для безопасного выполнения расширенных резекций печени сформировались у больных в группе ЗНО в 23 (88,4 %) случаях, у больных с доброкачественными новообразованиями печени – в 10 (100 %) случаях.
Таблица 3
Table 3
Характеристика первого этапа операции
Characteristics of the first stage of the operation
Нозология | Среднее время операции, мин ± σ | Осложнения (Clavien – Dindo) | Койко-день ± σ |
Гемангиома (n=5) | 96 ± 10,11 | I | 4 |
Гепатоаденома (n=2) | 52,5 ± 6,76 | I | 4 |
ФНГ (n=3) | 59,2 ± 8,12 | I | 4 |
Колоректальные метастазы (n=18) | 97,5 ± 11,32 | I | 5 |
Гепатоцеллюлярный рак (n=7) | 70 ± 27,1 | I | 5 |
Холангиоцеллюлярный рак (n=1) | 65 | I | 5 |
Всего | 79,3 ± 29,86 | - | 4,5 ± 0,5 |
У 3 пациентов (8,3 %) отмечалось отсутствие прироста планируемого остатка печени, в одном из которых зарегистрировано прогрессирование основного заболевания (табл. 4).
Таблица 4
Table 4
Динамическая волюмометрия
Dynamic volumetry
Нозология | FLR в динамике, % |
Гемангиома (n=5) | 64,8 |
Гепатоаденома (n=2) | 56,9 |
ФНГ (n=3) | 49,1 |
Колоректальные метастазы (n=16) | 39,6 |
Гепатоцеллюлярный рак (n=6) | 57,3 |
Холангиоцеллюлярный рак (n=1) | 43,2 |
В последующем 33 пациентам (91 %) выполнен второй этап хирургического лечения: в 28 (84,8 %) случаях правосторонняя гемигепатэктомия (ПГЭ), в 5 (15,2 %) – расширенная правосторонняя гемигепатэктомия (РПГЭ).
Среднее время операции составило 143,4 минуты. Объем кровопотери в среднем 259,4 мл. В послеоперационном периоде в группе ЗНО клинико-лабораторные проявления пострезекционной печеночной недостаточности в 3 случаях (13 %), расцененные по шкале ISGLS как класс А, в группе с доброкачественными образованиями явления печеночной недостаточности зафиксировано не было.
Печеночная недостаточность купирована на фоне консервативной терапии. Осложнения по шкале Clavien – Dindo в группе с ЗНО печени составило II степень, в группе с доброкачественными образованиями печени – I степень. Летальных исходов зафиксировано не было. Срок пребывания в стационаре в среднем составил 13 койко-дней (табл. 5).
Таблица 5
Table 5
Характеристика второго этапа операции
Characteristics of the second stage of the operation
Нозология | Среднее время операции, мин.± σ | Средняя кровопотеря, мл ± σ | Осложнения (Clavien – Dindo) | Пострезекционная печеночная недостаточность (ISGLS), n, класс | Средний койко-день ± σ |
ПГЭ
| РПГЭ |
Гемангиома (n=5) | 110,4± 23,59 | 110,4± 56,32 | I | 0 | 12,4± 1,5 | 5 | 0 |
Гепатоаденома (n=2) | 135,7± 27,18 | 234,7± 25,12 | I | 0 | 11,5± 0,5 | 2 | 0 |
ФНГ (n=3) | 115,2± 26,19 | 110,1± 43,81 | I | 0 | 11,3± 0,7 | 3 | 0 |
Колоректальные метастазы (n=16) | 166,7± 16,82 | 356,5± 32,19 | II | 1, A | 16,5±2,5 | 13 | 3 |
Гепатоцеллюлярный рак (n=6) | 154,8± 34,16 | 387,8±55,45 | II | 1, A | 15,5±1,5 | 5 | 1 |
Холангиоцеллюлярный рак (n=1) | 149 | 250 | II | 1, A | 14 | 0 | 1 |
В группе ЗНО отмечается наибольший срок койко-дня, обусловленный развитием в 3 случаях (13 %) пострезекционной печёночной недостаточности, что требовало проведения продленной консервативной терапии до полного купирования явления печеночной недостаточности. Летальных исходов зафиксировано не было.
Выводы
ОЛИВК, обладая всеми преимуществами лапароскопических вмешательств на органах брюшной полости, позволяет формировать викарную гипертрофию ремнанта в условиях невозможности использования рентгенэндоваскулярных вмешательств (отсутствие визуализации правой ветви воротной вены (нет УЗИ окна, трудности визуализации из-за размеров опухоли, аллергическая реакция на контраст либо нефропатия)), исключить внепеченочную диссеминацию опухоли и тем самым своевременно изменить концепцию терапии, а также обеспечить необходимую полноту изоляции портального кровотока, так как всегда при ее применении имеется возможность редукции кровотока к 4 сегменту печени.
ОЛИВК позволила эффективно вызвать викарную гипертрофию ремнанта у 23 (88,4 %) больных с ЗНО печени и у 10 (100 %) больных с ДНО печени и условия для выполнения последующей безопасной резекции печени с позиций риска развития пострезекционной печеночной недостаточности, в оптимальные сроки (4–6 нед.) не допуская диссеминации и перехода в случае злокачественного опухолевого заболевания в инкурабельную стадию, а в случае доброкачественной патологии печени без избыточного нахождения под диспансерным наблюдением, что делает ее методикой выбора в случае невозможности применения рентген-эндоваскулярной эмболизации воротной вены, а в ряде случаев полной альтернативой ALLPS.
Этапные резекции печени расширенного объема после ОЛИВК характеризуются количеством осложнений и летальных исходов, сравнимым при таковых после рентгенэндоваскулярных операций на правой ветви воротной вены.





Reference lists
Glukhov A.A., Andreev A.A., Laptieva A.Yu., Ostroushko A.P. 2020. Pervichnaya profilaktika postrezektsionnoy pechenochnoy nedostatochnosti [Primary prevention of post-resection liver failure]. Profilakticheskaya meditsina. T. 23. № 5–2. S. 44–45 doi.12.17832/1893-5634.2367893-49.
Kaniev Sh.A., Baimakhanov Zh.B., Doskhanov M.O., Nurlanbaev E.K., Serikuly E., Birzhanbekov N.N., Skakbaev A.S., Baiguisova D.Z., Barlybay R.A., Sadykov Ch.T., Musakhanova Z.Zh., Turgan A.G., Chormanov A.T., Kausova G.K., Medeubekov U.Sh., Seisembaev M.A., Baimakhanov B.B. 2018. Sovremennye podkhody k lecheniyu ekhinokokkoza pecheni (obzor literatury) [Modern approaches to the treatment of liver echinococcosis (literature review)]. Annaly khirurgicheskoy gepatologii. 23 (3): 47–56. doi.10.16931/1995-5464.2018347-56.
Karpin A.D., Starinsky V.V., Shakhzadova A.O. 2020. Zlokachestvennye novoobrazovaniya v Rossii v 2019 godu (zabolevaemost' i smertnost') [Malignant neoplasms in Russia in 2019 (morbidity and mortality)]. Moskva: MNIOI im. P.A. Gertsena filial FGBU «NMITs radiologii» Minzdrava Rossii. 252 p. doi.19.18342/1943-9832.4367542-51.
Shabunin A.V., Parfenov I.P., Bedin V.V. [et al.]. 2020. Rezektsiya pecheni. Spetsificheskie oslozhneniya i ikh profilaktika. Khirurgiya [Liver resection. Specific complications and their prevention]. Zhurnal im. Pirogova N.I. № 3. S. 5–12. DOI 10.17116/hirurgia20200315.
Akinyemiju T. et al. 2017. The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level // JAMA Oncol. Vol. 3, № 12. P. 1683. doi: 10.1001/jamaoncol.2017.3055
Albati N.A., Korairi A.A., Hasan I.A., Almodhaiberi H.K., Algarni A.A. 2019. Outcomes of staged hepatectomies for liver malignancy. World J. Hepatol. Jun 27; 11 (6): 513–521. doi: 10.4254/wjh.v11.i6.513.
Asenbaum U., Kaczirek K., Ba-Ssalamah A., Ringl H., Schwarz C., Waneck F. et al. 2018. Post-hepatectomy liver failure after major hepatic surgery: not only size matters. Eur. Radiol. 28 (11): 4748–56. DOI: 10.1007/s00330-018-5487-y
Baker F.A., Zeina A.R., Mouch S.A., Mari A. 2021. Benign Hepatic Tumors: From Incidental Imaging Finding to Clinical Management. Korean J. Fam. Med. Jan; 42 (1): 2–8. doi: 10.4082/kjfm.18.0188.
Chansangrat J., Keeratibharat N. 2021. Portal vein embolization: rationale, techniques, outcomes and novel strategies. Hepat. Oncol. Sep 21; 8 (4): HEP 42. doi: 10.2217/hep-2021-0006.
Estes C., Razavi H., Loomba R., Younossi Z., Sanyal A.J. 2018. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology. Jan; 67 (1): 123–133. doi: 10.1002/hep.29466.
Galle P.R. et al. 2018. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma // J. Hepatol. Elsevier B.V. Vol. 69, № 1. P. 182–236. doi: 10.1016/j.jhep.2018.03.019
Global Burden of Disease Cancer Collaboration. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-Years for 29 Cancer Groups, 1990 to 2017: A Systematic Analysis for the Global Burden of Disease Study. JAMA Oncol. 2019; 5 (12): 1749–1768. doi:10.1001/jamaoncol.2019.2996
Guglielmi A., Ruzzenente A., Conci S., Valdegamberi A., Iacono C. 2012. How much remnant is enough in liver resection? Dig Surg. 29 (1): 6–17. doi: 10.1159/000335713.
Guiu B., Quenet F., Escal L., Bibeau F., Piron L., Rouanet P., Fabre J.M., Jacquet E., Denys A., Kotzki P.O., Verzilli D., Deshayes E. 2017. Extended liver venous deprivation before major hepatectomy induces marked and very rapid increase in future liver remnant function. Eur. Radiol. Aug; 27 (8): 3343–3352. doi: 10.1007/s00330-017-4744-9.
Heil J., Schadde E. 2020. Simultaneous portal and hepatic vein embolization before major liver resection. Langenbecks Arch Surg. 2021 Aug; 406 (5): 1295–1305. doi: 10.1007/s00423-020-01960-6. Epub. Aug 24. PMID: 32839889; PMCID: PMC8370912.
Jin S., Fu Q., Wuyun G., Wuyun T. 2013. Management of post-hepatectomy complications. World J. Gastroenterol. Nov 28; 19 (44): 7983–91. doi: 10.3748/wjg.v19.i44.7983
Kabir T., Syn N., Goh B.K.P. 2021. Current status of laparoscopic liver resection for the management of colorectal liver metastases. J. Gastrointest. Oncol. 2020 Jun; 11 (3): 526–539. doi: 10.21037/jgo.2020.02.05. PMID: 32655931; PMCID: PMC7340801major liver resection. Langenbecks Arch. Surg. Aug; 406 (5): 1295–1305. doi:10.1007/s00423-020-01960-6
Mazzaferro V., Gorgen A., Roayaie S., Droz Dit Busset M., Sapisochin G. 2020. Liver resection and transplantation for intrahepatic cholangiocarcinoma. J. Hepatol. Feb; 72 (2): 364–377. doi: 10.1016/j.jhep.2019.11.020.
Müller P.C., Linecker M., Kirimker E.O., Oberkofler C.E., Clavien P.A., Balci D., Petrowsky H. 2021. Induction of liver hypertrophy for extended liver surgery and partial liver transplantation: State of the art of parenchyma augmentation-assisted liver surgery. Langenbecks Arch. Surg. Nov; 406 (7): 2201–2215. doi: 10.1007/s00423-021-02148-2.
Schnitzbauer A.A., Lang S.A., Goessmann H., Nadalin S., Baumgart J., Farkas S.A., Fichtner-Feigl S., Lorf T., Goralcyk A., Hörbelt R., Kroemer A., Loss M., Rümmele P., Scherer M.N., Padberg W., Königsrainer A., Lang H., Obed A., Schlitt H.J. 2012. Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings. Ann. Surg. Mar; 255 (3): 405–14. doi: 10.1097/SLA.0b013e31824856f5.
Suzuki K., Epstein M.L., Kohlbrenner R., Garg S., Hori M., Oto A., Baron R.L. 2011. Quantitative radiology: automated CT liver volumetry compared with interactive volumetry and manual volumetry. AJR Am. J. Roentgenol. Oct; 197 (4): W 706–12. doi: 10.2214/AJR.10.5958.
Zoli M., Pisi P., Marchesini G., Bianchi G.P., Turci G.A., Pisi E. 1989. A rapid method for the in vivo measurement of liver volume. Liver. Jun; 9 (3): 159–63. doi: 10.1111/j.1600-0676.1989.tb00393.x