The Use of Biodegradable Wound Dressing in the Treatment of Donor and Burn Wounds in Patients with Thermal Injury
Annotation
We have undertaken a prospective analysis of 50 patients with burns in the topical treatment of which «ChitoPran» biodegradable coatings were used. The conditions for the most effective use of «ChitoPran» have been identified. The technique of optimal wound management after the application of «ChitoPran» is presented. The main errors in the application of wound dressing are noted. The clinical efficacy of «ChitoPran» was shown in comparison with traditional treatment: in patients with «ChitoPran» of the period of epithelialization of donor wounds were statistically significantly reduced (up to 8 days, instead of 11 days), the frequency of infectious complications decreased to 15 %, instead of 25 %. Pain intensity according to VAS decreased to 2 points instead of 5 points with traditional treatment, which allowed for earlier activation of patients. When using ChitoPran, histological analysis of the skin structure confirmed the development of a full-fledged epithelium.
Unfortunately, the article is available only in Russian
Введение
В последнее время, несмотря на снижение ожогового травматизма в РФ до 76,2 на 100 тыс. населения (для сравнения в 2009 г. – 210 на 100 тыс. населения), отмечается тенденция к увеличению тяжести ожоговой травмы [Алексеев, 2020]. При оказании специализированной медицинской помощи возникает необходимость в использовании современных раневых покрытий, без применения которых невозможно качественно улучшить лечение тяжелообожженных [Потекаев и др., 2017; Поляков и др., 2019; Halim et al., 2010; Luca-Pozner et al., 2021]. Биодеградирующие раневые покрытия все чаще применяются в местном лечении поверхностных ожогов, остаточных ожоговых ран, в лечении донорских ран [Крайнюков и др., 2018; Будкевич и др., 2020; Кузнецова и др., 2020; Abdel-Sayed et al., 2019; Yamakawa, Hayashida, 2019]. В настоящее время научный и практический интерес представляют раневые покрытия, созданные на основе хитозана [Богданов и др., 2020; Zulfiqar et al., 2020]. Благодаря антимикробной активности, устойчивости к условиям окружающей среды, высокой адсорбционной способности, адгезивной природе, превосходной проницаемости для кислорода хитозан стал одним из наиболее востребованных в лечении ран [Dai et al., 2011; Devi, Dutta, 2017; You et al., 2017]. Для отработки методики применения биодеградирующих покрытий на ожоговые раны мы рекомендуем начать использование их на донорские раны, которые фактически выступают моделью ожога IIIА степени или ожога II степени по МКБ-10. Полученный опыт позволит перенести клинические результаты на лечение поверхностных ожоговых ран, встречающихся почти в 70 % случаев [Borisov et al., 2017; Schiefer et al., 2022]. Однако в большинстве статей не отмечены особенности их использования при разных типах ран, в разные фазы раневого процесса, не представлены оптимальные условия для их применения (подготовка раневого поля, сроки наложения, вторичная повязка и т. д.), что приводит к получению неудовлетворительного результата и отказа от их использования в повседневной работе. Кроме того, клиническая эффективность часто определяется только по срокам эпителизации, без оценки болевого фактора, частоты инфекционных осложнений и сравнения гистологических параметров биоптатов эпителизированных участков кожи при разных способах лечения.
Цель работы. Улучшить результаты лечения донорских ран и поверхностных ожогов у больных с применением биодеградирующих раневых покрытий на основе
хитозана.
Материалы и методы
В рамках выполнения НИР НИИ СП им. Н.В. Склифосовского ДЗМ проведен проспективный анализ результатов лечения 50 пациентов, находившихся в ожоговом центре НИИ СП им. Н.В. Склифосовского ДМЗ в период 2020–2022 годы, которым в качестве раневого покрытия использовали биодеградируемый материал на основе хитозана «ХитоПран» (Биотекфарм, Россия). «ХитоПран» представляет собой биополимерный биопластический материал, который состоит из электроформованных субмикронных волокон (диаметром 400–500 нм) на основе хитозана, плотность материала – 25–30 г / м2. У 40 пациентов (1 группа) его использовали в лечении донорских ран, у 10 (2 группа) – на ожоги II степени (по МКБ-10). В группу сравнения вошли 45 пациентов: 25 (3 группа) – с донорскими ранами, в лечении которых традиционно применяли сухие стерильные марлевые салфетки в 1–2 слоя, и 20 пациентов с ожогами кожи II степени по МКБ-10 (4 группа), где использовались атравматические сетчатые повязки в сочетании с водорастворимыми мазевыми препаратами.
Проводили сравнение между 1 и 3 группой (пациенты с донорскими ранами) и 2 и 4 группами (пациенты с ожогами II степени по МКБ-10). Группы были сопоставимы по возрастно-половому составу, тяжести термической травмы (площадь и глубина поражения). В таблицах 1, 2 приведена краткая характеристика пациентов, участвующих в исследовании.
Таблица 1
Table 1
Сравнительная характеристика групп больных с донорскими ранами в зависимости от метода местного лечения
Comparative characteristics of groups of patients with donor wounds depending on the method of local treatment
Пациенты с донорскими ранами | Способ лечения донорских ран | ||
ХитоПран | Традиционное лечение | p, M-W | |
Число пациентов, n | 40 (1 группа) | 25 (3 группа) | – |
Возраст, лет | 52 (40,5; 67) | 53 (38; 67) | p > 0.05 |
Общая площадь ожога, % п. т.* | 11,5 (6; 19,3) | 11 (5; 23,5) | p > 0.05 |
Поверхностные ожоги, % п. т. | 6 (2; 10,3) | 5 (2; 11) | p > 0.05 |
Глубокие ожоги, % п. т. | 5 (3; 7) | 5 (3; 7) | p > 0.05 |
Примечание: * п. т. – поверхность тела.
Таблица 2
Table 2
Сравнительная характеристика групп больных с ожогами в зависимости от метода местного лечения ран
Comparative characteristics of groups of patients with burns depending on the method of local wound treatment
Пациенты с поверхностными ожогами | Способ лечения ожоговых ран | ||
ХитоПран Me (LQ; UQ) | Традиционное лечение Me (LQ; UQ) | p, M-W | |
Число пациентов, n | 10 (2 группа) | 20 (4 группа) | – |
Возраст, лет | 58 (45,5;77,3) | 51 (41; 63,5) | p > 0.05 |
Общая площадь ожога, % п. т.* | 8,5 (5;15,3) | 11 (4;17) | p > 0.05 |
Поверхностные ожоги, % п. т. | 3 (2;8,8) | 7 (1,8;15,5) | p > 0.05 |
Глубокие ожоги, % п. т. | 3 (2,6;6,5) | 2 (1,8;3) | p > 0.05 |
Примечание: * п. т. – поверхность тела.
Различия между сравниваемыми группами статистически незначимы.
На донорские раны повязки «ХитоПран» накладывали после полного гемостаза донорской раны и полного просушивания раневой поверхности. Повязка заходила на 2–3 см за пределы раны. «ХитоПран» укрывали атравматическим покрытием «ПараПран» и фиксировали стерильным марлевым бинтом. Техника наложения «ХитоПран» на длительно незаживающие и послеоперационные ожоговые раны II степени после выполнения хирургической обработки была аналогичной. Первую и последующие перевязки после этого проводили через 2–3 дня. Раневое покрытие «ХитоПран» с раны не снимали до полного заживления раны, оно резорбировалось естественным путем, производили смену только верхних слоев с целью контроля состояния раны. При необходимости на раневые участки, где «ХитоПран» биодеградировал, до периода её заживления повторно накладывали «ХитоПран».
Эффективность лечения оценивали по срокам эпителизации ран при применении биодеградируемых повязок и традиционном лечении. Кроме того, у больных с донорскими ранами на 1, 4, 7 сутки оценивали интенсивность боли по визуальной аналоговой шкале боли (ВАШ, Visual Analogue Scale, VAS) [Huskisson, 1974].
Полученные данные представлены в формате медиан (Me) и квартилей (LQ; UQ). Сравнительный статистический анализ проводили с применением критерия Манна – Уитни (кр. M-W). За уровень статистической значимости принято p < 0,05.
Результаты применения биодеградирующего раневого покрытия «ХитоПран» при лечении донорских ран
В лечении донорских ран «ХитоПран» применили у 40 пациентов с термической травмой. На донорские раны повязки «ХитоПран» накладывали после подготовки раневого ложа (рис. 1а и 1б). Необходимо выполнение тщательного гемостаза донорской раны, которое включало местное применение 0,1 % раствора адреналина в разведении на 400 мл 0,9 % NaCl.
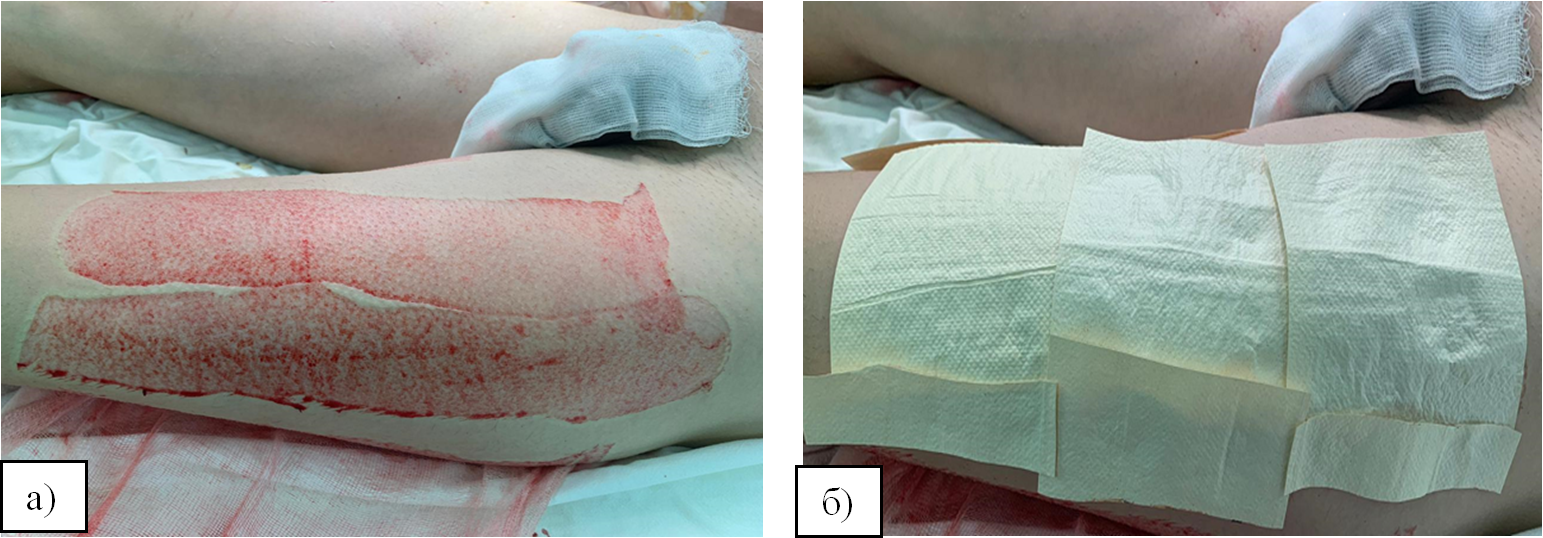
Рис. 1. Подготовка донорской раны (а) и наложение, применение биодеградирующего раневого покрытия «ХитоПран» (б)
Fig. 1. Preparation of a donor wound (a) and application of biodegradable wound dressing «ChitoPran» (b)
В период наложения повязки отмечали хорошее прилегание к раневой поверхности. Первую перевязку выполняли через 2–3 дня, удаляли поверхностные слои вторичной повязки до фиксированного на донорской ране раневого покрытия «ХитоПран» (рис. 2а)
Раневое покрытие превращалось в тонкую корку, плотно фиксированную к ране, исполняя роль «биологического струпа», под которым происходила краевая и островковая эпителизация. В дальнейшем происходило его самостоятельное отторжение, что избавляло пациентов от болезненных ощущений и не травмировало образовавшийся эпителий (рис. 2 б).
 Рис. 2. Раневое покрытие «ХитоПран» фиксировано к раневому ложу в виде сухого струпа (а). Активная эпителизация донорской раны под раневым покрытием «ХитоПран» на 6 сутки после наложения (б)
Рис. 2. Раневое покрытие «ХитоПран» фиксировано к раневому ложу в виде сухого струпа (а). Активная эпителизация донорской раны под раневым покрытием «ХитоПран» на 6 сутки после наложения (б)
Fig. 2. «ChitoPran» wound dressing is fixed to the wound bed in the form of a dry scab (a). Active epithelialization of the donor wound under the wound dressing «ChitoPran» on the 6th day after application (b)
Повязки «ХитоПран» легко удалялись с эпителизированной поверхности ран, при этом травматизации образованного эпителия не отмечено. Для оценки степени зрелости эпителия нами было выполнено гистологическое исследование донорских ран в пределах одной анатомической области, где применялись раневое покрытие «ХитоПран» и марлевая салфетка (контрольная рана) (рис. 3). Материал забирали на 15 сутки с помощью Punch-биопсии (Punch № 3,0).
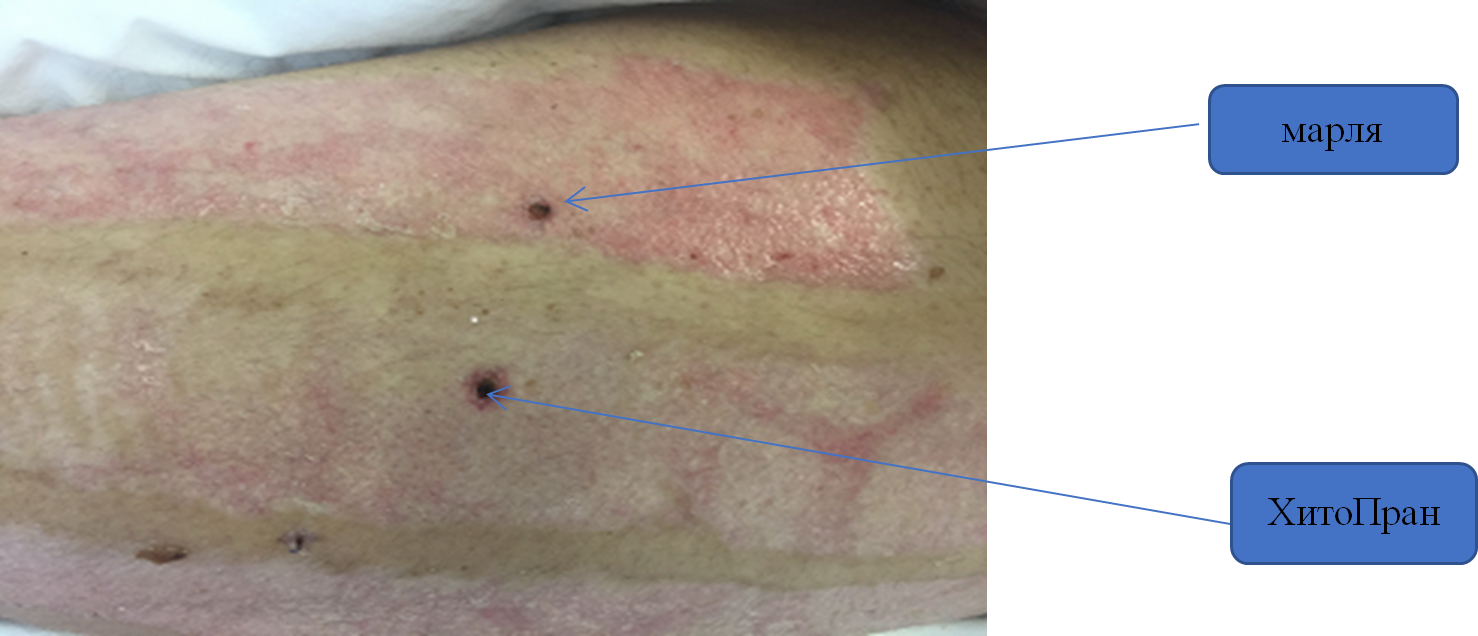 Рис. 3. Punch-биопсия (Punch № 3,0) области заживших донорских ран (15 сутки)
Рис. 3. Punch-биопсия (Punch № 3,0) области заживших донорских ран (15 сутки)
Fig. 3. Punch biopsy (Punch No. 3.0) of the area of healed donor wounds (day 15)
При гистологическом анализе структуры кожи после применения биодеградирующей повязки «ХитоПран» были получены следующие результаты: край «донорского» дефекта кожи с интенсивной полноценной эпителизацией, зрелый многослойный плоский эпителий, формируя акантотические тяжи, нарастает на раневую поверхность (рис. 4а). На рис. 4б представлен гистологический анализ зажившего участка донорской раны под сухой марлевой салфеткой. Широкий край раневого дефекта, выстланный фибрином, с замедленной регенерацией и замещением тонким слоем плоского эпителия.
 Рис. 4. Гистологическое исследование эпителизации донорской раны при использовании покрытия «ХитоПран» (а) и марлевой повязки (б). (Окраска среза гематоксилином и эозином × 200)
Рис. 4. Гистологическое исследование эпителизации донорской раны при использовании покрытия «ХитоПран» (а) и марлевой повязки (б). (Окраска среза гематоксилином и эозином × 200)
Fig. 4. Histological examination of the epithelialization of the donor wound when using the «ChitoPran» coating (a) and gauze dressing (b). (Section with hematoxylin and eosin × 200)
Эпителизация в более ранние сроки участков донорских ран с применением современных раневых покрытий позволила повторно выполнить забор аутотрансплантатов у больного с дефицитом донорских ран с заживших участков. Отметим, что применение биодеградирующих раневых покрытий «ХитоПран» позволило статистически значимо сократить сроки эпителизации донорских ран по сравнению с традиционным лечением (табл. 3).
Таблица 3
Table 3
Сроки эпителизации донорских ран в зависимости от метода местного лечения
Days of epithelialization of donor wounds depending on the method of local treatment
Пациенты с донорскими ранами | ХитоПран | Традиционное лечение | p, M-W |
Число пациентов, n | 40 | 25 | – |
Сроки эпителизации, дни | 8 (8;9) | 11 (10; 12) | P < 0.05 |
Кроме того, при лечении донорских ран с «ХитоПраном» снижалась интенсивность боли, оцениваемая по ВАШ на 1, 4, 7 сутки. Результаты представлены на рисунке 5.
Пациенты, у которых применяли «ХитоПран» (1 группа), интенсивность боли в донорской ране в 1 сутки оценивали в 2 (1; 3) балла, тогда как пострадавшие с традиционным лечением (3 группа) – 5 (5; 6) баллов, что было статистически значимо (p ˂ 0,05; кр. M-W). На 4 сутки оценка интенсивности боли среди пациентов 1 и 3 групп не изменилась. Меньшая интенсивность боли у пациентов с применением «ХитоПрана» позволила активизировать их уже на 3–4 сутки после операции. На 7 сутки интенсивность боли у пациентов 1 группы составила 1 (1; 1) балл («ХитоПран») и 2 (1; 3) балла в 3 группе (традиционное лечение) соответственно (p ˂ 0,05; кр. M-W).
Биополимерная повязка исполняла роль защитного биологического струпа; нагноение донорской раны отмечено у 15 % пациентов 1 группы. У пациентов 3 группы нагноение ран развилось в 25 % случаев, что потребовало выполнения дополнительных перевязок и увеличило сроки госпитализации.
Несмотря на значительные успехи при применении раневых покрытий «ХитоПран» следует учитывать особенности их использования у ожоговых больных.

Рис. 5. Интенсивность боли в донорских ранах в зависимости от метода местного лечения (на 1, 4, 7 сутки)
Fig. 5. Intensity of pain in donor wounds depending on the method of local treatment (on days 1, 4, 7)
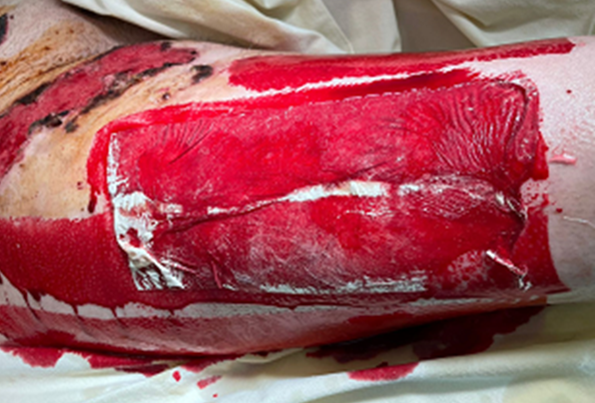
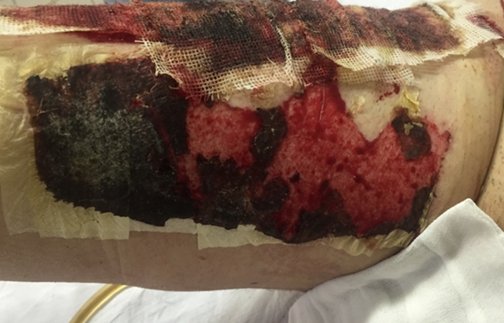
При наложении на донорские раны с недостаточно тщательно выполненным гемостазом повязка «ХитоПран» теряет свою структуру и деформируется (рис. 6а). При обильном пропитывании кровью повязки «ХитоПран» в раннем послеоперационном периоде (1–2 сутки) полностью биодеградировали, рана обнажалась (рисунок 6б). В этом случае на открытые участки раны повторно накладывали «ХитоПран».
|
|
Рис. 6а. Изменение структуры «ХитоПран» Fig. 6a. Changes in the structure of «ChitoPran» upon contact with blood | Рис. 6б. Частичная биодеградация «ХитоПран» с обнажением фрагмента донорской раны Fig. 6b. Partial biodegradation of «ChitoPran» with exposure of a fragment of a donor wound |
У 2 (5 %) из 40 пациентов отмечали плотную фиксацию «ХитоПрана» к раневому ложу донорской раны с последующим высыханием ее и формированием тонкой корочки без признаков краевой и островковой эпителизации в течении 28–30 дней. Даже после наложения гидрофобных мазей раневое покрытие оставалось плотно фиксированным к ране, а его удаление приводило к травматизации крайне слабого неоэпителия и появлению эрозий (рис. 7). Это были ослабленные пациенты в возрасте более 80 лет с онкологическим анамнезом.

Рис. 7. Нарушение эпителизации донорской раны с появлением эрозированной поверхности
Fig. 7. Violation of the epithelization of the donor wound with the appearance of an eroded surface
Результаты применения биодеградирующих повязок в лечении ожоговых ран
Учитывая мягкую и пористую структуру раневого покрытия, высокую сорбционную способность, мы не использовали «ХитоПран» на ранах с обильным отделяемым (в 1–5 сутки). Применяли раневые покрытия «ХитоПран» на ожоговые раны II степени (МКБ-10) в более поздние сроки, интраоперационно, после выполнения тангенциальной некрэктомии в пределах дермы у 10 пациентов (2 группа). Первую перевязку выполняли на 4–5 сутки после операции (рис. 8а), отмечая частичное заживление ожоговой раны под сухим биологическим струпом с участком инфицированной гематомы. К 9 суткам отмечена активная эпителизация ожоговой раны (рис. 8б).

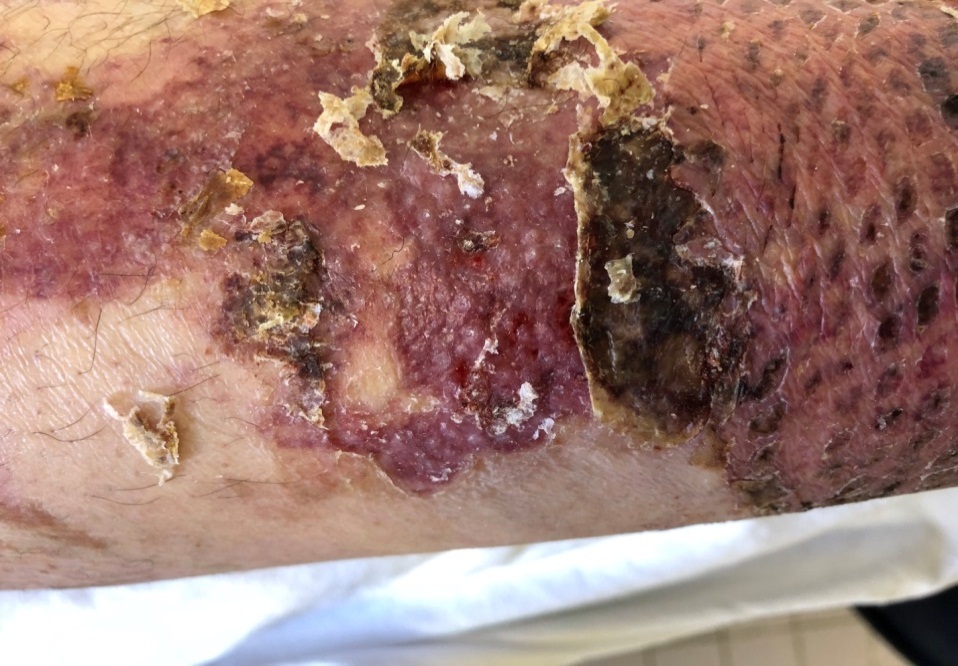
Рис. 8. Вид раны на 5 (а) и 9 (б) сутки после операции тангенциальной некрэктомии и наложения раневых покрытий «ХитоПран»
Fig. 8. View of the wound on days 5 (a) and 9 (b) after the operation of tangential necrectomy and the application of «ChitoPran» wound dressings
Заживление проходило по типу «донорской раны», под сухим струпом, за счет островковой эпителизации. Участки инфицирования были локальными, отграниченными, в последующем не распространялись. Биодеградирующие повязки «ХитоПран» показали себя в лечении ожоговых ран как эффективные раневые покрытия, благодаря которым удалось существенно сократить сроки эпителизации пограничных ожогов в сравнении с традиционным лечением (табл. 4).
Таблица 4
Table 4
Сроки эпителизации ожоговых ран в зависимости от метода местного лечения
Days of epithelialization of burn wounds depending on the method of local treatment
Пациенты с ожогами | Способ лечения ожоговых ран II степени | ||
ХитоПран | Традиционное лечение | p, M-W | |
Число пациентов, n | 10 (2 группа) | 20 (4 группа) | – |
Сроки эпителизации, дни | 12 (10,5; 13,8) | 18 (14; 20) | p < 0.05 |
Обсуждение
В настоящее время основным патогенетически обоснованным методом лечения глубоких ожогов III степени является хирургическое восстановление кожного покрова с помощью расщепленных или полнослойных аутотрансплантатов кожи. После взятия лоскутов кожи у пациента остаются раны, называемые «донорскими», требующие местного лечения. Традиционно для местного лечения донорских ран предлагается использовать влажно-высыхающие марлевые повязки с растворами антисептиков [Атясов, 1989]. При таком способе лечения, по данным разных авторов, заживление ран донорских участков занимает от 7 до 26 дней [Крайнюков и др., 2018; Asuku et al., 2021]. В случае возникновения инфекционных осложнений или длительном заживлении восстановление кожного покрова может длиться 44 ± 3,8 суток и потребовать дополнительного хирургического лечения [Крайнюков и др., 2018]. Способность повязок при биодеградировании стимулировать процесс эпителизации показал их высокую клиническую эффективность. Применение их в лечении донорских ран позволило уменьшить сроки эпителизации ран до 8 суток вместо 11 суток при традиционном лечении, привело к достоверному снижению интенсивности боли до 2 баллов против 5 при традиционном лечении. Отмечено снижение частоты инфекционных осложнений до 15 % против 25 %. Все это в совокупности способствовало ранней активизации пациентов, сокращению сроков госпитализации. Однако использование «ХитоПран» в повседневной клинической практике требует определенного опыта, знаний условий их применения, показания и противопоказания в разные фазы раневого процесса для получения оптимального результата. Применение мазевых препаратов может губительно сказаться на раневых покрытиях «ХитоПран». Но даже возникшие в результате применения местные осложнения могут быть купированы при правильной и своевременной коррекции лечения.
Вывод
Применение биодеградируемых раневых покрытий на основе хитозана в лечении донорских ран позволяет уменьшить интенсивность боли, сократить сроки эпителизации и улучшить качество эпителия, что поможет решить проблему дефицита донорских ресурсов. Использование биодеградирующих раневых покрытий на пограничных ожоговых ранах после выполнения дермабразии или поверхностной некрэктомии создает оптимальные условия для заживления ожоговых ран в более короткие сроки без образования гипертрофических рубцов. Биодеградирующие повязки «ХитоПран» являются более эффективным средством для лечения ран в сравнении с марлевыми салфетками.





Reference lists
Alekseev A.A. 2020. Osnovnye statisticheskie pokazateli raboty meditsinskikh organizatsiy Rossii po okazaniyu spetsializirovannoy meditsinskoy pomoshchi postradavshim ot ozhogov v 2019 godu [The main statistical indicators of the work of medical organizations in Russia to provide specialized medical care to victims of burns in 2019]. Protokol zasedaniya profil'noy komissii po kombustiologii Minzdrava Rossii sovmestno s Plenumom Obshcherossiyskoy obshchestvennoy organizatsii «Ob"edinenie kombustiologov «Mir bez ozhogov», 29 oktyabrya 2020 g. Available at: http://combustiolog.ru/news_site/zasedaniya-profil-noj-komissii-po-kombustiologii-minzdrava-rossii-sovmestno-s-plenumom-obshherossijskoj-obshhestvennoj-organizatsii-ob-edinenie-kombustiologov-mir-bez-ozhogov-29-10-2020/ (accessed 14 Sept 2022).
Atjasov N.I. 1989. Lechenie ran donorskih uchastkov pri svobodnoj kozhnoj plastike u obozhzhjonnyh [Treatment of wounds of donor sites with free skin grafting in burnt patients]. Saransk: MGU, 91.
Bogdanov S.B., Karakulev A.V., Gilevich I.V., Melkonyan K.I., Polyakov A.V., Sotnichenko A.S. 2020. Opyt primeneniya ranevogo pokrytiya «KhitoPran» pri lechenii patsiyenta s kombinirovannoy travmoy [The experience of using «chitopran» wound coating for treating a patient with combined injury]. Ortopediya, travmatologiya i vosstanovitel'naya khirurgiya detskogo vozrasta, 8 (3): 327–332.
Borisov V.S., Afanasov I.M., Filatov I.Yu., Kaplunova M.Yu., Loginov L.P., Smirnov K.S. 2017. Ispol'zovaniye zamenitelya kozhi pri lechenii donorskikh uchastkov [The use of skin substitute in the treatment of donor sites]. V: Abstr. 17-y Kongress Yevropeyskoy assotsiatsii ozhogov EBA (Barselona, Ispaniya, 6–9 sentyabrya 2017 g.): 71. #026.02.
Budkevich L.I., Mirzoyan G.V., Gabitov R.B., Brazol M.A., Salistyj P.V., Chikinev Y.V., Shmyrin A.A., Glutkin A.V. 2020. Bioplasticheskiy kollagenovyy material «Kollost» pri lechenii ozhogovoy travmy [Сollost bioplastic collagen material for the treatment of burns]. Sovremennye tekhnologii v meditsine, 12 (1): 92–97.
Krajnjukov P.E., Zinov'ev E.V., Osmanov K.F. 2018. Osobennosti klinicheskoy kartiny i rezul'taty lecheniya donorskikh ran posle autodermoplastiki u postradavshikh ot ozhogov [Features of the clinical picture and results of treatment of donor wounds after autodermoplasty in victims of burns]. Vestnik Nacional'nogo mediko-hirurgicheskogo Centra im. N.I. Pirogova, 13 (2): 113–117.
Kuznetsova T.A., Besednova N.N., Usov V.V., Andryukov B.G. 2020. Biosovmestimyye i biodegradiruyemyye ranevyye pokrytiya na osnove polisakharidov iz morskikh vodorosley (obzor literatury) [Biocompatible and biodegradable wound dressings on the basis of seaweed polysaccharides (review of literature)]. Vestnik khirurgii im. I.I. Grekova, 179 (4): 109–115. doi: 10.24884/0042-4625-2020-179-4-109-115
Polyakov A.V., Bogdanov S.B., Afanasov I.M., Karakulev A.V., Bogdanova Y.A., Zinoviev E.V., Osmanov K.F. 2019. Ispol'zovaniye ranevykh pokrytiy na osnove khitozana «Khitopran» v lechenii bol'nykh s ozhogovoy travmoy [Application of chitosan-based wound coatings ‘chitopran’ in the treatment of patients with burn trauma]. Innovatsionnaya meditsina Kubani, 3 (15): 25–31. doi: 10.35401/2500-0268-2019-15-3-25-31
Potekaev N.N., Frigo N.V., Petersen E.V. 2017. Iskusstvennaya kozha: vidy, oblasti primeneniya [Artificial skin: types and applications]. Klinicheskaya dermatologiya i venerologiya, 16 (6): 7–15. doi: 10.17116/klinderma20171667-15
Abdel-Sayed P., Michetti M., Scaletta C., Flahaut M., Hirt-Burri N., de Buys Roessingh A., Raffoul W., Applegate L.A. 2019. Cell therapies for skin regeneration: an overview of 40 years of experience in burn units. Swiss. Med. Wkly. 149: w20079. doi: 10.4414/smw.2019.20079
Asuku M., Yu T.C., Yan Q., Böing E., Hahn H., Hovland S., Donelan M.B. 2021. Split-thickness skin graft donor-site morbidity: A systematic literature review. Burns. 47 (7): 1525–1546. doi: 10.1016/j.burns.2021.02.014
Dai T., Tanaka M., Huang Y.Y., Hamblin M.R. 2011. Chitosan preparations for wounds and burns: Antimicrobial and wound-healing effects. Expert Rev. Anti-Infect. Ther. 9 (Is7): 857–879. doi: 10.1586/eri.11.59
Devi N., Dutta J. 2017. Preparation and Characterization of Chitosan-bentonite Nanocomposite Films for Wound Healing Application. Int. J. Biol. Macromol. 104 (Pt B): 1897–1904. doi: 10.1016/j.ijbiomac.2017.02.080
Halim A.S., Khoo T.L., Mohd Yussof S.J. 2010. Biologic and synthetic skin substitutes: An overview. Indian. J. Plast.Surg. 43 (Suppl): 23–28. doi: 10.4103/0970-0358.70712
Huskisson E.C. 1974. Measurement of pain. Lancet. 2 (7889): 1127–1131. doi: 10.1016/s0140-6736(74)90884-8
Luca-Pozner V., Nischwitz S.P., Conti E., Lipa G., Ghezal S., Luze H., Funk M., Remy H., Qassemyar Q. 2022. The use of a novel burn dressing out of bacterial nanocellulose compared to the French standard of care in paediatric 2nd degree burns – A retrospective analysis. Burns. 48 (6):
1472–1480. doi: 10.1016/j.burns.2021.11.019
Schiefer J.L., Aretz G.F., Fuchs P.C., Bagheri M., Funk M., Schulz A., Daniels M. 2022. Comparison of wound healing and patient comfort in partial-thickness burn wounds treated with SUPRATHEL and epicte hydro wound dressings. Int. Wound. J. 19 (4): 782–790. doi: 10.1111/iwj.13674
Yamakawa S., Hayashida K. 2019. Advances in surgical applications of growth factors for wound healing. Burns Trauma. 7: 10. doi: 10.1186/s41038-019-0148-1
You C., Li Q., Wang X., Wu P., Ho J.K., Jin R., Zhang L., Shao H., Han C. 2017. Silver Nanoparticle Loaded Collagen/chitosan Scaffolds Promote Wound Healing via Regulating Fibroblast Migration and Macrophage Activation. Sci. Rep. 7 (1):10489. doi: 10.1038/s41598-017-10481-0
Zulfiqar Ali Khan, Shahrin Jamil, Amna Akhtar, Muhammad Mustehsan Bashir, Muhammad Yar. 2020. Chitosan based hybrid materials used for wound healing applications – A short review. Int. J. Polymeric. Materials Polymeric. Biomaterialis. 69 (7): 1–18. doi: 10.1080/00914037.2019.1575828