Manifestation of Agranulocytosis in the Oral Cavity (Clinical Case)
Annotation
Acute agranulocytosis is a rare, potentially life-threatening condition that is associated with taking medications in more than 70 % of cases. Agranulocytosis is characterized by the number of peripheral neutrophils < 0.5 × 109/l. Currently, due to the widespread use of cytotoxic therapy in medical practice, as well as the emergence of a large number of new pharmacological agents, the frequency of cases of agranulocytosis has increased significantly. Although this pathology can be found quite rarely (1 case per 1 200 people), its manifestations in the oral cavity such as ulcerative-necrotic gingivitis and stomatitis, herpetic rashes, necrosis of the tonsils, tooth mobility are a serious problem for a dentist involved in the treatment of this disease. This article will consider a clinical case of acquired agranulocytosis of a young patient against the background of taking thyrostatics, with vivid manifestations of the disease in the oral cavity. Treatment and diagnosis were carried out conscientiously by hematologists, endocrinologists and dentists, based on examination, complaints, careful collection of anamnesis and the results of additional studies. Despite the fact that acquired agranulocytosis is a rather rare disease, the described algorithms of the work carried out, supported by a photoprotocol and the results of treatment, will be relevant for dentists of all specialties, for the formation of clinical thinking and observation.
Unfortunately, the article is available only in Russian
Введение
Агранулоцитоз (тяжелая форма нейтропении) является редким, угрожающим жизни состоянием. В его основе лежит снижение уровня лейкоцитов в крови до 1 × 109/л, а именно за счет фракции гранулоцитов. По происхождению агранулоцитоз делят на врожденный, обусловленный генетической предрасположенностью (встречается крайне редко) и приобретенный [Kılıç et al., 2020; Lopez et al., 2021; Zhu et al., 2021]. Выделяют миелотоксическую (в результате воздействия на организм ионизирующего излучения, цитотоксических препаратов, паров бензола и др.), аутоиммунную, гаптеновую (лекарственную) и идиопатическую формы приобретенного агранулоцитоза. Механизмы развития приобретенной нейтропении, в том числе и крайнего ее варианта – агранулоцитоза, включают нарушение продукции гранулоцитов или их разрушение. Это патологическое состояние встречается достаточно редко, 1 случай на 1 200 человек. Женщины страдают агранулоцитозом в 2 раза чаще мужчин [Lhomme et al., 2015; McCulloch et al., 2021; Schinz et al., 2021].
Лекарственно-индуцированная нейтропения возникает, когда лекарственно-зависимые антитела образуются против гликопротеинов мембраны нейтрофилов и вызывают разрушение нейтрофилов [Thompson et al., 2016; Chen et al., 2020]. У пострадавших пациентов наблюдаются лихорадка, озноб и инфекции; тяжелые инфекции, оставленные без лечения, могут привести к смерти [Mijovic et al., 2019; Stern et al., 2019; Garcia Del Campo et al., 2021].
Агранулоцитоз может быть вызван многими лекарственными препаратами. Препараты высокого риска включают антитиреоидные препараты, клозапин, тиклопидин, сульфасалазин, дипирон, триметоприм/сульфаметоксазол, карбамазепин [Vicente et al., 2017; di Fonzo et al., 2018; Ribé Buitrón et al., 2021]. Приблизительно в 5 % случаев лекарственный агранулоцитоз может привести к летальному исходу.
Лекарственно-индуцированные нейтропения и агранулоцитоз наблюдаются у пожилых пациентов чаще в сравнении с лицами молодого и среднего возраста, поскольку по мере увеличения возраста возрастает количество принимаемых ЛС и шире распространена полиморбидность.
Основные клинические проявления: на фоне ухудшения общего состояния больных (повышение температуры тела, головная боль, боль при глотании, запах изо рта) на слизистой оболочке рта развиваются язвенно-некротические процессы, имеющие тенденцию к быстрому распространению. Возникают легко кровоточащие зловонные язвы.
Возникающие стоматиты не только отягощают состояние больных, но и создают благоприятные условия для присоединения локальных и генерализованных инфекций вследствие проникновения микроорганизмов через поврежденную слизистую оболочку полости рта [Genchanok et al., 2019].
Клинический случай
Пациентка М., 25 лет, обратилась на кафедру терапевтической стоматологии ФГБОУ ВО СамГМУ с жалобами на изменение вкуса, постоянную острую боль в горле и в ротовой полости, изменение цвета и консистенции слизистой полости рта.
За 3 месяца до обращения к стоматологу на основании жалоб (дрожь в теле, одышка, учащенное сердцебиение, периодическая тошнота) и проведенных обследований (ультразвуковое исследование, лабораторная диагностика) врачом-эндокринологом был поставлен диагноз: диффузный токсический зоб, тиреотоксикоз 2 ст. Проводилась медикаментозная терапаия – тирозол 30 мг в сутки. При контрольном обследовании (биохимический анализ крови) через месяц после начала терапии показатели лейкоцитов
1,56 × 109/л, нейтрофилов 2 % (0,03 × 109/л), СОЭ 49 мм/ч (см. таб.). Пациентка отметила общее ухудшение состояния, предъявляла жалобы на постоянную тошноту, рвоту, одышку, раздражительность, учащенное сердцебиение, повышение температуры тела до 38 оС. Также отмечалась бледность кожных покровов, повышенное потоотделение, повышенная возбудимость. Пациентка была направлена к врачу-гематологу, где был поставлен диагноз острый приобретенный агранулоцитоз на фоне приема тиреостатиков. Медикаментозная терапия тиамазолом была срочно отменена. Врачом-гематологом был назначен антибиотик внутривенно.
Таблица
Table
Результаты биохимического анализа крови, на момент обращения к врачу-стоматологу
The results of a biochemical blood test, at the time of contacting a dentist
Исследование | Результат | Единицы измерения |
Гемоглобин | 11,7 | г/дл |
Эритроциты | 4,7 | млн/мкм |
MCV | 71,9 | фл |
RDW | 15,0 | % |
MCH | 24,9 | пг |
MCHC | 34,6 | г/дл |
Тромбоциты | 465 | тыс/мкл |
Лейкоциты | 1,56 | тыс/мкл |
Палочкоядерные нейтрофилы | 0 | % |
Нейтрофилы (общее число) | 2 | % |
Лимфоциты | 4 | % |
При осмотре стоматологом полости рта определялся некроз десневого края во фронтальном отделе верхней и нижней челюсти на вестибулярной поверхности, а также в области премоляров нижней челюсти с язычной поверхности (рис. 1). Осмотр и пальпация слизистой полости рта вызывала сильный болевой синдром у пациента. Слизистая десны была гиперемирована и отечна. Отмечалась неудовлетворительная гигиена полости рта (обильные мягкие наддесневые зубные отложения). За счет сильного болевого синдрома пациентка не могла проводить ежедневную домашнюю гигиену. Прием пищи был затруднен не только за счет сильных болевых ощущений, но и за счет сниженного слюноотделения. На момент обращения слюна была вязкой и пенящейся.
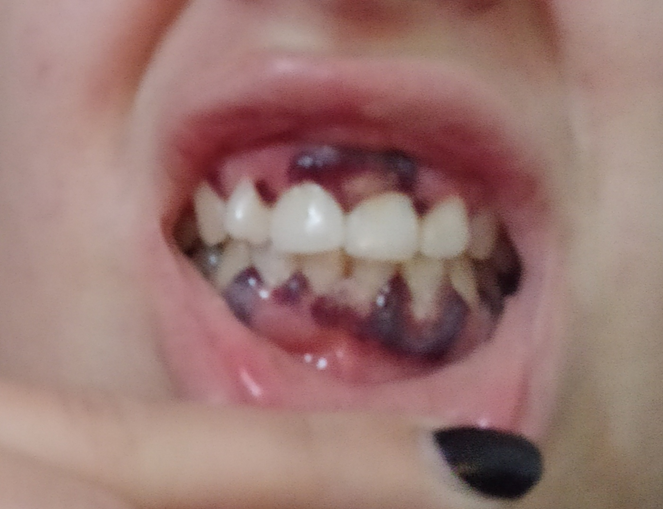
Рис. 1. Пациентка М., проявления агранулоцитоза в полости рта. Первичное обращение к врачу-стоматологу
Fig. 1. Patient M., manifestations of agranulocytosis in the oral cavity. Initial contact with a dentist
Обсуждение
Медикаментозный агранулоцитоз – тяжелое осложнение, связанное с большинством классов лекарств. Лекарства, такие как клозапин, триметоприм-сульфаметоксазол и метимазол, чаще вызывают агранулоцитоз, чем другие препараты.
Антитиреоидные препараты могут быть редкой причиной агранулоцитоза. Приостановление приема этих препаратов является обязательным для таких пациентов и может привести к ухудшению гипертиреоза [Fasullo et al., 2018; Wiciński et al., 2018].
Данное осложнение относится к иммунным гаптеновым агранулоцитозам и возникает вследствие гибели нейтрофилов в крови и костном мозге в результате выработки антигранулоцитарных антител к измененным гранулоцитам, приобретающим антигенные свойства под действием лекарственного препарата [Gonnert et al., 2018; Patel et al., 2019; Tunsirimas et al., 2019].
В рассмотренном нами клиническом случае мы наблюдали яркие проявления агранулоцитоза в полости рта. Примечательно, что данная патология характерна для пациентов пожилого возраста, но в нашем случае пациентка весьма молодого возраста. Ключевым моментом в лечении данной патологии являлась отмена тиреостатического препарата. Через 10 дней после прекращения тирозола при повторном биохимическом анализе крови лейкоциты – 18,2 × 109/л, нейтрофилы 30 %, лимфоциты 42 %, моноциты 14 %. Пациентка отметила улучшение общего состояния.
На первичном приеме стоматолога была проведена профессиональная гигиена под местной анестезией, медикаментозная обработка хлоргекседином 0,05 % и протеолитическими ферментами для удаления некротизированных тканей, местное применение антибиотиков и противовоспалительных препаратов. Был скорректирован домашний уход за полостью рта, подобраны средства индивидуальной гигиены. Рекомендована мягкая зубная щетка, паста с противовоспалительными веществами без отдушек, аппликации анальгезирующих гелей перед приемом пищи, кератопластики, а также щадящая диета. Подбор медикаментов был осложнен резким извращением вкуса пациента и сильным рвотным рефлексом на запахи.
На пятый день после отмены тиреостатического препарата десневой край покрылся плотным бело-желтым налетом (рис. 2). Поскольку мы смогли грамотно подобрать все средства индивидуального ухода, домашняя гигиена проводилась в полном объеме, пациентка была замотивирована на положительный результат лечения.

Рис. 2. Пациентка М., пять дней после начала симптоматической терапии
Fig. 2. Patient M., five days after the start of symptomatic therapy
Через пятнадцать дней после начала симптоматической терапии в полости рта и отмены тиреостатического препарата пациентка практически не предъявляла жалоб на боль в ротовой полости, только незначительный дискомфорт при приеме жесткой пищи (рис. 3). Умеренная гиперемия слизистой полости рта во фронтальном отделе сохранялась, очаги некроза исчезли полностью. Был повторно скорректирован домашний уход. В силу молодого возраста пациента и соблюдения всех данных врачами рекомендаций уже через две недели мы наблюдали активную регенерацию тканей слизистой полости рта. Для получения удовлетворительного эстетического результата пациентке было рекомендовано наблюдение у врача-пародонтолога с периодичностью 1 раз в месяц.
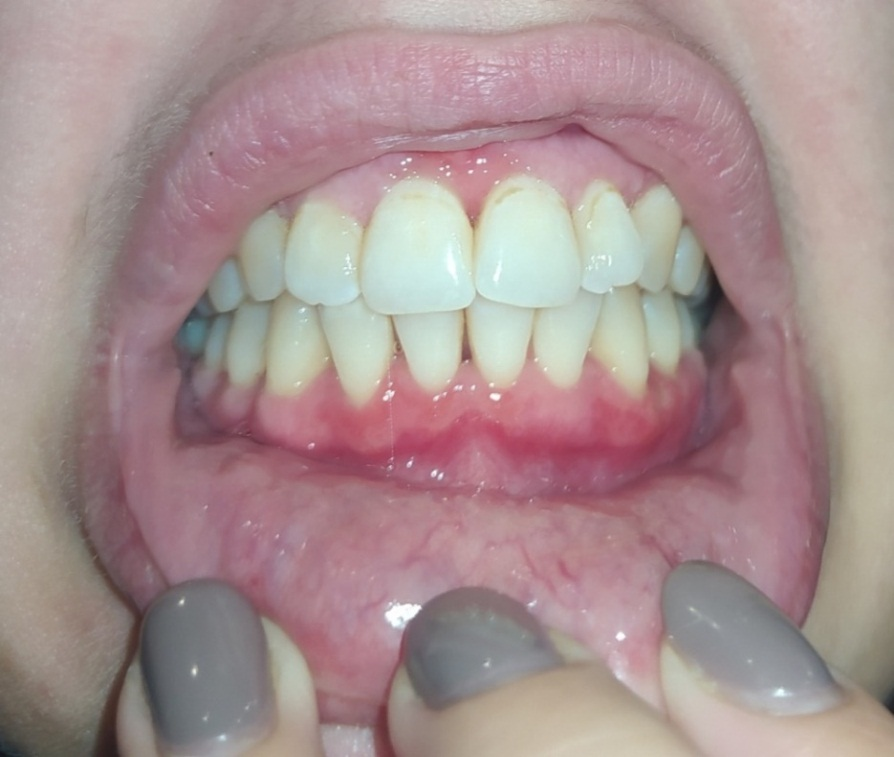
Рис. 3. Пациентка М., пятнадцать дней после начала симптоматической терапии
Fig. 3. Patient M., fifteen days after the start of symptomatic therapy
Заключение
Медикаментозный агранулоцитоз обычно является самокупирующимся состоянием (при условии отмены токсических препаратов) с полным исчезновением в течение двух недель. После отмены лекарств в большинстве случаев нейтропения со временем проходит и необходима только симптоматическая терапия, такая как антибиотики для лечения и профилактики инфекций и соблюдение правил гигиены. Среднее время полного восстановления числа нейтрофилов составляет 9 дней (диапазон 9–24 дня).
Несмотря на то, что состояние пациента нормализуется после отмены препарата, вызвавшего агранулоцитоз, жалобы на боль в ротовой полости сохраняются до трех недель, что значительно осложняет жизнь пациента. При несвоевременном обращении пациентов к врачу-стоматологу с диагнозом острый агранулоцитоз мы сможем наблюдать такие последствия, как некроз десневых сосочков и их полное исчезновение, с зияющими межзубными промежутками. Не стоит также забывать, что при отсутствии симптоматической терапии и должного соблюдения гигиены ротовой полости мы можем ожидать присоединения локальной инфекции за счет снижения местного и общего иммунитета.





Reference lists
Chen W.T., Chi C.C. 2019. Associations of HLA genotypes with antithyroid drug-induced agranulocytosis: A systematic review and meta-analysis of pharmacogenomics studies. Br. J. Clin. Pharmacol. Sep; 85 (9): 1878–1887. doi: 10.1111/bcp.13989.
Di Fonzo H., Villegas Gutsch M., Castroagudin A., Cabrera M.V., Mazzei M.E., Rueda D. 2018. Agranulocytosis Induced by Vancomycin. Case Report and Literature Review. Am. J. Case. Rep. Sep 3; 19: 1053–1056. doi: 10.12659/AJCR.909956.
Fasullo S., Davì S., Cosenza G., Di Franco F., La Manna N., Giubilato A., Vetrano G., Maringhini G. 2018. Acute agranulocytosis after oral administration of dabigatran: a rare case report and a short review of literature. J. Thromb. Thrombolysis. May; 45 (4): 588–592. doi: 10.1007/s11239-018-1624-3.
Garcia Del Campo C., Murcia Soler M., Martinez-Mir I., Palop Larrea V. 2021. Adecuación de la seguridad del metamizol y agranulocitosis [Adequacy of the safety of metamizole and agranulocytosis]. Aten Primaria. Jun-Jul; 53 (6): 102047. Spanish. doi: 10.1016/j.aprim.2021.102047.
Genchanok Y., Tolu S.S., Wang H., Arora S. 2019. Agranulocytosis from Outpatient Antimicrobial Treatment with Ceftriaxone: A Case Report. Perm. J. 2019; 23: 18–190. doi: 10.7812/TPP/18-190.
Gonnert F.A., Meißner W. 2018. Kasuistik: Metamizol-induzierte Agranulozytose [Case Report – Metamizole-Induced Agranulocytosis]. Anasthesiol Intensivmed Notfallmed Schmerzther. May; 53 (5): 388–394 (in German). doi: 10.1055/s-0043-115329.
Kılıç Ö., İşeri Nepesov M., Ulukapı H.B., Özdemir Z.C., Bör Ö., Dinleyici E.Ç. 2021. Paediatric Agranulocytosis Associated with Metamizole Treatment. Paediatr Drugs. Jan; 23 (1): 105–110. doi: 10.1007/s40272-020-00431-1.
Lhomme F., Ochmann M., Lamy T. 2015. Agranulocytose médicamenteuse [Drug-induced agranulocytosis]. Rev Prat. May; 65 (5): 697–700 (in French).
Lopes V., Ramos J., Dias P., Santos A. 2021. Nitrofurantoin-induced agranulocytosis. B.M.J. Case. Rep. Nov 11; 14 (11): e246788. doi: 10.1136/bcr-2021-246788.
McCulloch J.E., Miller A., Borcea M., Reid J. 2021. Austrian syndrome, ceftriaxone-induced agranulocytosis and COVID-19. B.M.J. Case. Rep. Jan 6; 14 (1): e239355. doi: 10.1136/bcr-2020-239355.
Mijovic A., MacCabe J.H. 2020. Clozapine-induced agranulocytosis. Ann. Hematol. Nov; 99 (11): 2477–2482. doi: 10.1007/s00277-020-04215-y.
Patel R., Lima A., Burke C., Hoffman M. 2019. Monocytopenia in clozapine-induced agranulocytosis: insights into pathophysiology and treatment. B.M.J. Case. Rep. Jan 18; 12 (1): bcr-2018-226016. doi: 10.1136/bcr-2018-226016.
Ribé Buitrón J.M., González Rodríguez M., Barceló Colomer M.E. 2021. Clozapina y agranulocitosis: repensando la utilidad de su monitorización [Clozapine and agranulocytosis: Rethinking the usefulness of its monitoring]. Aten Primaria. Oct; 53 (8): 102114 (in Spanish). doi: 10.1016/j.aprim.2021.102114.
Schinz K., Waldfahrer F., Wüst W., Iro H. 2020. Agranulozytose nach Metamizol-Einnahme – ein unterschätztes Risiko? [Agranulocytosis after use of metamizole – an underestimated risk?]. Laryngorhinootologie. Oct; 99 (10): 707–712. (in German). doi: 10.1055/a-1190-4445.
Stern A., Carrara E., Bitterman R., Yahav D., Leibovici L., Paul M. 2019. Early discontinuation of antibiotics for febrile neutropenia versus continuation until neutropenia resolution in people with cancer. Cochrane Database Syst. Rev. Jan 3; 1 (1): CD012184. doi: 10.1002/14651858.
Thompson R.A., Isin E.M., Ogese M.O., Mettetal J.T., Williams D.P. 2016. Reactive metabolites: current and emerging risk and hazard assessments. Chem. Res. Toxicol. 29 (4): 505–533.
Tunsirimas N., Pariwatcharakul P., Choovanichvong S., Ratta-Apha W. 2019. Clozapine-induced agranulocytosis and leukopenia: Incidence, associated factors, and rate of hematologic adverse-effects monitoring in psychiatric out-patient services in Thailand. Asian J. Psychiatr. Mar; 41: 13–16. doi: 10.1016/j.ajp.2019.03.002.
Vicente N., Cardoso L., Barros L., Carrilho F. 2017. Antithyroid Drug-Induced Agranulocytosis: State of the Art on Diagnosis and Management. Drugs R. D. Mar; 17 (1): 91–96. doi: 10.1007/s40268-017-0172-1.
Wiciński M., Węclewicz M.M. 2018. Clozapine-induced agranulocytosis/granulocytopenia: mechanisms and monitoring. Curr. Opin. Hematol. Jan; 25 (1): 22–28. doi: 10.1097/MOH.0000000000000391
Zhu D., Zhang S., Cao X., Xia Q., Zhang Q., Deng D., Gao S., Yu H., Liu Y., Zhou H., Tao F., Sun X. 2021. Thionamide-induced Agranulocytosis: A Retrospective Analysis of 36 Patients With Hyperthyroidism. Endocr. Pract. Dec; 27 (12): 1183–1188. doi: 10.1016/j.eprac.2021.06.017