Influence of interleukin-21 on the state of intracellular signaling mechanisms in leukocytes in patients with pneumonia
Annotation
The results of a study of possible mechanisms of the influence of interleukin-21 on the functional state of blood cells and their production of cytokines in people who have had pneumonia are presented. Purpose: to study the effect of interleukin-21 on the state of signaling mechanisms, in particular, mitogen-activated / stress-activated signaling pathways, the level of heat shock proteins and histones in peripheral blood mononuclear leukocytes in community-acquired pneumonia convalescents, as well as the production of interleukins and growth factors. 40 male patients from 18 to 43 years old with community-acquired pneumonia on the 13–15th day of the disease were examined. Results. In persons who have had pneumonia, the level of interleukin-21 is associated with the state of mitogen-activated / stress-activated signaling pathways, as well as the signaling pathway associated with Janus kinases and signal transducers and transcription activators, determining the cytokine profile and features of the postclinical phase of the disease in such patients.
Keywords: interleukin-21, pneumonia, cytokines, growth factors, immunorehabilitation, intracellular signaling pathways, transcription factors, inflammation
Unfortunately, the article is available only in Russian
Введение
В процессах восстановления иммунологического гомеостаза после перенесенной острой инфекции большое значение имеет достижение нормализации функциональной активности клеток врожденного и адаптивного иммунного ответа. Учитывая важную роль цитокинов в регуляции как адаптивных, так и врожденных механизмов иммунитета, нарушение их продукции может сопровождаться разнообразными патологическими проявлениями, в частности иммунодефицитом, хронизацией воспалительного процесса, развитием синдрома системной воспалительной реакции и т. п. проявлениям, приводящим к затяжному и хроническому течению заболеваний, возникновению повторных инфекций и суперинфекций, а также септических состояний [Логаткина и др., 2017; Симбирцев, 2018; Бязрова и др., 2020].
В системе цитокинов особое место отводится интерлейкину-21 (ИЛ-21), обладающему способностью модулировать как гуморальный иммунный ответ за счет стимуляции дифференцировки В-лимфоцитов и фолликулярных Т-хелперов, так и клеточный ответ, за счет регуляции активности NK и CD8+ лимфоцитов [Симбирцев, 2018; Long et al., 2019]. Большинство биологических эффектов ИЛ-21 реализуется посредством активации в соответствующих клетках JAK/STAT-сигнального пути, в частности фосфорилирования протеинкиназ JAK1, JAK3 и сигнальных трансдукторов и активаторов транскрипции STAT1, STAT3 [Spolski et al., 2019; Liu et al., 2020].
Вместе с тем в настоящее время биологическое действие ИЛ-21 исследовано недостаточно полно, в частности не в полной мере изучены молекулярные механизмы формирования биологических эффектов цитокина с участием митоген-активируемого / стресс-активируемого (MAPK/SAPK) сигнального пути, а также его влияние на состояние неспецифической резистентности и продукцию других цитокинов, в частности ИЛ-4, ИЛ-13, ИЛ-15, ИЛ-18 и факторов роста.
Целью данного исследования явилось изучение влияния ИЛ-21 на состояние внутриклеточных сигнальных механизмов, белков теплового шока и гистонов в мононуклеарных лейкоцитах периферической крови у реконвалесцентов внебольничной бактериальной пневмонии, а также продукции ими интерлейкинов, их растворимых рецепторов.
Материалы и методы
Изучены результаты обследования 40 пациентов обоего пола от 18 до 43 лет (средний возраст – 33±5,5 лет), поступивших в клинику с внебольничной пневмонией. В соответствии с целью исследования, в ядерно-цитоплазматических лизатах МНК, выделенных из венозной крови, методом иммуноферментного анализа (ИФА) на 13–15 сутки заболевания оценивали концентрацию (нг/мл) белка теплового шока-60 (БТШ60), белка теплового шока-70 (БТШ70), субъединиц р50 и р65 фактора транскрипции NF-κB. Кроме того, исследовали уровень фосфорилирования (в условных единицах на нг протеина – ед/нг) по тирозину в положении 1007⁄1008 рецепторной протеинкиназы JAK2, по тирозину в положении 694 – фактора STAT5А, по тирозину в положении 641 – фактора STAT6, по тирозину в положении 705 – фактора STAT3, по серину в положении 32 – фактора IκBα, по серину в положении 10 – гистона Н3, по серину в положении 32 – БТШ27, по серину в положении 133 – фактора транскрипции CREB [Зилов и др., 2019; Терехов и др., 2019].
В клеточных супернатантах определяли концентрацию ИЛ-2, -4, -12, -13, -15, -17, -18, -19, -21, -23, хемокинов MCP-1 и MIP3α, факторов роста bFGF, VEGF-A, VEGF-C, концентрацию растворимой формы рецепторов к ИЛ-2 (RIL2), ИЛ-4 (RIL4), растворимой формы рецептора 1 типа к VEGF (VEGF-RI), матриксной металлопротеиназы-1 (ММП1). Также определяли уровень растворимой формы рецептора DcR3, лиганда рецептора лимфотоксина β (LIGHT), ФНО-подобного слабого индуктора апоптоза (TWEAK), ФНО-зависимого лиганда, индуцирующего апоптоз (TRAIL).
Статистический анализ проводили с использованием программы Statistica 13.0 (StatSoft, США). Исследуемые показатели представляли в виде среднего значения, медианы (Ме), 25 и 75 процентилей выборки. Значимость межгрупповых различий оценивали с помощью U-критерия Манна – Уитни. Взаимосвязи изучаемых факторов оценивали методом иерархического кластерного анализа с использованием правила Варда с целью объединения исследованных факторов в кластеры в метрике 1 – коэффициент корреляции Пирсона.
Результаты
Анализ содержания в сыворотке ИЛ-21 показал, что у реконвалесцентов ВП его средний уровень составил 2,0 нг/мл. Значение 1 и 4 квартиля, а также медианы выборки составили 1,08, 3,1 и 1,87 нг/мл, соответственно. С учетом полученных данных были сформированы две подгруппы с условно низким (подгруппа 1) и высоким (подгруппа 2) уровнем ИЛ-21. В первую группу были включены образцы с концентрацией ИЛ-21 ниже медианных значений (1,87 нг/мл и менее), во вторую – образцы с уровнем ИЛ-21, равным либо превышавшим медианную концентрацию (1,87 нг/мл и более). Результаты исследования представлены в таблице 1.
Таким образом, повышение продукции ИЛ-21 ассоциируется с увеличением продукции bFGF на 143,4 % (р = 0,0001), ИЛ-15 на 130,0 % (р = 0,0001), ИЛ-19 на 125,1 % (р = 0,0001), ИЛ-4 на 74,2 % (р = 0,013), ИЛ-13 на 65,8 % (р = 0,017), ИЛ-18 на 64,9 % (р = 0,017), ИЛ-23 на 58,5 % (р = 0,019), ИЛ-12 на 55,5 % (р = 0,023), ИЛ-2 на 27,8 % (р = 0,046), ИЛ-17 на 15,4 % (р = 0,053), МСР1 на 15,3 % (р = 0,1). Кроме того, в подгруппе с высоким уровнем ИЛ-21 отмечалось повышение уровня RIL4 на 62,4 (р = 0,018), RIL2 на 39,4 % (р = 0,032), а также VEGF-RI на 7,9 % (р = 0,18). На этом фоне отмечалось снижение продукции MIP3α на 9,6 % (р = 0,12), VEGF-A на 10,4 % (р = 0,06), VEGF-C на 22,2 % (р = 0,043).
Таблица 1
Table 1
Уровень исследованных показателей в подгруппах
The level of the investigated cytokines
Цитокин, нг/мл | Подгруппа 1 | Подгруппа 2 | ||
х | Ме (25; 75 %) | х | Ме (25; 75 %) | |
ИЛ-2 | 1,2 | 1,0 (0,9; 1,3) | 1,54 | 1,5 (1,4; 1,6) |
RIL2 | 1,24 | 1,1 (0,8; 1,8) | 1,73 | 1,7 (1,6; 2,2) |
ИЛ-4 | 1,39 | 1,5 (0,8; 1,7) | 2,43 | 2,3 (1,9; 3,2) |
RIL4 | 1,0 | 0,8 (0,7; 1,0) | 1,63 | 1,4 (0,8; 2,1) |
ИЛ-12 | 1,34 | 0,8 (0,7; 1,5) | 2,08 | 2,5 (1,3; 2,8) |
ИЛ-13 | 1,45 | 1,0 (0,9; 2,8) | 2,41 | 2,5 (1,9; 2,8) |
ИЛ-15 | 0,98 | 0,9 (0,8; 0,9) | 2,26 | 1,8 (1,4; 3,4) |
ИЛ-17А | 1,74 | 1,5 (1,4; 1,9) | 2,01 | 1,5 (1,1; 3,1) |
ИЛ-18 | 1,11 | 0,8 (0,7; 1,0) | 1,83 | 2,1 (1,4; 2,4) |
ИЛ-19 | 1,02 | 0,9 (0,8; 1,0) | 2,29 | 2,2 (1,9; 2,5) |
ИЛ-23 | 1,08 | 0,9 (0,8; 1,1) | 1,71 | 1,6 (0,9; 2,1) |
MCP1 | 2,37 | 2,2 (2,2; 2,7) | 2,73 | 2,8 (2,5; 3,0) |
MIP3α | 2,76 | 2,7 (2,6; 2,8) | 2,49 | 2,3 (2,2; 2,8) |
bFGF | 0,92 | 0,9 (0,8; 2,8) | 2,24 | 2,3 (2,1; 2,8) |
VEGF-A | 1,17 | 1,1 (1,0; 1,5) | 1,05 | 1,2 (0,7; 1,4) |
VEGF-C | 1,0 | 1,0 (0,9; 1,2) | 0,77 | 0,7 (0,5; 1,1) |
VEGF-RI | 1,2 | 1,0 (0,9; 1,0) | 1,3 | 1,2 (1,1; 1,4) |
ИЛ-21 | 0,91 | 0,8 (0,7; 1,0) | 2,89 | 2,8 (2,7; 3,1) |
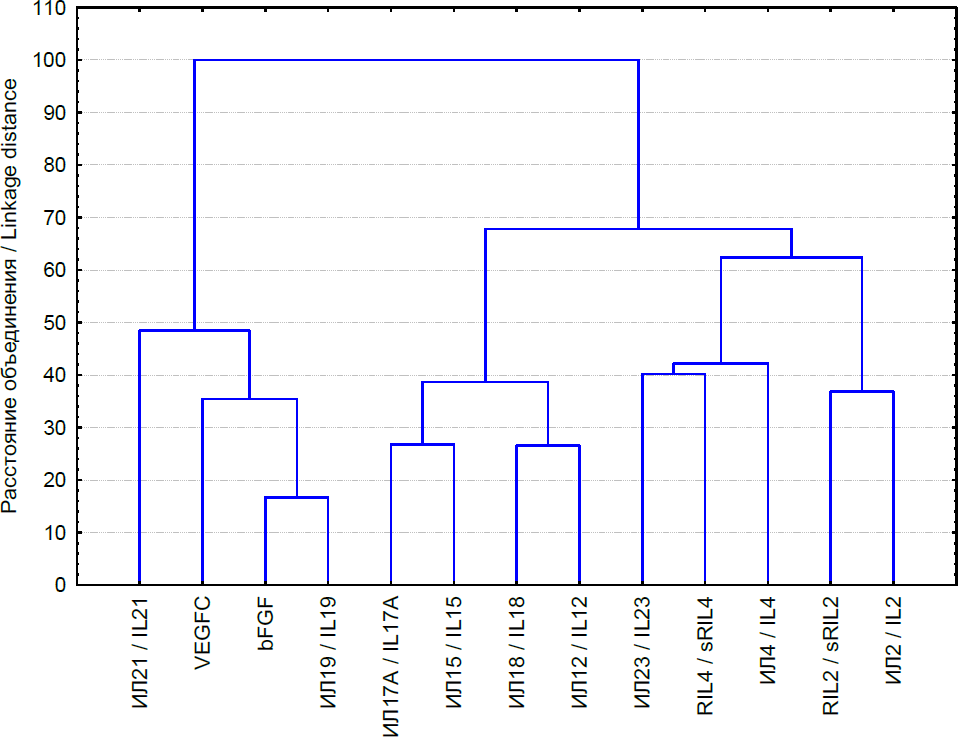
Рис. 1. Результаты кластерного анализа взаимосвязи исследованных цитокинов
Fig. 1. Results of cluster analysis of the relationship of the studied cytokines
Проведенный анализ потенциальных взаимосвязей между исследованными молекулами позволил выделить 2 кластера. В первый кластер могут быть включены ИЛ-21, ИЛ-19, bFGF и VEGF-C. При этом в данном кластере, в соответствии с величиной дистанции между исследуемыми факторами, наиболее тесные связи имеют место между ИЛ-19 и bFGF, что может определяться важной ролью ИЛ-19 в стимуляции экспрессии гена bFGF. При этом взаимосвязи между факторами роста (VEGF и bFGF) и ИЛ-19, очевидно, определяются его способностью контролировать экспрессию генов, отвечающих за ангиогенез [Симбирцев, 2018; Liu et al., 2019; Fujimoto et al., 2021]. Второй кластер, в который входят оставшиеся медиаторы, регулирующие активность Т-хелперов и В-лимфоцитов, может быть разделен на два подмножества. В первое подмножество второго кластера входят ИЛ-17А, ИЛ-15, ИЛ-18, ИЛ-12, т. е. цитокины, регулирующие в первую очередь клеточно-опосредованный иммунный ответ, во второе – ИЛ-23, ИЛ-2, ИЛ-4, RIL2, RIL4 – регулирующие преимущественно дифференцировку Т-хелперов и формирование гуморального иммунного ответа. Таким образом, результаты кластерного анализа позволяют говорить о взаимосвязи продукции ИЛ-21 с продукцией факторов, определяющих репарацию и регенерацию тканей (исследуемые факторы роста, ИЛ-19), а также регуляторов адаптивного иммунного ответа.
Уровень исследованных регуляторов межклеточных взаимодействий и сигнальных путей представлен в таблице 2.
Таблица 2
Table 2
Уровень исследованных факторов в зависимости от продукции ИЛ-21
The level of the investigated factors
Фактор | Подгруппа 1 | Подгруппа 2 | ||
х | Ме (25; 75 %) | х | Ме (25; 75 %) | |
H3, ед/нг | 2,79 | 2,5 (2,4; 2,7) | 1,64 | 1,5 (1,1; 2,1) |
БТШ27, ед/нг | 0,13 | 0,1 (0,05; 0,1) | 0,15 | 0,1 (0,1; 0,2) |
БТШ60, нг/мл | 271,9 | 247,4 (223,3; 284,5) | 321,0 | 328,7 (247,9; 374,9) |
БТШ70, нг/мл | 145,4 | 145,5 (145,4; 149,0) | 126,9 | 126,8 (119,1; 132,3) |
TRAIL, нг/мл | 0,84 | 0,8 (0,8; 1,1) | 0,91 | 0,9 (0,7; 1,1) |
TWEAK, нг/мл | 13,0 | 13,5 (10,3; 13,6) | 16,5 | 17,4 (14,9; 17,5) |
LIGHT, нг/мл | 15,4 | 14,8 (14,7; 17,3) | 15,9 | 17,8 (12,0; 20,1) |
DcR3, нг/мл | 0,93 | 0,9 (0,9; 1,0) | 1,07 | 1,0 (1,0; 1,2) |
JAK2, ед/нг | 0,71 | 0,7 (0,6; 0,9) | 0,53 | 0,4 (0,4; 0,7) |
STAT3, ед/нг | 1,01 | 1,1 (0,8; 1,2) | 0,6 | 0,5 (0,2; 1,0) |
STAT5A, ед/нг | 0,76 | 0,8 (0,7; 0,8) | 0,68 | 0,7 (0,5; 0,7) |
STAT6, ед/нг | 2,01 | 2,3 (1,7; 2,3) | 1,27 | 1,1 (1,1; 1,7) |
p50, нг/мл | 1,32 | 1,4 (1,2; 1,4) | 1,65 | 1,9 (1,1; 2,0) |
p65, нг/мл | 1,24 | 1,1 (1,1; 1,9) | 1,44 | 1,3 (1,2; 1,9) |
IkBα, ед/нг | 0,41 | 0,4 (0,3; 0,5) | 0,44 | 0,5 (0,3; 0,6) |
CREB, ед/нг | 1,01 | 1,1 (0,9; 1,1) | 1,29 | 1,14 (1,1; 1,8) |
ММП1, нг/мл | 0,99 | 1,0 (0,8; 1,3) | 0,73 | 0,6 (0,6; 0,9) |
Проведенный анализ свидетельствует о том, что повышение продукции ИЛ-21 ассоциировано с повышением содержания в МНК фактора р50 на 25,0 % р = 0,039), р65 на 15,6 % (р = 0,05), концентрации БТШ60 на 18,1 % (р = 0,05). Также было выявлено повышение уровня фосфорилирования БТШ27 на 15,2 % (р = 0,051), CREB на 27,6 % (р = 0,041), IkBα на 6,2 % (р = 0,06). На фоне повышения концентрации ИЛ-21 отмечалось повышение уровня TWEAK на 27,4 % (р = 0,041), DcR3 на 15,1 % (р = 0,045), TRAIL на 7,3 % (р = 0,06), LIGHT на 3,2 % (р = 0,1). В свою очередь, повышение уровня ИЛ-21 ассоциировалось с дефосфорилированием гистона Н3 на 41,1 % (р = 0,032), STAT3 на 40,8 % (р = 0,033), STAT6 на 36,6 % (р = 0,032), STAT5A на 10,8 % (р = 0,1), JAK2 на 25,3 % (р = 0,037). В МНК наблюдалось снижение уровня БТШ70 на 12,7 % (р = 0,055), продукции ММП1 на 26,3 % (р = 0,042).
На рисунке 2 представлены результаты кластерного анализа взаимосвязи продукции ИЛ-21 и исследованных регуляторов внутриклеточных процессов.
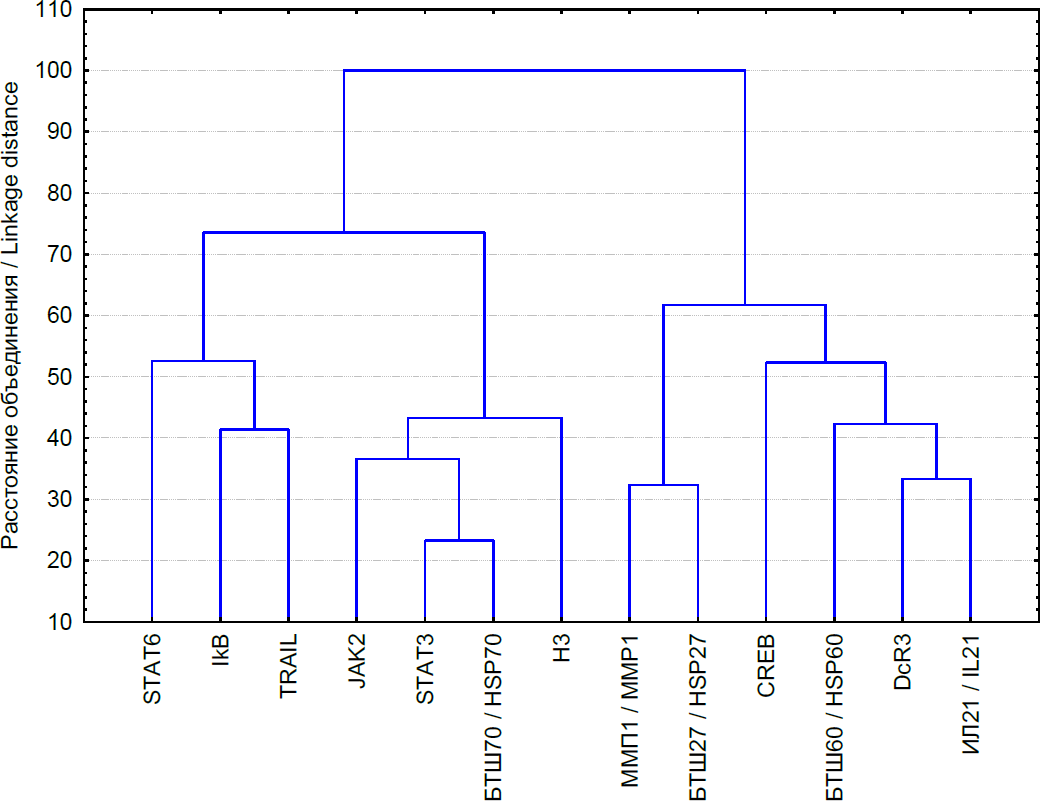
Рис. 2. Результаты кластерного анализа исследованных факторов
Fig. 2. Results of cluster analysis of the investigated factors
Проведенный анализ позволил выделить два крупных кластера, включающих в себя наиболее тесно связанные факторы. В первый кластер, образованный с участием ИЛ-21, включены DcR3, CREB, БТШ60 и БТШ27 и ММП1. Таким образом, у реконвалесцентов ВП в физиологических условиях биологические эффекты ИЛ-21 могут формироваться за счет активации MAPK/SAPK-сигнального пути, в частности фактора транскрипции CREB. При этом контроль со стороны ИЛ-21 экспрессии DcR3, которая зависит от состояния MAPK/SAPK-сигнального пути, определяет влияние цитокина на пролиферацию и апоптоз МНК. Повышение уровня БТШ60 и БТШ27, также находящихся в связи с продукцией ИЛ-21, в целом определяет цитопротективные эффекты ИЛ-21 у реконвалесцентов ВП.
Второй кластер может быть разделен на два подмножества. В первое входит JAK2, STAT3, БТШ70 и гистон H3, во второе – STAT6, IkBα и TRAIL. Первое подмножество изучаемых факторов второго кластера, имеющее связь с первым кластером, включает комплекс молекул, проявляющих преимущественно антипролиферативные эффекты в отношении клеток-мишеней ИЛ-21. Второе подмножество данного кластера объединяет регуляторы воспаления и апоптоза, также находящиеся под контролем ИЛ-21 [Симбирцев, 2018; Hsieh et al., 2017; Ghobadi et al., 2020; Wang et al., 2020; Pan et al., 2021].
Таким образом, в диапазоне физиологических концентраций ИЛ-21 может оказывать значимое стимулирующее влияние на продукцию ИЛ-15, ИЛ-19 и bFGF, в минимальной степени влияя на уровень ИЛ-2, ИЛ-17A и МСР-1, угнетая при этом продукцию MIP3α. При этом отрицательное влияние цитокина на фосфорилирование отдельных компонентов JAK/STAT-сигнального пути определяет снижение чувствительности клеток к соответствующим цитокинам, способствуя тем самым ограничению провоспалительной реактивности иммунокомпетентных клеток у реконвалесцентов пневмонии.
Обсуждение
Выявленное в исследовании уменьшение фосфорилирования факторов JAK2 и STAT3 на фоне повышения продукции ИЛ-21 может определяться его стимулирующим влиянием на экспрессию генов супрессоров цитокиновой сигнализации (SOCS-белков) и фосфатаз двойной специфичности, таких как РР2СА и РТР1В [Strengell et al., 2006]. На этом фоне снижение уровня фосфорилирования гистона Н3, содержания в МНК БТШ70, продукции ММП1 и VEGF также может являться следствием негативной регуляции JAK/STAT-сигнального пути, в частности дефосфорилирования фактора STAT3 за счет активации петли отрицательной обратной связи [Xu et al., 2018; Yoshida et al., 2019]. При этом снижение активности сигнального пути JAK2/STAT3, установленное в настоящем исследовании, ассоциирующееся с уменьшением продукции MIP3α и ММП1, в сочетании с повышением уровня ИЛ-19, FGFβ и БТШ60 может лежать в основе модулирующего влияния ИЛ-21 в отношении иммунной защиты слизистых оболочек и эпителиальных барьеров [Симбирцев, 2018; Vallières et al., 2019].
Ассоциация повышенного уровня ИЛ-21 и DcR3, являющегося важным отрицательным регулятором воспаления, способствующим ограничению процессов апоптоза, а также хемотаксиса лимфоцитов, позволяет говорить о том, что отдельные функции ИЛ-21, в частности ослабление аутоиммунных реакций и противовоспалительное действие, опосредуются повышенной экспрессией молекул-членов семейства фактора некроза опухоли [Hsieh et al., 2017; Ghobadi et al., 2020; Pan et al., 2021]. Также можно отметить, что стимуляция фосфорилирования БТШ27, наблюдающаяся при повышенной продукции ИЛ-21, определяет протективные противовоспалительные эффекты ИЛ-21 в отношении кислород-зависимого повреждения клеток, что, в свою очередь, связано с его способностью угнетать экспрессию таких молекул, как ICAM-1 и VCAM-1, матриксных металлопротеиназ, а также ограничивать активность каспазы-3 и тормозить процессы апоптоза [Lee et al., 2008]. Стимулируя фосфорилирование БТШ27, ИЛ-21 может оказывать протективное действие при развитии ишемического повреждения тканей, предупреждая нарушение проницаемости гистогематических барьеров [Shimada et al., 2018]. Вместе с тем усиление фосфорилирования БТШ27, ассоциированное с повышением уровня ИЛ-21, может также играть вспомогательную роль в регуляции биологической активности цитокина за счет модуляции сигнального пути JAK/STAT [Kim et al., 2018; Yoshida et al., 2019].
Таким образом, оказывая влияние на продукцию цитокинов, регулирующих функциональную активность T-хелперов 1, 2 и 17 типов, В-лимфоцитов, а также NK-клеток и цитотоксических лимфоцитов, ИЛ-21 способствует поддержанию сопряженности адаптивных и врожденных механизмов иммунного ответа, включая процессы гуморального и клеточно-опосредованного иммунного ответа. Указанное обстоятельство определяет биологическую значимость ИЛ-21 в фазу реконвалесценции ВП, включая поддержание противоинфекционной резистентности, в том числе посредством активации факторов транскрипции CREB и STAT3/6, а также за счет эпигенетических механизмов, связанных с модификацией структуры гистонов [Voevodin et al., 2017; Spolski et al., 2019; Vallières et al., 2019]. Учитывая взаимосвязи между ИЛ-21 и фактором транскрипции CREB, ИЛ-21 можно рассматривать в качестве терапевтической мишени при различных иммунопатологических процессах, сопровождающихся нарушением взаимодействия между Т- и В-лимфоцитами, а также клетками адаптивного и врожденного иммунного ответа, в регуляции которых важную роль играет фактор CREB. При этом коррекция продукции ИЛ-21 может быть достигнута как медикаментозными, так и не медикаментозными стимулами. В последнем случае одним из стимуляторов продукции ИЛ-21 может являться низкоинтенсивное излучение частотой 1 ГГц, способствующее повышению продукции ИЛ-21, активации факторов транскрипции NF-κB и CREB, снижению фосфорилирования STAT3 и STAT6, приводя к усилению фагоцитоза, повышению продукции эндогенных антимикробных пептидов и противоинфекционной защиты, стимуляции пролиферации фибробластов, ускорению заживления ран [Терехов и др., 2017; Терехов и др., 2019, Thöni et al., 2021].





Reference lists
Byazrova M.G., Astahova E.A., Spiridonova A.B., Vasil'eva Yu.V. 2020. Stimulyaciya B-limfocitov cheloveka in vitro s pomoshch'yu IL-21/CD40L i ih harakteristika [IL-21/CD40L stimulation of human B-lymphocytes in vitro and their characteristics]. Immunologiya. 41 (6): 501–510.
Zilov V.G., Khadartsev A.A., Terekhov I.V., Bondar S.S. 2017. Vzaimosvyaz' soderzhaniya v mononuklearnyh lejkocitah cel'noj krovi v postklinicheskuyu fazu vnebol'nichnoj pnevmonii ciklinov, ciklin-zavisimyh kinaz i ih ingibitorov pod vliyaniem mikrovoln chastotoj 1 GGc [Relationship between the contents of cyclins, cyclin-dependent kinases, and their inhibitors in whole blood mononuclear leukocytes during the postclinical stage of community-acquired pneumonia under the influence of 1-GHz microwaves]. Byulleten' eksperimental'noy biologii i meditsiny. 163 (5): 623–626.
Logatkina A.V., Nikiforov V.S., Bondar' S.S. 2017. Vospalitel'nye citokiny i signal'nye sistemy mononuklearnyh kletok perifericheskoj krovi pri ishemicheskoj bolezni serdca [Proinflammatory cytokines and signaling pathways in peripheral blood mononuclear cells in patients with coronary artery disease. Klinicheskaya meditsina. 95 (3): 238–244.
Simbirtsev A.S. 2018 Citokiny v patogeneze i lechenii zabolevanij cheloveka [Cytokines in the pathogenesis and treatment of human diseases]. SPb, OOO «Foliant Publishing House», 512 s.
Terekhov I.V., Nikiforov V.S., Bondar S.S. 2017. Izmenenie soderzhaniya komponentov IL/TOLLsignal'nogo puti i NF-kB v mononuklearnyh kletok cel'noj krovi pod vliyaniem nizkointensivnogo elektromagnitnogo izlucheniya chastotoj 1 GGc [Changes in the content of IL / TOLL signaling pathway and NF-kB components in mononuclear cells of whole blood under the influence of lowintensity electromagnetic radiation with a frequency of 1 GHz]. Genes and cells. 12 (2): 90–96.
Terekhov I.V., Nikiforov V.S., Bondar' S.S. 2019. Sostoyanie RIG-I- i NF-KB-signal'nyh putej v mononuklearnyh kletkah cel'noj krovi prakticheski zdorovyh lic i rekonvalescentov pnevmonii, podvergnutyh mitogennoj stimulyacii [Condition of RIG-I and NF-KB-signal pathways in mononuclear cells of whole blood of practically healthy people and reconvalescents of pneumonia affected by mitogenic stimulation]. Genes and cells. 3 (14): 131–136.
Ghobadi H., Hosseini N., Aslani M.R. 2020. Correlations Between Serum Decoy Receptor 3 and Airflow Limitation and Quality of Life in Male Patients with Stable Stage and Acute Exacerbation of COPD. Lung. 198 (3): 515–523.
Spolski R., West E.E., Li P., Veenbergen S. 2019. IL-21/type I interferon interplay regulates neutrophildependent innate immune responses to Staphylococcus aureus. Elife. 8:e45501.
Long D., Chen Y., Wu H., Zhao M., Lu Q. 2019. Clinical significance and immunobiology of IL-21 in autoimmunity. J. Autoimmun. 99: 1–14.
Lee J.W., Kwak H.J., Lee J.J. 2008. HSP27 regulates cell adhesion and invasion via modulation of focal adhesion kinase and MMP-2 expression. Eur. J. Cell. Biol. 87 (6): 377–387.
Hsieh S.L., Lin W.W. 2017. Decoy receptor 3: an endogenous immunomodulator in cancer growth and inflammatory reactions. J. Biomed. Sci. 24 (1): 39.
Liu Z., Guo S., Dong Q. 2020. Nobiletin suppresses IL-21/IL-21 receptor-mediated inflammatory response in MH7A fibroblast-like synoviocytes (FLS): An implication in rheumatoid arthritis. Eur. J. Pharmacol. 875: 172939.
Wang M., Xie Z., Xu J., Feng Z. 2020. TWEAK/Fn14 axis in respiratory diseases. Clin Chim Acta. 509: 139–148.
Pan Y.G., Huang M.T., Sekar P., Huang D.Y. 2021. Decoy Receptor 3 Inhibits Monosodium Urate- Induced NLRP3 Inflammasome Activation via Reduction of Reactive Oxygen Species Production and Lysosomal Rupture. Front Immunol. 12: 638676.
Shimada Y., Shimura H., Tanaka R. 2018. Phosphorylated recombinant HSP27 protects the brain and attenuates blood-brain barrier disruption following stroke in mice receiving intravenous tissueplasminogen activator. PLoS One. 13 (5): e0198039.
Strengell M., Lehtonen A., Matikainen S., Julkunen I. 2006. IL-21 enhances SOCS gene expression and inhibits LPS-induced cytokine production in human monocyte-derived dendritic cells. J. Leukoc. Biol. 79 (6): 1279–1285.
Fujimoto Y., Kuramoto N., Yoneyama M., Azuma Y.T. 2021. Interleukin-19 as an Immunoregulatory Cytokine. Curr. Mol. Pharmacol. 14 (2): 191–199.
Thöni V., Oliva R., Mauracher D., Egg M. 2021. Therapeutic Nuclear Magnetic Resonance affects the core clock mechanism and associated Hypoxia-inducible factor-1. Chronobiol Int. 38 (8): 1120–1134.
Kim J.Y., An Y.M., Yoo B.R., Kim J.M. 2018. HSP27 inhibitor attenuates radiation-induced pulmonary inflammation. Sci. Rep. 8 (1): 4189.
Vallières F., Durocher I., Girard D. 2019. Biological activities of interleukin (IL)-21 in human monocytes and macrophages. Cell. Immunol. 337: 62–70.
Voevodin A.A., Khadartsev A.A., Bondar S.S., Terekhov I.V. 2017. The State of Intracellular Molecular Regulators during the Reconvalescence of Community-Acquired Pneumonia under the Influence of Microwaves at 1 GHz. Integr Med Int. 4: 171–180.
Xu N.W., Chen Y., Liu W. 2018. Inhibition of JAK2/STAT3 Signaling Pathway Suppresses Proliferation of Burkitt's Lymphoma Raji Cells via Cell Cycle Progression, Apoptosis, and Oxidative Stress by Modulating HSP70. Med. Sci. Monit. 24: 6255–6263.
Yoshida S., Yamamoto M., Aoki H., Fukuda H. 2019. STAT3 Activation Correlates with Adventitial Neutrophil Infiltration in Human Aortic Dissection. Ann. Vasc. Dis. 12 (2): 187–193.