Особенности атеросклеротического поражения коронарного русла у больных сахарным диабетом с острым инфарктом миокарда молодого и среднего возраста
Aннотация
В статье проведено исследование особенности атеросклероти ческого поражения коронарного русла и стратегии реперфузии методом чрескожного коронарного вмешательства (ЧКВ) реваскуляризации коронарной артерии в связи с прогнозом в популяции больных сахарным диабетом (СД) с острым инфарктом миокарда (ОИМ) молодого и с реднего возраста. Пациенты с ОИМ были обследованы путем определения биомаркеров и выполнения эхокардиографии (ЭхоКГ) в первые сутки ОИМ после ЧКВ со стентированием инфаркт - связанной коронарной артерии; через 12 месяцев повторно проводилось ЭхоКГ и опреде ление NT-proBNP. Установлено, что мультисосудистое поражение было у 41 % больных СД, а у 59 % – поражение одной КА. Мультисосудистое поражение среди 35 больных СД с передним ОИМ было зарегистрировано у 18 (51 %) человек. При непереднем ОИМ у 13 из 41 (31 %) больного СД отмечали мультисосудистое поражение. Установлено, что стеноз проксимального сегмента правой коронарной артерии (ПКА) чаще всего встречается у больных СД с ОИМ с мультисосудистым поражением. У больных СД с передним ОИМ с мультисосудистым поражением распространенность стеноза среднего сегмента левой коронарной артерии (ЛКА) уступает только стенозу в проксимальном сегменте ПКА. Неблагоприятный прогноз в долгосрочной перспективе среди больных СД с ОИМ молодого и среднего возраста был чаще, чем у больных без СД. Выбор стратегии реваскуляризации коронарных поражений у пациентов с мультисосудистым ОИМ обусловлен необходимостью открыть все артерии со стенозом, равным или превышающим 75 %, особенно дистальной сегмента левой коронарной артерии (ЛКА).
Ключевые слова: острый инфаркт миокарда, сахарный диабет, коронарная ангиография, N-концевой прогормон мозговой натрийуретический пептид, стеноз коронарных артерий
Введение
Целью реперфузионной терапии является открытие инфаркт-связанной коронарной артерии (КА) и достижение максимальной степени реперфузии миокарда. Ранняя реперфузия инфаркт-связанной КА [Arnett et al, 2019] приводит к уменьшению зоны некроза, улучшению функции левого желудочка (ЛЖ) и повышению частоты благоприятного ремоделирования ЛЖ [Мареев и др., 2018], а в конечном счете – к увеличению выживаемости, что было достоверно показано в последнем исследовании.
С одной стороны, гипергликемия и накопление конечных продуктов гликозилирования (КПГ) как основные патологические изменения у больных сахарным диабетом (СД) в результате приводят к повышению частоты атеросклеротического поражения КА [Голухова и др., 2013]. Высокая частота диабетических микроангиопатий составляет 14–55 % случаев [Марданов, 2015; Ma et al., 2018] у больных СД по сравнению с теми, у кого его нет. С другой стороны, накопление в крови недоокисленных продуктов обмена глюкозы является специфическим изменением микроциркуляторного русла миокарда у больных СД [Марданов, 2015]. По данным разных авторов, длительность СД, наличие артериальной гипертензии, возраст больного, степень компенсации СД и склонность к накоплению кетоновых тел оказывают влияние на вышеперечисленные патологические изменения [Шестакова и др., 2011; Какорин и др., 2013; Ташкенбаева и др., 2019; Yildirim et al., 2019], которые приводят к более неблагоприятному течению [Никитина и др., 2020] инфаркта миокарда (ИМ) у больных СД.
Количество сегментов КА со значимыми стенозами можно использовать как оценку отдаленного прогноза у пациентов с острым коронарным синдромом (ОКС) и СД-2. Относительный шанс (ОШ) количества сегментов КА со значимыми стенозами при коронароангиографии (КАГ) у больных СД составляет 5,38 (1,48–19,5) [Feldmann еt al., 2018]. Таким образом, при многососудистом поражении в общих и специфических случаях можно рассматривать чрескожное коронарное вмешательство (ЧКВ) как эффективный метод [Watanabe et al., 2018] оптимальной реваскуляризации миокарда.
Объекты и методы исследования
Дизайн – проспективное контролируемое нерандомизированное исследование с участием 191 человека в возрасте от 36 до 59 лет с ОИМ, которые были разделены на две группы. В основную группу вошли 76 больных СД, в группу сравнения – 115 больных без СД. Пациенты в обеих группах были сопоставимы по возрасту, полу, сопутствующей патологии и осложнениям острого инфаркта миокарда (ОИМ). В среднем длительность СД составила 6 лет (от 1 года до 12 лет).
В первую группу обследованных вошли 76 пациентов с ОИМ с СД в возрасте от 36 до 59 лет, медиана – 52 года; во 2-ю группу – 115 пациентов с ОИМ без СД, возраст – от 38 до 59 лет, медиана – 53 года. Индекс массы тела (ИМТ) у больных СД – от 23 до 44 кг/м2, медиана ИМТ – 29 кг/м2, не имеет статистически значимой разницы по сравнению с больными без СД (ИМТ – от 22 до 33 кг/м2, медиана – 27 кг/м2). Скорость клубочковой фильтрации (СКФ) по MDRD (Modification of Diet in Renal Disease – модификация диеты при заболеваниях почек) у больных СД составила от 55 до 80 мл/мин/1,73 м2, медиана – 67 мл/мин/1,73 м2, что статистически значимо ниже, чем у больных без СД (от 67 до 88 мл/мин/1,73 м2, медиана – 76 мл/мин/1,73 м2). ИМ был выявлен в анамнезе у 24 больных СД и у 20 больных без СД. Среди 76 больных СД у 35 (46 %) был зарегистрирован передний ИМ и у 41 (54 %) больного – заднебоковой ИМ. Среди 115 больных без СД у 56 (49 %) был зафиксирован передний ИМ и у 59 (51 %) – заднебоковой. Среди больных СД с артериальной гипертензией были отмечены следующие степени: у 32 человек (42 %) – I степень, у 10 человек (14 %) – II степень, у 34 (44 %) человек – III степень. Среди больных без СД фиксировались следующие показатели: у 72 (63 %) человек – I степень, у 25 (22 %) – II степень, у 18 (15 %) – III степень. Troponin I у больных СД (11152,8±10099,3 пг/мл,) достоверно выше, чем у больных без СД (9650,6±9181,3 пг/мл). Гликозилированный гемоглобин составил 7,12 % (от 6,45 до 10,21 %), что статистически значимо выше, чем у больных без СД (от 5,05 до 5,49 %, медиана – 5,31). NTproBNP в 1е сутки после ЧКВ у больных СД (от 618 до 1418 пг/мл, медиана – 881 пг/мл) оказался статистически значимо выше, чем у больных без СД (от 319 до 739 пг/мл, медиана – 508 пг/мл) (табл. 1).
По ЭхоКГ, выполненной в М и В режимах, определяли фракцию выброса (ФВ) по методу Simpson, индекс нарушения локальной сократимости (ИНЛС). ФВ оценивали по рекомендациям Американского общества эхокардиографии (ASE) и Европейской ассоциации сердечнососудистой визуализации (ECI) (2015) [Hendriks et al., 2017 и Watanabe et al., 2018]. ФВ не менее 46 % считалась удовлетворительной, а ФВ не более 45 % – сниженной.
Определение NTproBNP считают золотым стандартом в диагностике сердечной недостаточности. Уровень NTproBNP в сыворотке крови определяли дважды: в 1-е сутки после ЧКВ и через 12 месяцев. Измерения проводили на аппарате Cobas с использованием платформы Elecsys (Roche Diagnostics, США, 2017). Норма – менее 125 пг/мл.
Таблица 1
Table 1
Характеристика обследованных больных с ОИМ
Characteristics of the AMI patients examined
Показатель | Медиана (IQR), % или n | |
Больные СД | Больные без СД | |
Возраст, лет | 52 (36–59) | 53 (38–59) |
Пол м/ж , n | 59 / 17 | 101 / 14 |
ИМТ, кг/м2 | 29 (23–44) | 27 (22–33) |
Длительность СД, n (%) |
16 (21 %) | |
Артериальная гипертензия, n (%) |
32 (42 %) |
72 (63 %) |
Инфаркт миокарда в анамнезе, n | 24 | 20 |
ОСН по классификации Killip, n (%) |
48 (63 %) |
85 (74 %) |
Передний инфаркт миокарда, n (%) | 35 (46 %) | 56 (49 %) |
Непередний инфаркт миокарда, n (%) | 41 (54 %) | 59 (51 %) |
Troponin I, пг/мл | 11152,8±10099,3 * | 9650,6±9181,3 |
Гликозилированный гемоглобин, % | 7,12 (6,45–10,21) * | 5,31 (5,00–5,49) |
СКФ по MDRD, мл/мин/1,73 кв. м | 67 (55–80) * | 76 (67–88) |
NT-proBNP, пг/мл | 881 (618–1418) * | 508 (319–739) |
Примечание:* р < 0,05.
В данном исследовании значимым считали стеноз КА >50 % по двум позициям [Franz-Josef et al., 2019]. Функциональной определяли КА диаметром большим или равным 2 мм. Мультисосудистым поражением КА считали атеросклеротическое поражение более одного сосуда [Jean-Philippe et al., 2021] по результатам КАГ (табл. 2).
Таблица 2
Table 2
Характеристика поражения коронарных артерий у больных с ОИМ
Characteristics injure of coronary artery disease in AMI patients
Показатель | Передний ОИМ | Непередний ОИМ | ||
больные СД | больные без СД | больные СД | больные без СД | |
Однососудистое поражение | 17 | 36 | 28 | 38 |
ЛКА | 14 | 29 | 12 | 22 |
ОА | 1 | 7 | 10 | 7 |
ПКА | 2 | 0 | 6 | 8 |
Мультисосудистое поражение | 18 | 17 | 13 | 21 |
ЛКА и ОА | 3 | 3 | 4 | 5 |
ЛКА и ПКА | 8 | 6 | 2 | 10 |
ПКА и ОА | 4 | 3 | 3 | 1 |
ЛКА и ПКА и ОА | 3 | 5 | 4 | 5 |
Примечание: ОИМ – острый инфаркт миокарда; СД – сахарный диабет; ЛКА – левая коронарная артерия; ОА – огибающая артерия левой коронарной артерии; ПКА – правая коронарная артерия.
Выявлено мультисосудистое поражение у 41 % больных СД, а у 59 % – поражение одной КА. У пациентов без СД это соотношение составило 33 и 67 % соответственно (рис. 1). Мультисосудистое поражение среди 35 больных СД с передним ОИМ было зарегистрировано у 18 (51 %), а среди 53 больных без СД – у 17 (32 %) человек. У больных СД с передним ИМ чаще, чем у больных без СД (51 % против 32 %), реперфузии миокарда проводили путем имплантации двух и даже трех стентов. При непереднем ОИМ у 13 из 41 больного СД отмечали мультисосудистое поражение (31 %), а у больных без СД – у 21 из 59 (36 %). У больных СД с передним ИМ реже, чем у больных без СД (31 % против 36 %), реперфузии миокарда проводили путем имплантации двух и даже трех стентов.
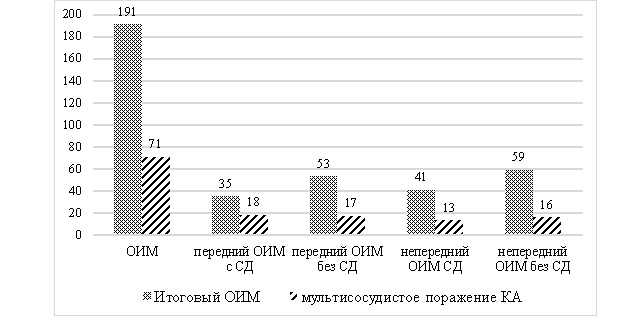
Рис. 1. Диаграмма распространенности мультисосудистого поражения КА у больных с ОИМ
Fig. 1. Diagram of the prevalence of multivessel injure coronary disease in AMI patients
Статистическую обработку результатов исследования проводили с использованием программ статистики Statasoft (2015) и Medcalc (2018). Все показатели представлены как медиана и их интерквартильный размах. Значимость различий переменных величин между сравниваемыми группами больных оценивалась по U-критерию Mann – Whitney. Связи между сегментами КА и ФВ ЛЖ были исследованы с помощью многомерного логистического регрессионного анализа.
Результаты
Однососудистое поражение КА у больных ОИМ
По данным КАГ, однососудистое поражение КА диагностировано у 17 больных СД с передним ОИМ. Проксимальный сегмент ЛКА представляет собой то место, где чаще всего встречается поражение сегмента (5 человек), сужение – от 85 до 90 %, медиана – 90 %. У 4 человек отмечено поражение первой диагональной артерии ЛКА, медиана – 90 %. Кроме того, зарегистрировано поражение дистального сегмента ЛКА (медиана сужения – 80 %),
2-й диагональной артерии ЛКА (медиана сужения – 70 %) и среднего сегмента ОА (медиана сужения – 65 %) у 1 человека. Из числа пациентов с правым типом кровоснабжения сердца у 1 человека диагностировано поражение проксимального сегмента ПКА (медиана сужения – 70 %), у 2 – поражение среднего сегмента ПКА (медиана сужения – 90 %) (табл. 3).
Таблица 3
Table 3
Частота поражения КА и степень сужения сегментов у больных СД с передним ОИМ с разными вариантами поражения КА по КАГ
Frequency of coronary artery lesions and degree of segmental stenosis in DM patients with anterior AMI with different variants of CA stenosis by coronary angiography
Показатель | Однососудистое поражение КА | Мультисосудистое поражение КА | |||
ЛКА и ОА | ЛКА и ПКА | ОА и ПКА | ЛКА и ОА и ПКА | ||
ЛКА прок. | 5 | 1 | 3 |
| 3 |
% | 90 [85–90] | 90 | 90 [90–90] |
| 80 [70–90] |
ЛКА сред. | 4 |
| 5 |
| 3 |
% | 90 [70–95] |
| 85 [80–90] |
| 88 [85–90] |
ЛКА дист. | 1 | 1 |
|
|
|
% | 80 [80–80] | 90 |
|
|
|
ЛКА 1СА |
|
|
|
|
|
% |
|
|
|
|
|
ЛКА 1ДА | 4 | 1 | 1 |
| 1 |
% | 90 [90–95] | 95 | 90 |
| 90 |
ЛКА 2ДА | 1 |
|
|
|
|
% | 70 |
|
|
|
|
ЛКА 1П |
|
| 1 |
|
|
% |
|
| 75 |
|
|
ОА прок. |
|
|
| 3 | 2 |
% |
|
|
| 77 [70–80] | 75 [70–80] |
ОА сред. | 1 |
|
|
| 1 |
% | 65 |
|
|
| 90 |
ОА дист. |
| 1 |
|
| 2 |
% |
| 80 |
|
| 82,5 [75–90] |
ОА 1МА |
| 2 |
|
| 1 |
% |
| 82,5 [75–90] |
|
| 90 |
ОА 2МА |
|
|
|
|
|
% |
|
|
|
|
|
ПКА прок. | 1 |
| 8 | 3 | 3 |
% | 70 |
| 90 [77,5–95] | 87 [80–90] | 83 [70–90] |
ПКА сред. | 2 |
| 3 | 3 | 2 |
% | 90 [90–90] |
| 90 [80–95] | 83 [80–90] | 90 [90–90] |
ПКА дист. | 0 |
| 2 | 1 | 1 |
% |
|
| 72.5 [70–75] | 70 | 80 |
Примечание: ОИМ – острый инфаркт миокарда; СД – сахарный диабет; ЛКА – левая коронарная артерия; ОА – огибающая артерия левой коронарной артерии; ПКА – правая коронарная артерия; прок. – проксимальный сегмент; сред. – средний сегмент; дист. – дистальный сегмент; 1СА – первая септальная артерия левой коронарной артерии; 1ДА – первая диагональная артерия левой коронарной артерии; 2ДА – вторая диагональная артерия левой коронарной артерии; 1П – первая промежуточная ветвь левой коронарной артерии; 1МА – первая маргинальная ветвь огибающей артерии ЛКА; 2МА – вторая маргинальная ветвь огибающей артерии ЛКА.
Однососудистое поражение КА наблюдалось у 36 больных без СД с передним ОИМ. Проксимальный сегмент ЛКА представляет собой то место, где чаще всего встречается поражение сегмента (17 человек) (сужение от 70 до 90 %, медиана – 90 %). У 9 человек диагностировано поражение среднего сегмента ЛКА, (сужение от 75 до 90 %, медиана – 90 %). У 4 пациентов отмечено поражение 2-й диагональной артерии ЛКА (сужение от 70 до 95 %, медиана – 80 %). У 3 больных наблюдалось поражение дистального сегмента ЛКА (сужение от 85 до 90 %, медиана – 90 %). У 2 пациентов диагностировано поражение 1-й диагональной артерии ЛКА (сужение от 90 до 90 %, медиана – 90 %). Кроме того, поражение 1-й септальной артерии ЛКА (медиана сужения – 90 %), 1-й промежуточной артерии ЛКА (медиана сужения – 90 %) выявлено у 1 человека. У 2 пациентов с правым типом кровоснабжения сердца наблюдалось поражение проксимального сегмента ПКА (медиана сужения – 90 %), у 1 больного – поражение среднего сегмента ПКА (медиана сужения – 70 %) (табл. 4).
Таблица 4
Table 4
Частота поражения КА и степень сужения сегментов у больных без СД с передним ОИМ с разными вариантами поражения КА по КАГ
Frequency of coronary artery lesions and degree of segmental stenosis without DM patients with anterior AMI with different variants of CA stenosis by coronary angiography
Показатель | Больные без СД с передним ОИМ | ||||
Однососудистое поражение КА | Мультисосудистое поражение КА | ||||
ЛКА и ОА | ЛКА и ПКА | ОА и ПКА | ЛКА и ОА и ПКА | ||
ЛКА прок. | 17 | 2 | 5 |
| 3 |
% | 90 [70–90] | 85 [80–90] | 90 [75–90] |
| 85 [75–90] |
ЛКА сред. | 9 | 2 | 2 |
| 1 |
% | 90 [75–95] | 82,5 [80–85] | 90 [90–90] |
| 80 |
ЛКА дист. | 3 |
|
|
| 1 |
% | 90 [85–90] |
|
|
| 85 |
ЛКА 1СА | 1 |
|
|
| 1 |
% | 90 |
|
|
| 70 |
ЛКА 1ДА | 2 |
| 3 |
| 2 |
% | 90 [90–90] |
| 90 [90–90] |
| 95 [90–100] |
ЛКА 2ДА | 4 |
|
|
|
|
% | 80 [70–95] |
|
|
|
|
ЛКА 1П | 1 |
| 1 |
|
|
% | 90 |
| 90 |
|
|
ОА прок. | 1 |
|
| 1 | 2 |
% | 65 |
|
| 90 | 80 [70–90] |
ОА сред. |
| 1 |
| 2 | 3 |
% |
| 80 |
| 80 [80–80] | 80 [70–90] |
ОА дист. |
| 1 |
|
| 1 |
% |
| 70 |
|
| 75 |
ОА 1MA |
| 1 |
|
| 3 |
% |
| 75 |
|
| 85 [80–90] |
OA 2MA |
| 1 |
| 1 |
|
% |
| 95 |
| 90 |
|
ПКА прок. | 2 |
| 5 | 3 | 3 |
% | 90 [90–90] |
| 80 [75–90] | 85 [75–90] | 90 [90–90] |
ПКА сред. | 1 |
| 3 |
| 3 |
% | 70 |
| 80 [75–90] |
| 90 [88–95] |
ПКА дист. |
|
| 1 |
| 1 |
% |
|
| 80 |
| 75 |
Примечание: ОИМ – острый инфаркт миокарда; СД – сахарный диабет; ЛКА – левая коронарная артерия; ОА – огибающая артерия левой коронарной артерии; ПКА – правая коронарная артерия; прок. – проксимальный сегмент; сред. – средний сегмент; дист. – дистальный сегмент; 1СА – первая септальная артерия левой коронарной артерии; 1ДА – первая диагональная артерия левой коронарной артерии; 2ДА – вторая диагональная артерия левой коронарной артерии; 1П – первая промежуточная ветвь левой коронарной артерии; 1МА – первая маргинальная ветвь огибающей артерии ЛКА; 2МА – вторая маргинальная ветвь огибающей артерии ЛКА.
По данным КАГ, однососудистое поражение КА диагностировано у 28 больных СД с непередним ОИМ. Проксимальный сегмент ЛКА представляет собой то место, где чаще всего встречается поражение сегмента (6 человек) (сужение от 70 до 90 %, медиана – 90 %). У 5 человек выявлено поражение среднего сегмента ЛКА (сужение от 70 до 90 %, медиана – 70 %), у 4 – поражение проксимального сегмента ОА (сужение от 70 до 80 %, медиана – 75 %). Кроме того, зафиксировано поражение дистального сегмента ЛКА (от 70 до 90 %, медиана – 70 %), 1-й диагональной артерии ЛКА (от 70 до 90 %, медиана – 90 %), среднего сегмента ОА (от 70 до 80 %, медиана сужения – 72,5 %), дистального сегмента ОА (от 70 до 75 %, медиана сужения – 72,5 %) у 3 человек. У 2 человек наблюдалось поражение 1-й промежуточной артерии ЛКА (сужение от 70 до 90 %, медиана – 80 %). У 3 пациентов с правым типом кровоснабжения сердца отмечено поражение дистального сегмента ЛКА (от 70 до 90 %, медиана – 70 %), поражение 1-й диагональной артерии ЛКА (от 70 до 90 %, медиана – 90 %), поражение среднего сегмента ОА (от 70 до 80 %, медиана сужения – 72,5 %), поражение дистального сегмента ОА (от 70 до 75 %, медиана сужения – 72,5 %). У 2 пациентов с правым типом кровоснабжения сердца наблюдалось поражение проксимального сегмента ПКА (медиана – 90 %), среднего сегмента ПКА (медиана – 90 %) и дистального сегмента ПКА (сужение 90 %) (табл. 5).
Таблица 5
Table 5
Частота поражения КА и степень сужения сегментов у больных СД с непередним ОИМ с разными вариантами поражения КА по КАГ
Frequency of coronary artery lesions and degree of segmental stenosis in DM patients with non-anterior AMI with different variants of CA stenosis by coronary angiography
Показатель | Больные СД с непередним ОИМ | ||||
Однососудистое поражение | Мультисосудистое поражение | ||||
ЛКА и ОА | ЛКА и ПКА | ОА и ПКА | ЛКА и ОА и ПКА | ||
ЛКА прок. | 6 | 3 | 1 |
| 2 |
% | 90 [70–90] | 90 [70–90] | 90 |
| 85 [80–90] |
ЛКА сред. | 5 | 1 | 1 |
| 2 |
% | 70 [70–90] | 85 | 90 |
| 90 [90–90] |
ЛКА дист. | 3 |
| 1 |
| 1 |
% | 70 [70–80] |
| 85 |
| 90 |
ЛКА 1СА |
|
|
|
| 1 |
% |
|
|
|
| 80 |
ЛКА 1ДА | 3 |
| 1 |
| 1 |
% | 90 [70–90] |
| 100 |
| 90 |
ЛКА 2ДА |
| 1 |
|
|
|
% |
| 85 |
|
|
|
ЛКА 1П | 2 |
|
|
| 1 |
% | 80 [70–90] |
|
|
| 90 |
ОА прок. | 1 | 2 |
|
| 1 |
% | 70 | 80 |
|
| 75 |
ОА сред. | 1 |
|
| 2 | 2 |
% | 70 |
|
| 85 [80–90] | 85 [80–90] |
ОА дист. | 1 | 1 |
| 1 |
|
% | 70 | 70 |
| 80 |
|
OA 1MA |
| 1 |
|
|
|
% |
| 90 |
|
|
|
OA 2MA |
| 1 |
|
|
|
% |
| 90 |
|
|
|
ПКА прок. | 2 |
|
| 3 | 2 |
% | 90 [90–90] |
|
| 87 [80–90] | 75 [70–80] |
ПКА сред. | 2 |
| 1 | 1 | 4 |
% | 70 [70–70] |
| 90 | 90 | 77,5 [75–80] |
ПКА дист. | 2 |
| 1 |
| 1 |
% | 70 [70–70] |
| 90 |
| 90 |
Примечание: ОИМ – острый инфаркт миокарда; СД – сахарный диабет; ЛКА – левая коронарная артерия; ОА – огибающая артерия левой коронарной артерии; ПКА – правая коронарная артерия; прок. – проксимальный сегмент; сред. – средний сегмент; дист. – дистальный сегмент; 1СА – первая септальная артерия левой коронарной артерии; 1ДА – первая диагональная артерия левой коронарной артерии; 2ДА – вторая диагональная артерия левой коронарной артерии; 1П – первая промежуточная ветвь левой коронарной артерии; 1МА – первая маргинальная ветвь огибающей артерии ЛКА; 2МА – вторая маргинальная ветвь огибающей артерии ЛКА.
Однососудистое поражение КА диагностировано у 38 больных без СД с непередним ОИМ. Наблюдалось поражение проксимального сегмента ЛКА (от 75 до 90 %, медиана сужения – 90 %) и среднего сегмента ЛКА (от 70 до 90 %, медиана сужения – 80 %) у 7 человек. Отмечено поражение дистального сегмента ЛКА (от 70 до 85 %, медиана – 70 %) и 1-й диагональной артерии ЛКА (от 90 до 90 %, медиана – 90 %) у 3 человек. Диагностировано поражение проксимального сегмента ОА (от 75 до 90 %, медиана – 80 %) и среднего сегмента ОА (от 75 до 90 %, медиана – 80 %) у 3 больных. У 2 человек наблюдалось поражение 1-й промежуточной артерии ЛКА (сужение от 70 до 80 %, медиана – 75 %). Наблюдалось поражение 1-й септальной артерии ЛКА (медиана – 90 %) и дистального сегмента ОА (медиана – 75 %) у 1 человека. У 1 пациента с правым типом кровоснабжения сердца имело место поражение проксимального сегмента ПКА (медиана – 80 %); поражение среднего сегмента артерий ПКА (медиана – 80 %) – у 4 пациентов (табл. 6).
Таблица 6
Table 6
Частота поражения КА и степень сужения сегментов у больных без СД с непередним ОИМ с разными вариантами поражения КА по КАГ
Frequency of coronary artery lesions and degree of segmental stenosis without DM patients with non-anterior AMI with different variants of CA stenosis by coronary angiography
Показатель | Больные без СД с непередним ОИМ | ||||
Однососудистое поражение | Мультисосудистое поражение | ||||
ЛКА и ОА | ЛКА и ПКА | ОА и ПКА | ЛКА и ОА и ПКА | ||
ЛКА прок. | 7 | 1 | 6 |
| 3 |
% | 90 [75–90] | 65 | 80 [70–90] |
| 88 [85–90] |
ЛКА сред. | 7 | 2 | 3 |
| 2 |
% | 80 [70–90] | 77.5 [75–80] | 90 [80–90] |
| 85 [80–90] |
ЛКА дист. | 3 |
| 1 |
| 1 |
% | 70 [70–85] |
| 70 |
| 65 |
ЛКА 1СА | 1 |
|
|
|
|
% | 90 |
|
|
|
|
ЛКА 1ДА | 3 |
|
|
| 2 |
% | 90 [90–90] |
|
|
| 87,5 [85–90] |
ЛКА 2ДА |
| 1 | 1 |
|
|
% |
| 85 | 75 |
|
|
ЛКА 1П | 2 | 1 | 1 |
|
|
% | 75 [70–80] | 85 | 65 |
|
|
ОА прок. |
|
|
|
|
|
% |
|
|
|
|
|
ОА сред. |
| 2 |
| 1 | 4 |
% |
| 90 [85–95] |
| 90 | 88 [87,5–90] |
ОА дист. |
|
|
|
| 1 |
% |
|
|
|
| 95 |
OA 1MA |
|
|
|
| 2 |
% |
|
|
|
| 92,5 [90–95] |
OA 2MA |
| 1 |
|
|
|
% |
| 90 |
|
|
|
ПКА прок. | 1 |
| 3 |
| 2 |
% | 70 |
| 85 [80–90] |
| 77,5 [75–80] |
ПКА сред. | 1 |
| 6 | 1 | 3 |
% | 70 |
| 87 [70–95] | 90 | 88 [85–90] |
ПКА дист. | 0 |
| 2 |
| 3 |
% |
|
| 85 [80–90] |
| 90 [90–90] |
Примечание: ОИМ – острый инфаркт миокарда; СД – сахарный диабет; ЛКА – левая коронарная артерия; ОА – огибающая артерия левой коронарной артерии; ПКА – правая коронарная артерия; прок. – проксимальный сегмент; сред. – средний сегмент; дист. – дистальный сегмент; 1СА – первая септальная артерия левой коронарной артерии; 1ДА – первая диагональная артерия левой коронарной артерии; 2ДА – вторая диагональная артерия левой коронарной артерии; 1П – первая промежуточная ветвь левой коронарной артерии; 1МА – первая маргинальная ветвь огибающей артерии ЛКА; 2МА – вторая маргинальная ветвь огибающей артерии ЛКА.
Мультисосудистое поражение КА у больных с ОИМ
Мультисосудистое поражение КА имело место у 18 больных СД с передним ОИМ, двух артерий – у 15, трех – у 3 больных.
Из числа пациентов с поражением ЛКА и ОА поражение первого маргинального сегмента ОА (диаметр более 2 мм) диагностировано у 2 больных (сужение от 75 до 90 %, медиана – 82,5 %); поражение проксимального сегмента ЛКА – у 1 (медиана – 90 %); поражение дистального сегмента ЛКА – у 1 (медиана – 90 %); поражение первой диагональной артерии ЛКА – у 1 (медиана – 90 %); поражение дистального сегмента ОА – у 1 больного (медиана – 80 %).
Из числа больных с поражением ЛКА и ПКА поражение проксимального сегмента ПКА наблюдалось у 8 человек (от 77,5 до 95 %, медиана – 90 %); поражение среднего сегмента ЛКА – у 5 (от 80 до 90 %, медиана – 85 %). Диагностировано поражение проксимального сегмента ЛКА (медиана – 90 %), среднего сегмента ЛКА (медиана – 90 %) и дистального сегмента ЛКА (от 70 до 75 %, медиана – 72,5 %) у 3 пациентов с поражением ЛКА и ПКА. Наблюдалось поражение дистального сегмента ПКА (от 70 до 75 %, медиана – 72,5 %), 1-й диагональной артерии ЛКА (медиана – 90 %) и 1-й промежуточной артерии ЛКА (медиана – 75 %) у 1 человека с поражением ЛКА и ПКА.
Имело место поражение проксимального сегмента ПКА (от 80 до 90 %, медиана – 87 %), среднего сегмента ПКА (от 80 до 90 %, медиана – 83 %) и проксимального сегмента ОА (от 70 % до 80 %, медиана – 77 %) у 3 человек с поражением ОА и ПКА. У 1 больного с поражением ОА и ПКА наблюдалось поражение дистального сегмента ПКА (медиана – 70 %) (табл. 3).
Наблюдалось поражение проксимального сегмента ЛКА (от 70 до 90 %, медиана – 80 %), дистального сегмента ЛКА (от 85 до 90 %, медиана – 88 %) и проксимального сегмента ПКА (от 70 % до 90 %, медиана – 83 %) у 3 человек с поражением трех маргинальных КА. Диагностировано поражение проксимального сегмента ОА (от 70 до 80 %, медиана – 75 %), дистального сегмента ОА (от 75 до 90 %, медиана – 82,5 %) и среднего сегмента ПКА (медиана – 90 %) у 2 человек с поражением трех маргинальных КА. Имело место поражение 1-й диагональной артерии ЛКА (медиана – 90 %), среднего сегмента ОА (медиана – 90 %), 1-й маргинальной артерии ОА (медиана – 90 %) и дистального сегмента ПКА (медиана – 80 %) у 1 человека с поражением трех маргинальных КА (табл. 3).
Мультисосудистое поражение КА имело место у 17 больных без СД с передним ОИМ, двух артерий – у 12, трех – у 5 больных. Наблюдалось поражение проксимального сегмента ЛКА (от 70 до 90 %, медиана – 80 %), среднего сегмента ЛКА (от 80 до 90 %, медиана – 85 %) и проксимального сегмента ПКА (от 80 до 85 %, медиана – 82,5 %) у 2 человек с поражением ЛКА и ОА. Отмечено поражение среднего сегмента ОА (медиана – 70 %), дистального сегмента ОА (медиана – 85 %), 1-й маргинальной артерии ОА (медиана – 80 %) и 2-й маргинальной артерии ОА (медиана – 80 %) у 1 человека с поражением ЛКА и ОА. Наблюдалось поражение проксимального сегмента ЛКА (от 75 до 90 %, медиана – 90 %), проксимального сегмента ПКА (от 75 до 90 %, медиана – 80 %) у 5 человек с поражением ЛКА и ПКА. Диагностировано поражение среднего сегмента ПКА (от 75 до 90 %, медиана – 80 %), 1-й диагональной артерии ЛКА (медиана – 90 %) у 3 человек с поражением ЛКА и ПКА. Наблюдалось поражение среднего сегмента ЛКА (медиана – 90 %), 1-й промежуточной артерии ЛКА (медиана – 90 %) и дистального сегмента ПКА (медиана – 80 %) у 1 человека с поражением ЛКА и ПКА. У 3 больных с поражением ОА и ПКА имело место поражение проксимального сегмента ПКА (сужение от 75 до 90 %, медиана – 85 %). У 2 больных с поражением ОА и ПКА имело место поражение среднего сегмента ОА (медиана – 80 %). Диагностировано поражение проксимального сегмента ОА (медиана – 90 %) и 1-й маргинальной артерии ОА (медиана – 90 %) у 1 человека с поражением ОА и ПКА (см. табл. 4).
Наблюдалось поражение проксимального сегмента ЛКА (от 75 до 90 %, медиана – 85 %), среднего сегмента ОА (от 70 до 90 %, медиана – 80 %), проксимального сегмента ПКА (медиана – 90 %) и среднего сегмента ПКА (от 88 до 95 %, медиана – 90 %) у 3 человек с поражением трех маргинальных КА. Поражение проксимального сегмента ОА (от 70 до 90 %, медиана – 80 %), 1-й диагональной артерии ЛКА (от 90 до 100 %, медиана – 95 %) отмечали у 2 человек с поражением трех маргинальных КА. Наблюдалось поражение среднего сегмента ЛКА (медиана – 85 %), 1-й септальной артерии ЛКА (медиана – 70 %), дистального сегмента ОА (медиана – 75 %) и дистального сегмента ПКА (медиана 75 %) у 1 человека с поражением трех маргинальных КА (см. табл. 4).
Мультисосудистое поражение КА имело место у 13 больных СД с непередним ОИМ, двух артерий – у 9, трех – у 4 человек. У 3 больных с поражением ЛКА и ОА наблюдалось поражение проксимального сегмента ЛКА (от 70 до 90 %, медиана – 70 %). У 2 больных с поражением ЛКА и ОА диагностировано поражение проксимального сегмента ОА (медиана – 80 %). Поражение среднего сегмента ЛКА (медиана – 85 %), 2-й диагональной артерии ЛКА (медиана – 85 %), дистального сегмента ОА (медиана – 70 %), 1-й маргинальной артерии ОА (медиана – 90 %) и 2-й маргинальной артерии ОА (медиана – 90 %) отмечено у 1 человека с поражением ОА и ПКА. Наблюдалось поражение проксимального сегмента ЛКА (медиана – 90 %), среднего сегмента ЛКА (медиана – 90 %), среднего сегмента ПКА (медиана – 90 %), дистального сегмента ПКА (медиана – 90 %) у 1 человека с поражением ЛКА и ПКА. Поражение дистального сегмента ЛКА (медиана – 85 %), 1-й диагональной артерии ЛКА (медиана – 100 %) имело место у 1 человека с поражением ЛКА и ПКА. У 3 больных с поражением ОА и ПКА наблюдалось поражение проксимального сегмента ПКА (от 80 до 90 %, медиана – 90 %), у 2 больных с поражением ОА и ПКА – поражение среднего сегмента ОА (от 80 до 90 %, медиана – 85 %). Наблюдалось поражение среднего сегмента ПКА (медиана – 90 %) и дистального сегмента ОА (медиана – 80 %) у 1 человека с поражением ОА и ПКА (см. табл. 5).
Поражение среднего сегмента ПКА (от 75 до 80 %, медиана – 77,5 %) диагностировано у 4 человек с поражением трех маргинальных КА. Имело место поражение проксимального сегмента ЛКА (от 80 до 90 %, медиана – 85 %), среднего сегмента ЛКА (медиана – 90 %), среднего сегмента ОА (от 80 до 90 %, медиана – 85 %) и проксимального сегмента ПКА (от 70 до 80 %, медиана – 75 %) у 2 человек с поражением трех маргинальных КА. Наблюдалось поражение дистального сегмента ЛКА (медиана – 90 %), 1-й септальной артерии (медиана – 80 %), 1-й диагональной артерии (медиана – 90 %), 1-й промежуточной артерии ОА (медиана – 90 %), проксимального сегмента ОА (медиана – 75 %) и дистального сегмента ПКА (медиана – 90 %) у 1 человека с поражением трех маргинальных КА (см. табл. 5).
Мультисосудистое поражение КА имело место у 21 больного без СД с непередним ОИМ, двух артерий – у 17, трех – у 4 человек. Наблюдалось поражение среднего сегмента ЛКА (от 75 до 80 %, медиана – 77,5 %) и среднего сегмента ОА (от 85 % до 95 %, медиана – 90 %) у 2 пациентов с поражением ЛКА и ОА. Отмечалось поражение проксимального сегмента ЛКА (медиана – 65 %), 2-й диагональной артерии ЛКА (медиана – 85 %), 1-й промежуточной артерии ЛКА (медиана – 85 %) и 2-й маргинальной артерии ОА (медиана – 90 %) у 1 человека с поражением ЛКА и ОА. Наблюдалось поражение проксимального сегмента ЛКА (от 70 до 90 %, медиана – 80 %), среднего сегмента (от 70 до 95 %, медиана – 87 %), 1-й промежуточной артерии ЛКА (медиана – 85 %) и 2-й маргинальной артерии ОА (медиана – 90 %) у 6 больных с поражением ЛКА и ПКА. Поражение проксимального сегмента ПКА (от 80 до 90 %, медиана – 85 %) и среднего сегмента (от 80 до 90 %, медиана – 90 %) имело место у 3 человек с поражением ЛКА и ПКА. У 3 больных с поражением ЛКА и ПКА наблюдалось поражение дистального сегмента ПКА (от 80 до 90 %, медиана – 85 %). Отмечалось поражение дистального сегмента ЛКА (медиана 90 %), 2-й диагональной артерии ЛКА (медиана – 90 %) и 1-й промежуточной артерии ЛКА (медиана – 90 %) у 1 человека с поражением ЛКА и ПКА. Наблюдалось поражение среднего сегмента ПКА (медиана 90 %) и среднего сегмента ОА (медиана – 90 %) у 1 больного с поражением ОА и ПКА (см. табл. 6).
Поражение среднего сегмента ОА (от 87,5 до 90 %, медиана – 88 %) имело место у 4 человек с поражением трех маргинальных КА. Наблюдалось поражение проксимального сегмента ЛКА (от 85 до 90 %, медиана – 88 %), поражение среднего сегмента ПКА (от 85 до 90 %, медиана – 88 %) и поражение среднего сегмента ПКА (медиана – 90 %) у 3 пациентов с поражением трех маргинальных КА. Диагностировано поражение среднего сегмента ЛКА (от 80 до 90 %, медиана – 85 %), 1-й диагональной артерии ЛКА (от 85 до 90 %, медиана – 87,5 %), 1-й маргинальной артерии ОА (от 90 до 95 %, медиана – 92,5 %) и проксимального сегмента ПКА (от 75 до 80 %, медиана – 77,5 %) у 2 человек с поражением трех маргинальных КА. Наблюдалось поражение дистального сегмента ЛКА (медиана – 65 %) и дистального сегмента ЛКА (медиана – 95 %) у 1 больного с поражением трех маргинальных КА (табл. 6).
Динамика параметров у больных с передним ИМ
По данным ЭхоКГ, в 1-е сутки ОИМ у больных СД с передним ИМ с мультисосудистым поражением КА среднее значение ФВ ЛЖ равно 44 % (от 42 до 49 %), что достоверно ниже, чем у больных без СД, которое составило 50 % (от 46 до 57 %) (р1 = 0,0114). Значение уровня NT-proBNP было увеличено в обеих группах (876 и 651 нг/мл соответственно), но у больных СД этот показатель был статистически значимо больше, чем у больных без СД (р1 = 0,0121). ИНЛС в обеих группах был выше нормы, но оказался статистически значимо отрицательным между группами больных СД и без СД (р1 = 0,7910) (табл. 7).
Таблица 7
Table 7
Динамика данных ФВ ЛЖ и ИНЛС по эхокардиографии и NT-proBNP у больных с передним ИМ с мультисосудистым поражением КА
Dynamics of LVEF and INLS data by echocardiography and NT-proBNP in patients with anterior myocardial infarction with multivessel coronary artery disease
Показатель | 1-е сутки ОИМ | р | Через 12 месяцев | ||
больные СД | больные без СД |
| больные СД | больные без СД | |
ФВ ЛЖ % | 44 [42–49] | 50 [46–57] | р1 = 0,0114* р2 = 0,0082* р3 = 0,5132 р4 = 0,0240* | 41 [35–52] | 54 [42–64] |
NT-proBNP пг/мл | 876 [673–1954] | 651 [331–799] | р1 = 0,0121* р2 = 0,0989 р3 = 0,0002* р4 = 0,0004* | 309 [234–865] | 202 [107–428] |
ИНЛС | 1,63 [1,38–1,69] | 1,5 [1,25–1,69] | р1 = 0,7910 р2 = 0,0991 р3 = 0,0931 р4 = 0,0026* | 1,38 [1,13–1,5] | 1,24 [1,13–1,25] |
Примечание: ФВ ЛЖ – фракция выброса левого желудочка; ИНЛС – индекс нарушения локальной сократимости; р1 – разница после реваскуляризации в 1-е сутки ОИМ между больными СД и без СД; р2 – разница после реваскуляризации КА спустя 12 месяцев после ОИМ между больными СД и без СД; р3 – разница у больных СД между ЧКВ в 1-е сутки ОИМ и через 12 месяцев после ЧКВ; р4 – разница у больных без СД между ЧКВ в 1-е сутки ОИМ и через 12 месяцев после ЧКВ; * – достоверная разница, р < 0,05.
Через 12 месяцев у больных СД с передним ИМ с мультисосудистым поражением КА ФВ ЛЖ достигала 35–52 % (в среднем 41 %), что по сравнению с ФВ поступивших в 1-е сутки не имеет достоверной разницы (р3 = 0,5132). У больных без СД ФВ ЛЖ через 12 месяцев достигала 54 % (42–64 %), что достоверно выше, чем в группе больных СД. Была отмечена положительная динамика ФВ ЛЖ у больных без СД (р4 = 0,0240, статистически значимо). Значение уровня NT-proBNP у больных СД достигало 309 нг/мл
(234–865 нг/мл) и достоверно снижалось в сравнении с 1-ми сутками ОИМ (р3 = 0,0002), в группе пациентов без СД уровень NT-proBNP оказался примерно одинаковым (р4 = 0,0004). Через 12 месяцев ИНЛС в обеих группах был примерно одинаковым (1,38 против 1,24; р2 = 0,991). ИНЛС в 1й группе оставался прежним (р3 = 0,0931), а в группе без СД оказался статистически значимо ниже, чем в 1-е сутки ОИМ (p4 = 0,0026) (табл. 7).
Динамика параметров у больных с непередним ИМ
По данным ЭхоКГ, в 1-е сутки ОИМ у больных СД с непередним ИМ с мультисосудистым поражением КА среднее значение ФВ ЛЖ составило 43 % (от 41 до 51 %), по сравнению с группой больных без СД (от 42 до 51 %, медиана – 48 %), где ФВ ЛЖ не имела достоверной разницы (р1= 0,4552). Значение уровня NT-proBNP было увеличено в обеих группах (819 нг/мл и 678 нг/мл), но у больных СД этот показатель не был статистически значимым, чем у больных без СД (р1= 0,6074). ИНЛС в обеих группах был выше, чем в норме, но оказался отрицательным статистически значимо между группами больных СД и без СД (р1 = 0,7488) (табл. 8).
Таблица 8
Table 8
Динамика данных ФВ ЛЖ и ИНЛС по эхокардиографии и NT-proBNP у больных с непередним ИМ с мультисосудистым поражением КА
Dynamics of LVEF and INLS data by echocardiography and NT-proBNP in patients with non-anterior myocardial infarction with multivessel injury coronary artery
Показатель | 1-е сутки ОИМ | р | Через 12 месяцев после ОИМ | ||
больные СД | больные без СД |
| больные СД | больные без СД | |
ФВ ЛЖ % | 43 [41–51] | 48 [42–51] | р1 = 0,4552 р2 = 0,6192 р3 = 0,0426* р4 = 0,0086* | 55 [51–58] | 56 [44–63] |
NT-proBNP пг/мл | 819 [538–997] | 678 [437–920] | р1 = 0,6074 р2 = 0,8593 р3 = 0,0015* р4 = 0,0001* | 203 [145–511] | 269 [112–692] |
ИНЛС | 1,31 [1,19–1,81] | 1,38 [1,31–1,69] | р1 = 0,7488 р2 = 0,8998 р3 = 0,0066* р4 = 0,0070* | 1,27 [1,13–1,62] | 1,24 [1,13–1,31] |
Примечание: ФВ ЛЖ – фракция выброса левого желудочка; ИНЛС – индекс нарушения локальной сократимости; р1 – разница после реваскуляризации в 1-е сутки ОИМ между больными СД и без СД; р2 – разница после реваскуляризации КА спустя 12 месяцев после ОИМ между больными СД и без СД; р3 – разница у больных СД между ЧКВ в 1-е сутки ОИМ и через 12 месяцев после ЧКВ; р4 – разница у больных без СД между ЧКВ в 1-е сутки ОИМ и через 12 месяцев после ЧКВ; * – достоверная разница, р < 0,05.
Через 12 месяцев у больных СД с непередним ИМ с мультисосудистым поражением КА ФВ ЛЖ достигала 51–58 % (в среднем 55 %) и была достоверно выше, чем у поступивших в 1-е сутки (р3 = 0,0426). У больных без СД ФВ ЛЖ через 12 месяцев достигала 56 % (44–63 %) и была достоверно выше, чем в группе больных СД. Отмечена положительная динамика ФВ ЛЖ у больных без СД (р4 = 0,0086, статистически значимо). Значение уровня NT-proBNP у больных СД достигало 203 нг/мл (145–511 нг/мл), достоверно снижалось по сравнению с 1-ми сутками ОИМ (р3 = 0,0015). В группе пациентов без СД уровень NT-proBNP оказался примерно одинаковым (р4 = 0,0001). Через 12 месяцев ИНЛС в обеих группах был примерно одинаковым (у больных СД – 1,27, против больных без СД – 1,24; р2 = 0,8998). Через 12 месяцев ИНЛС у больных СД и без СД оказался статистически значимо низким, чем в 1-е сутки ОИМ (р3 = 0,0066; р4 = 0,0070) (табл. 8).
Динамика NT-proBNP
У 7 больных СД с ОИМ наблюдалось поражение ЛКА и ОА. Значение NT-proBNP в 1-е сутки у больных СД с поражением ЛКА и ОА достигало 1504 пг/мл (от 830 до 2770 пг/мл). У 6 больных без СД с ОИМ наблюдалось поражение ЛКА и ОА. Значение NT-proBNP в 1-е сутки у больных СД с поражением ЛКА и ПКА достигало 659 пг/мл (от 139 до 802 пг/мл). NT-proBNP в 1-е сутки ОИМ у больных СД не имело статистически значимой разницы по сравнению с пациентами без СД.
У 10 больных СД и у 16 больных без СД наблюдалось поражение ЛКА и ПКА. Значение NT-proBNP в 1-е сутки у больных СД с поражением ЛКА и ПКА достигало 766 пг/мл (от 476 до 1731 пг/мл). Значение NT-proBNP в 1-е сутки у пациентов без СД с поражением ЛКА и ПКА достигало 671 пг/мл (от 544 до 1185 пг/мл). NT-proBNP в 1-е сутки ОИМ у больных СД не имеет статистически значимой разницы по сравнению с больными без СД.
У 7 больных СД с ОИМ наблюдалось поражение ПКА и ОА, значение NT-proBNP в 1-е сутки достигало 635 пг/мл (от 516 до 1213 пг/мл). У 4 больных без СД наблюдалось поражение ПКА и ОА, значение NT-proBNP в 1-е сутки достигало 812 пг/мл (от 294 до 1392 пг/мл). NT-proBNP в 1-е сутки ОИМ у больных СД не имело статистически значимой разницы по сравнению с больными без СД (табл. 9).
Таблица 9
Table 9
Динамика данных NT-proBNP у больных с ИМ с поражением двух коронарных артерий
Dynamics of NT-proBNP data in patients with myocardial infarction with lesions of two coronary arteries
Показатель | NT-proBNP в 1-е сутки ИМ, пг/мл | NT-proBNP через 12 месяцев, пг/мл | ||
ЛКА и ОА | больные СД n = 7 | больные без СД n = 6 | больные СД n = 7 | больные без СД n = 6 |
1504*+ (830–2770) | 659* (139–802) | 865+ (134–1204) | 331 (89–509) | |
ЛКА и ПКА | больные СД n = 10 | больные без СД n = 16 | больные СД n = 10 | больные без СД n = 16 |
766+ (476–1731) | 671 (544–1185) | 247+ (145–315) | 320 (151–537) | |
ПКА и ОА | больные СД n = 7 | больные без СД n = 4 | больные СД n = 7 | больные без СД n = 4 |
635+ (516–1213) | 812 (294–1392) | 243+ (192–632) | 513 (125–882) | |
р | р1 = 0,0540 | р2 = 0,0442 | р1 = 0,0715 | р2 = 0,0325 |
Примечание: ИМ – инфаркт миокарда; СД – сахарный диабет; ЛКА – левая коронарная артерия; ОА – огибающая артерия левой коронарной артерии; ПКА – правая коронарная артерия; p1 – статистическое значение между группами ЛКА и ОА, ПКА и ОА, ЛКА и ПКА у больных СД с ОИМ; р2 – статистическое значение между группами ЛКА и ОА, ПКА и ОА, ЛКА и ПКА у больных с ОИМ без СД; * – статистическое значение между группами больных СД и без СД; + – статистическое значение между 1-ми сутками и через 12 месяцев у больных с ОИМ.
Через 12 месяцев значение сыворотки NT-proBNP у больных СД с поражением ЛКА и ОА снизилось и достигало 865 пг/мл (от 134 до 1204 пг/мл), что значительно ниже, чем у пациентов с ОИМ в 1-е сутки (865 пг/мл против 1504 пг/мл; р = 0,0180). Через 12 месяцев значение сыворотки NT-proBNP у больных без СД с поражением ЛКА и ОА было равно 320 пг/мл (от 151 до 537 пг/мл), что не имеет статистически значимой разницы по сравнению с больными в 1-е сутки ОИМ (320 пг/мл против 659 пг/мл; р = 0,0747).
Через 12 месяцев значение сыворотки NT-proBNP у больных СД с поражением ЛКА и ПКА снизилось и достигало 247 пг/мл (от 145 до 315 пг/мл), что значительно ниже, чем в 1-е сутки ОИМ (247 пг/мл против 766 пг/мл, р = 0,0051). Через 12 месяцев значение сыворотки NT-proBNP у больных без СД с поражением ЛКА и ОА было равно 202 пг/мл (от 107 до 428 пг/мл), что достоверно ниже, чем в 1-е сутки ОИМ (651 пг/мл против 202 пг/мл, р = 0,0004).
Через 12 месяцев значение сыворотки NT-proBNP у больных СД с поражением ПКА и ОА снизилось и достигало 243 пг/мл (от 192 до 632 пг/мл), что значительно ниже, чем в 1-е сутки ОИМ (243 пг/мл против 635 пг/мл, р = 0,0180). У больных без СД с поражением ПКА и ОА значение сыворотки NT-proBNP снизилось и было равно 513 пг/мл (от 125 до 882 пг/мл), что не имеет статистически значимой разницы по сравнению со значением NT-proBNP в 1-е сутки ОИМ (513 пг/мл против 812 пг/мл, р = 0,0679).
Динамика ФВ ЛЖ по разным тактикам реваскуляризации КА
Мультисосудистое поражение КА имело место у 43 больных СД, из них 22 – с передним ОИМ, 21 – с непередним ОИМ. Полная одномоментная реваскуляризация миокарда была проведена у 11 из 22 больных с передним ОИМ и у 1 из 21 больного с непередним ОИМ. Через 12 месяцев наблюдения ФВ снизилась у 18 больных СД с однососудистым поражением ОИМ и у 18 – с мультисосудистым поражением ОИМ. Через 12 месяцев наблюдения ФВ у больных без СД с ОИМ с мультисосудистым поражением КА после ЧКВ полной одномоментной реваскуляризацией была повышена по сравнению с ФВ в 1-е сутки ОИМ (52 % против 51 %, р = 0,0145).
У больных СД с ОИМ с мультисосудистым поражением КА после ЧКВ полной одномоментной реваскуляризацией через 12 месяцев ФВ по ЭхоКГ не имела статистически значимой разницы по сравнению с ФВ в 1-е сутки ОИМ (46 % против 44 %, р = 0,9686). Через 12 месяцев наблюдения ФВ у больных без СД с ОИМ с мультисосудистым поражением КА после ЧКВ неполной одномоментной реваскуляризацией значимо выше, чем ФВ в 1-е сутки ОИМ (54 % против 49 %, р = 0,0001).
У больных СД с ОИМ с мультисосудистым поражением КА после ЧКВ полной одномоментной реваскуляризацией через 12 месяцев наблюдения ФВ по ЭхоКГ не имела статистически значимой разницы по сравнению с ФВ в 1-е сутки ОИМ (58 % против 44 %, р = 0,1335).
Обсуждение
В основе формирования дисфункции ЛЖ и хронической сердечной недостаточности (ХСН) у больных СД лежат процессы, связанные со структурными изменениями кардиомиоцитов на фоне хронической гипоперфузии, повышения диастолической жесткости и нарушения активной релаксации миокарда, реактивных изменений опорно-трофического остова, [Wu et al., 2020] уменьшения диастолического наполнения и ремоделирования с сегментарными нарушениями структуры сердца [Ван и др., 2020].
Установлено, что в отдаленном периоде у 10 больных СД с передним ИМ с мультисосудистым поражением КА ФВ ЛЖ менее 46 %, что ниже, чем у больных без СД. Частота ФВ ≤45 % в отдаленном периоде у больных СД с передним ИМ с мультисосудистым поражением КА была в 2 раза чаще, чем у больных без СД, а при непереднем ИМ с мультисосудистым поражением КА – в 2 раза чаще у больных без СД, чем у больных СД (6 больных против 3).
Неблагоприятный прогноз у больных СД связан с тем, что патологические изменения в мелких сосудах у них начинаются чаще и раньше, чем у больных с нормальным метаболизмом глюкозы [Walter et al., 2018; Ван и др., 2020]. Накопление конечных продуктов гликирования приводит к снижению выработки и метаболизма активных форм кислорода и оксида азота и воспалению эндотелия микрососудов, а также усугубляет замещающий фиброз. Вышеперечисленные изменения приводят к снижению активности кардиомиоцитов, гипертрофии миокарда, что тесно связано с возникновением аритмий и ремоделированием сердца [Qiankun et al., 2020]. Стоит отметить, что гипергликемия повышает активность протеинкиназы C в фибробластах, тем самым увеличивая выработку и отложение коллагена. Из-за существования альтернативного фиброза увеличение отложения коллагена [Walter et al., 2018; Qiankun et al., 2020] особенно выражено у пациентов с СД с низкой ФВ ЛЖ.
Спустя 12 месяцев после ЧКВ связь между ФВ ЛЖ и поражением Прокс. сегм. ЛКА (OШ = 10,75 [95 % ДИ 1,02 – 113,02], p = 0,048), а также 1-Марг. ОА (OШ = 49,32 [95 % ДИ 1,53–1587,04], p = 0,028) оставалась стабильно достоверной в значительной степени в модели многомерного анализа мультисосудистого поражения КА. Связь между ФВ ЛЖ и поражением Дист. сегм. ЛКА (OШ = 0,27 [95 % ДИ 0,01 – 0,08], p = 0,037) спустя 12 месяцев после ЧКВ была стабильно достоверной в значительной степени в многомерном анализе (табл. 10).
Таблица 10
Table 10
Статистические значения отдельных сегментов КА после ЧКВ полной одномоментной реваскуляризацией КА в 1-е сутки ОИМ при благоприятном прогнозе через 12 месяцев у больных СД с мультисосудистым поражением. Многомерная модель логистической регрессии, n = 31, р = 0,0415
Statistical values of individual CA segments after PCI by complete single-stage revascularization of the CA at 1th day of ACS with a favorable prognosis after 12 months in DM patients with multivessel lesions. Multivariate logistic regression model, n = 31, р = 0,0415
Показатель | OШ | p | 95 % ДИ | |
Прокс. сегм. ЛКА | 10,75 | 0,048* | 1,02 | 113,02 |
Дист. сегм. ЛКА | 0,27 | 0,037* | 0,01 | 0,80 |
1-Диаг. ЛКА | 1,39 | 0,743 | 0,19 | 10,45 |
Прокс. сегм. ОА | 0,08 | 0,091 | 0,01 | 1,49 |
Дист. сегм. ОА | 0,02 | 0,127 | 0,01 | 2,98 |
1-Марг. ОА | 49,32 | 0,028* | 1,53 | 1587,04 |
Прокс. сегм. ПКА | 0,79 | 0,793 | 0,14 | 4,34 |
Примечание: КА – коронарная артерия; ЧКВ – чрескожное коронарное вмешательство; СД – сахарный диабет; ЛКА – левая коронарная артерия; ОА – огибающая артерия левой коронарной артерии; ПКА – правая коронарная артерия; прок. – проксимальный сегмент; сред. – средний сегмент; дист. – дистальный сегмент; 1СА – первая септальная артерия левой коронарной артерии; 1-Диаг. – первая диагональная артерия левой коронарной артерии; 1-Марг. – первая маргинальная ветвь огибающей артерии ЛКА; сегм. – сегмент. * р < 0,05.
Результаты данного исследования показывают, что реваскуляризации прокс. сегм. ЛКА и функциональной 1-марг. ОА обеспечивают максимальную выживаемость, но не улучшают прогноз через 12 месяцев. Поражения прокс. сегм. ЛКА и 1-марг. ОА при мультисосудистом поражении считают рисками неблагоприятного прогноза, так как ФВ ЛЖ снижается после ЧКВ через 12 месяцев.
Для пациентов с ОИМ, вызванным стенозом в проксимальной передней нисходящей ветви, необходимо принимать стратегию острой реваскуляризации, так как передняя нисходящая ветвь снабжает верхушки, 2/3 желудочковой перегородки и почти весь миокард передней стенки ЛЖ.
Результаты данного исследования свидетельствуют о том, что реваскуляризация сегментарного поражения левой дистальной КА в 1-е сутки после острого ИМ является независимым положительным корреляционным фактором улучшения прогноза [You et al., 2021; Jobs et al., 2017], поскольку ФВ ЛЖ увеличивается через 12 месяцев после ЧКВ.
Таким образом, выбор стратегии реваскуляризации коронарных поражений у пациентов с многососудистым ОИМ обусловлен необходимостью открыть все артерии со стенозом, равным или превышающим 75 %, особенно маргинальные функциональные артерии ОА [Wallentin et al., 2016]. При невозможности реваскуляризации всех коронарных артерий со стенозом, равным или более 75 %, необходимо выполнить реваскуляризацию инфаркт-связанной КА и дистальных сегментов левой КА.
Выводы
1. У больных СД ОИМ передней стенки с многососудистым поражением коронарных артерий встречается чаще, чем у пациентов без СД. При переднем ОИМ количество пораженных сегментов у больных СД больше, чем у пациентов без СД.
2. Стеноз проксимального сегмента ПКА чаще всего встречается у больных СД с ОИМ с мультисосудистым поражением. У больных СД с передним ОИМ с мультисосудистым поражением распространенность стеноза среднего сегмента ЛКА уступает только стенозу в проксимальном сегменте ПКА.
3. У пациентов с диабетом, перенесших острый передний ИМ, частота стеноза в среднем сегменте передней нисходящей ветви уступает только стенозу в проксимальном сегменте правой КА. Выбор стратегии реваскуляризации коронарных поражений у пациентов с многососудистым ОИМ обусловлен необходимостью открыть все артерии со стенозом, равным или превышающим 75 %, особенно маргинальные функциональные артерии ОА. При невозможности реваскуляризации всех коронарных артерий со стенозом, равным или более 75 %, необходимо выполнить реваскуляризацию инфаркт-связанной КА и дистальных сегментов левой КА.





Список литературы
Ван Ч., Асафьева Е.А., Макеева Т.И. 2020. Прогностическая значимость N-концевого прогормона мозгового натрийуретического пептида в долгосрочном ремоделировании левого желудочка у больных сахарным диабетом молодого и среднего возраста с острым коронарным синдромом после чрескожного коронарного вмешательства. Журнал им. Н.В. Склифосовского Неотложная медицинская помощь. 9 (4): 511–520.
Голухова Е.З., Мустафаева А.З. 2013. Влияние сахарного диабета II типа на диастолическую функцию миокарда левого желудочка у больных с ишемической болезнью сердца. Креативная кардиология. (2): 46–52.
Какорин С.В., Круглый Л.Б., Мкртумян А.М. 2013. Клиникоморфологические особенности, прогноз и тактика лечения острого коронарного синдрома у больных сахарным диабетом 2 типа. Сахарный диабет. 16 (2): 36–42.
Марданов Б.У., Мамедов М. Н., Корнеева М.Н., Оганов Р.Г. 2015. Особенности госпитального течения инфаркта миокарда у больных с нарушениями углеводного обмена. Рациональная Фармакотерапия в Кардиологии. 11 (5): 477–482.
Мареев В.Ю., Фомин И.В., Агеев Ф.Т., Беграмбекова Ю.Л., Васюк Ю.А., Гарганеева А.А., Гендлин Г.Е., Глезер М.Г., Готье С.В., Довженко Т.В., Кобалава Ж.Д., Козиолова Н.А., Коротеев А.В., Мареев Ю.В., Овчинников А.Г., Перепеч Н.Б., Тарловская Е.И., Чесникова А.И., Шевченко А.О., Арутюнов Г.П., Беленков Ю.Н., Галявич А.С., Гиляревский С.Р., Драпкина О.М., Дупляков Д.В., Лопатин Ю.М., Ситникова М.Ю., Скибицкий В.В., Шляхто Е.В. 2018. Клинические рекомендации ОССНРКО РНОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология. 58 (S6): 8–164.
Никитина Е.А., Мелетев И.С., Соловьев О.В., Чичерина Е.Н. 2020. Прогнозирование риска неблагоприятных сердечнососудистых событий в отдаленном периоде после эпизода острого коронарного синдрома на фоне сахарного диабета 2 типа. Кардиоваскулярная терапия и профилактика. 19 (3): 2357.
Ташкенбаева Э.Н., Хасанжанова Ф.О., Шарапова Ю.Ш. 2019. Особенности показателей систолической функции левого желудочка в зависимости от способа лечения в остром периоде инфаркта миокарда. Российский национальный конгресс кардиологов, (Екатеринбург, 24–26 сентября 2019 г.) Екатеринбург; 2019. с. 349.
Шестакова М.В., Шамхалова М.Ш., Клефортова И.И., Зайцева Н.В., Мартынов С.А., Шамаева Е.Н. 2011. Сахарный диабет и хроническая болезнь почек. В кн.: Дедов И.И., Шестакова М.В. (ред.) Сахарный диабет: острые и хронические осложнения. Москва: Медицинское информационное агентство; Гл. 9. с. 140–199.
Arnett D.R., Blumenthal R.S., Albert M.A., Michos E.D., Buroker A.B., Michael E., Miedema D., Goldberger Z.D., Muñoz D., Hahn E.J., Smith S.C., Himmelfarb C.D., Virani S.S., Khera A., Willia K.A., Lloyd-Jones D., Yeboah J., McEvoy J.W., Ziaeian B., Beckman J.A., Levine G.N., Al-Khatib S.M., Hlatky M.A., Birtcher K.K., Ikonomidis J., Cigarroa J.C., Joglar J.A., Deswal A., Mauri L., Fleisher L.A., Piano M.R., Gentile F., Riegel B., Goldberger Z.D., Wijeysundera D.N. 2019. ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease. Circulation. 140 (11): e596e646.
Feldmann K.J., Goldstein J.A., Marinescu V., Simon R.D., Gilbert L.R. 2018. Disparate impact of ischemic injury on regional wall dysfunction in acute anterior vs inferior myocardial infarction, Cardiovascular Revascularization Medicine. 20 (11): 965–972.
Franz-Josef N., Miguel S., Anders A., Fernando A., Adrian P.B., Umberto B., Robert A.B., Jean- Philippe C., Volkmar F., Stuart J.H., Peter J., Adnan K., Akos K., Steen D.K., Josef N., Dimitrios J.R., Petar M.S., Dirk S., Giulio G.S., Stephan W., Rashmi Y., Michael O.Z., ESC Scientific Document Group. 2019. 2018 ESC/EACTS Guidelines on myocardial revascularization European Heart Journal. 40: 87–165.
Hendriks T., Minke H.T., Hartman M., Pieter J.J., Niek H.J., Yldau M.Y., Chris P.H., Dirk J.V., Iwan C.C., Erik L., Nijveldt R., 2017. Predictors of left ventricular remodeling after STelevation myocardial infarction. Int. J. Cardiovasc Imaging. 33: 1415–1423.
Jean-Philippe C., Holger T., Emanuele B., Olivier B., Johann Bauersachs D.L., Paul D., Maria D., Thor E., Thierry F., Chris P.G., Martine G., Alexander J., Peter J., Ekaterini L., Basil S.L., Julinda M., Emanuele M., Béla M., Christian M., Marco R., Frans H.R., Dirk S., George C.M., ESC Scientific Document Group. 2021. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. European Heart Journal. 42: 1289–1367.
Jobs A., Mehta S.R., Montalescot G., Vicaut E., Van’t Hof A.W.J., Badings E.A., Neumann F.J., Kastrati A., Sciahbasi A., Reuter P.G., Lapostolle F., Milosevic A., Stankovic G., Milasinovic D., Vonthein R., Desch S., Thiele H. 2017. Optimal timing of an invasive strategy in patients with non-ST-elevation acute coronary syndrome: a meta-analysis of randomised trials. Lancet. 390: 737–746.
Ma M., Diao K., Yang Zh., Zhu Y., Guo Y., Yang M., Zhang Y., He Y. 2018. Clinical associations of microvascular obstruction and intramyocardial hemorrhage on cardiovascular magnetic resonance in patients with acute ST segment elevation myocardial infarction (STEMI). Medicine 97 (30): 1–9.
Qiankun Bao, Bangying Zhang, Ya Suo, Chen Liu, Qian Yang, Kai Zhang, Ming Yuan, Meng Yuan, Yue Zhang, Guangping Li. 2020. Intermittent hypoxia mediated by TSP1 dependent on STAT3 induces cardiac fibroblast activation and cardiac fibrosis. Human Biology and Medicine. 9: e49923.
Wallentin L., Lindhagen L., Arnstrom E., Husted S., Janzon M., Johnsen S.P., Kontny F., Kempf T., Levin L.A., Lindahl B., Stridsberg M., Stahle E., Venge P., Wollert K..C, Swahn E., Lagerqvist B., FRISC-II study group. 2016. Early invasive versus non-invasive treatment in patients with non-ST-elevation acute coronary syndrome (FRISC- II): 15 year follow-up of a prospective, randomised, multicentre study. Lancet. 388: 1903–1911.
Walter J.P., Elisa D.C. 2018. Distinct Myocardial Targets for Diabetes Therapy in Heart Failure With Preserved or Reduced Ejection Fraction. Vol. 6, No. 1.
Watanabe Sh., Kenneth F., Jason C.K., Olympia B., Leonardson L., Koichi N., Jaume A., Navin K.K., Roger J.H., Kiyotake I., 2018. Left Ventricular Unloading Using an Impella CP Improves Coronary Flow and Infarct Zone Perfusion in Ischemic Heart Failure. Journal of the American Heart Association. 7: e006462.
Wu Lan, Huang Wen-Qing, Yu Cheng-Chao and Yan-Fei Li. 2020. Moderate Hydrogen Peroxide Postconditioning Ameliorates Ischemia/Reperfusion Injury in Cardiomyocytes via STAT3- Induced Calcium, ROS, and ATP Homeostasis. Pharmacology, undefined: 1–11.
Yildirim E., Ermis E., Allahverdiyev S., Ucar H., Cengiz M. 2019. Value of Syntax Score II in Prediction of New-Onset Atrial Fibrillation in Patients With NSTE-ACS Undergoing Percutaneous Coronary Intervention. Angiology. 70 (9): 860–866.
You J., Gao L., Shen Y., Guo W., Wang X., Wan Q., Wang X., Wu J., Zhang Q., 2021. Predictors and long-term prognosis of left ventricular aneurysm in patients with acute anterior myocardial infarction treated with primary percutaneous coronary intervention in the contemporary era. Journal of Thoracic Disease, 13 (3): 1706–1716.