Предикторы неблагоприятного прогноза инфаркта миокарда у молодых пациентов на амбулаторном этапе реабилитации
Aннотация
Цель исследования: выявить независимые факторы неблагоприятного прогноза у молодых пациентов, перенесших инфаркт миокарда, на амбулаторном этапе лечения. В исследование включено 108 пациентов в возрасте от 18 до 45 лет с подтвержденным диагнозом инфаркт миокарда с подъемом и без подъема сегмента ST. Наблюдение за пациентами осуществлялось в течение 12 месяцев после инфаркта миокарда. На амбулаторном этапе лечения исследовались лабораторно-инструментальные параметры, включающие общий и биохимический анализы крови, оценку показателей системы гемостаза, суточной экскреции альбумина с мочой, эхокардиографию и длительное мониторирование электрокардиограммы. Оценка распространенности традиционных факторов риска проводилась с использованием оригинальной анкеты. Приверженность к лечению оценивалась с помощью опросника Мориски – Грина с дополнениями. Статистическая обработка данных проводилась с использованием программы IBM SPSS Statistics v.23. Через 12 месяцев после инфаркта миокарда комбинированная конечная точка наступила у 24 % молодых пациентов. Летальность составила 3 %, повторный инфаркт миокарда развился в 4 % случаев, нестабильная стенокардия – в 7 %, потребность в плановой реваскуляризации составила 9 %. Независимыми прогностическими факторами в данной когорте признаны курение и низкая приверженность к приему статинов.
Введение
Ишемическая болезнь сердца (ИБС) остается ведущей причиной смерти от сердечно-сосудистых заболеваний (ССЗ) [Virani et al., 2020]. Инфаркт миокарда (ИМ) – одно из наиболее тяжелых проявлений ИБС. В последние годы на фоне роста распространенности факторов риска развития атеросклероза фиксируется увеличение числа случаев ИМ в молодом возрасте [Константинова и др., 2017; Arora et al., 2019; Wang et al., 2020]. Частота ИМ среди молодых в некоторых странах достигает 20 % [Shah et al., 2016]. Данная когорта составляет основной экономический потенциал любой страны, в связи с чем последствия ИМ в данной группе могут быть катастрофическими.
Случаи первичного ИМ среди молодого населения отражают распространенность факторов риска в популяции в целом, в то время как на развитие повторных сердечно-сосудистых катастроф в большей степени оказывает влияние качество проводимых мероприятий вторичной профилактики. Несмотря на прогресс в ведении таких пациентов частота повторных госпитализаций вследствие рецидива ИМ остается высокой и по разным данным составляет от 14 до 41,6 % [Haffner et al., 1998; Kangovi, Grande, 2011]. Развитие повторных ИМ сопровождается, как правило, более тяжелыми клиническими проявлениями и худшим прогнозом. Установлено, что такие пациенты реже получают оптимальное лечение [Cao et al., 2016; Myftiu et al., 2017]. Риск повторного ИМ наиболее высокий в течение первого года после индексного события, однако и в последующем он остается выше, чем в популяции в целом [Jernberg et al., 2015; Rapsomaniki et al., 2016]. Ряд исследований показал, что контроль над факторами риска способен улучшить долгосрочный прогноз у пациентов, перенесших ИМ [Piepoli et al., 2016; Maron et al., 2018].
В связи с вышеперечисленным поиск предикторов неблагоприятного прогноза в реабилитационном периоде ИМ с учетом возрастных особенностей представляется весьма актуальным и может существенно улучшить результаты проводимых мероприятий вторичной профилактики. Тем не менее большинство исследований, затрагивающих вопросы ИМ в молодом возрасте, фокусируются лишь на изучении острого периода. Работы, посвященные изучению особенностей факторов риска и их влиянию на прогноз на амбулаторно-поликлиническом этапе реабилитации у таких пациентов, единичны.
Цель исследования: выявить независимые факторы неблагоприятного прогноза у молодых пациентов, перенесших ИМ, на амбулаторном этапе лечения.
Объекты и методы исследования
В исследование последовательно включено 108 пациентов в возрасте от 18 до 45 лет с подтвержденным диагнозом ИМ с подъемом и без подъема сегмента ST, случившимся в период с 01.01.2017 г. по 01.01.2019 г. Все пациенты подписали добровольное информированное согласие на участие в исследовании. Критериями исключения из исследования явились острые и хронические заболевания в стадии обострения, тяжелая сопутствующая соматическая патология, сахарный диабет (СД) 1 типа, психические заболевания. Характеристика включенных в исследование пациентов представлена в табл. 1.
Таблица 1
Table 1
Характеристика молодых пациентов с инфарктом миокарда
Characteristics of young patients with myocardial infarction
Параметр | n = 108 |
Средний возраст, лет Me (Q1-Q3) | 41,0 (38,0–43,0) |
Мужчины, n (%) | 92/108 (85,2) |
Женщины, n (%) | 16/108 (14,2) |
Инфаркт миокарда с подъемом сегмента ST, n (%) | 91/108 (84,3) |
Инфаркт миокарда без подъема сегмента ST, n (%) | 17/108 (15,7) |
Догоспитальный тромболизис, n (%) | 17/99 (17,2) |
Чрескожное коронарное вмешательство, n (%) | 107/108 (99,1) |
Стентирование коронарных артерий, n (%) | 76/107 (71,0) |
Медикаментозное лечение пациентов на амбулаторном этапе представлено в табл. 2.
Таблица 2
Table 2
Медикаментозное лечение молодых пациентов с инфарктом миокарда на амбулаторном этапе
Treatment of young patients with myocardial infarction
Группа препаратов | n = 108 |
Ацетилсалициловая кислота, n (%) | 108/108 (100,0) |
Блокаторы P2Y12-рецепторов тромбоцитов, n (%) | 108/108 (100,0) |
Бета-адреноблокаторы, n (%) | 100/108 (96,2) |
Ингибиторы ангиотензинпревращающего фермента, n (%) | 68/108 (66,0) |
Антагонисты рецепторов ангиотензина II, n (%) | 13/108 (12,6) |
Статины, n (%) | 99/108 (95,2) |
Ингибиторы абсорбции холестерина, n (%) | 1/108 (0,9) |
Антагонисты минералокортикоидных рецепторов, n (%) | 21/108 (23,1) |
Все пациенты были подвергнуты трехэтапной реабилитации, включавшей
стационарный, ранний стационарный реабилитационный и амбулаторно-поликлинический реабилитационный этапы. Наблюдение продолжалось в течение
12 месяцев после ИМ.
На амбулаторном этапе лечения исследовались лабораторно-инструментальные параметры, включающие общий и биохимический анализы крови, оценку показателей системы гемостаза, суточной экскреции альбумина с мочой, эхокардиографию и длительное мониторирование электрокардиограммы (ЭКГ). Оценка распространенности традиционных факторов риска ССЗ проводилась с использованием оригинальной анкеты. Приверженность к лечению оценивалась с помощью опросника Мориски – Грина с дополнениями. Все исследования были проведены с соблюдением международных стандартов и биоэтических норм в соответствии с Хельсинкской декларацией Всемирной Медицинской Ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. Жизненный статус и исходы оценивались через 12 месяцев после ИМ. Комбинированная конечная точка включала сердечно-сосудистую смерть и/или развитие повторного ИМ, и/или нестабильной стенокардии, и/или плановой реваскуляризации в течение 12 месяцев
после ИМ.
Статистическая обработка данных проводилась с использованием программы IBM SPSS Statistics v.23. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Колмогорова – Смирнова,
а также показателей асимметрии и эксцесса. Количественные показатели, имеющие нормальное распределение, представлены средним арифметическим (M) и стандартным отклонением (SD), количественные показатели, распределение которых отличалось от нормального медианой (Me) и нижним и верхнем квартилями (Q1-Q3),
номинальные данные – абсолютными значениями и процентными долями. Факторы, влияющие на развитие комбинированной конечной точки, оценивались с помощью критерия χ2 Пирсона. При наличии статистической значимости фактор исследовали
с помощью однофакторного логистического регрессионного анализа. В качестве
количественной меры эффекта использовался показатель относительного риска (ОР)
с расчетом границ 95 % доверительного интервала (ДИ). За уровень достоверности принимали p ˂ 0,05.
Результаты и их обсуждение
Среди традиционных факторов риска у пациентов молодого возраста на амбулаторном этапе лечения наиболее широко распространены: курение (65,4 %), избыточная масса тела и ожирение (69,2 %), дислипидемия (58,9 %), артериальная гипертензия (АГ) (58,8 %), отягощенная по ранней ИБС наследственность (54,6 %) (табл. 3).
Таблица 3
Table 3
Факторы риска у молодых пациентов с инфарктом миокарда
Risk factors in young patients with myocardial infarction
Параметр | n = 108 |
Артериальная гипертензия, n (%) | 57/97 (58,8) |
Дислипидемия, n (%) | 43/73 (58,9) |
Гиперурикемия, n (%) | 2/28 (7,1) |
Нормальная масса тела, n (%) | 33/107 (30,8) |
Избыточная масса тела, n (%) | 48/107 (44,9) |
Ожирение I степени, n (%) | 16/107 (15,0) |
Ожирение II степени, n (%) | 8/107 (7,5) |
Ожирение III степени, n (%) | 2/107 (1,9) |
Отягощенная наследственность, n (%) | 53/97 (54,6) |
Низкий уровень физической активности, n (%) | 42/108 (38,9) |
Курение, n (%) | 68/104 (65,4) |
Сахарный диабет 2 типа, n (%) | 8/82 (9,8) |
Нарушение толерантности к глюкозе, n (%) | 7/82 (8,5) |
По данным биохимического анализа крови у молодых пациентов на фоне проведения реабилитационных мероприятий целевые значения общего холестерина и липопротеидов низкой плотности не достигнуты (ЛПНП). В 45,5 % случаев отмечалась высокая экскреция альбумина с мочой (табл. 4).
Таблица 4
Table 4
Биохимические показатели у молодых пациентов с инфарктом миокарда
Biochemical parameters in young patients with myocardial infarction
Параметр | n = 108 |
Глюкоза, ммоль/л (M ± SD) | 5,7 ± 0,4 |
Аланинаминотрансфераза, МЕ/л (M ± SD) | 27,0 ± 13,1 |
Аспартатаминотрансфераза, МЕ/л (M ± SD) | 26,7 ±10,2 |
Креатинин, мкмоль/л (M ± SD) | 94,6 ± 16,5 |
Скорость клубочковой фильтрации, мл/мин/1,73 м² Me (Q1-Q3) | 95,0 (81,0–103,0) |
Мочевая кислота, мкмоль/л Me (Q1-Q3) | 330,5 (298,0–372,9) |
Общий холестерин, ммоль/л (M ± SD) | 4,0 ± 1,2 |
Липопротеиды низкой плотности, ммоль/л (M ± SD) | 2,1 ± 0,8 |
Липопротеиды высокой плотности, ммоль/л Me (Q1-Q3) | 1,1 (1,0–1,3) |
Триглицериды, ммоль/л (M ± SD) | 1,8 ± 1,1 |
Высокая экскреция альбумина с мочой, n (%) | 10/22 (45,5) |
Показатели системы гемостаза у большинства пациентов находились в пределах нормальных значений (табл. 5).
Таблица 5
Table 5
Показатели системы гемостаза у молодых пациентов с инфарктом миокарда
Indicators of the hemostasis system in young patients with myocardial infarction
Параметр | n = 108 |
Активированное парциальное тромбопластиновое время, с (M ± SD) | 29,2 ± 3,9 |
Протромбиновое время, с (M ± SD) | 13,7 ± 0,9 |
Тромбиновое время, с (M ± SD) | 15,8 ± 1,5 |
Фибриноген, г/л (M ± SD) | 3,1 ± 0,6 |
Агрегация тромбоцитов с аденозиндифосфатом, с Me (Q1-Q3) | 10,2 (10,0–10,4) |
Агрегация тромбоцитов с ристомицином, % Me (Q1-Q3) | 67,0 (65,0–68,0) |
Хагеман-зависимый фибринолиз, мин Me (Q1 -Q3) | 10,0 (9,0–12,0) |
По данным эхокардиографии в 41,9 % случаев на амбулаторном этапе лечения у молодых пациентов сохранялись зоны локальной асинергии, у 16,3 % сформировалась хроническая аневризма сердца, у 18 % – систолическая дисфункция (табл. 6).
Таблица 6
Table 6
Эхокардиографические показатели у молодых пациентов с инфарктом миокарда
Echocardiographic parameters in young patients with myocardial infarction
Параметр | n = 108 |
Индекс конечно-диастолического объема, мл/м² Me (Q1-Q3) | 64,9 (56,4–92,9) |
Индекс конечно-систолического объема, мл/м² Me (Q1-Q3) | 23,6 (22,1–36,2) |
Диаметр левого предсердия, мм Me (Q1-Q3) | 37,0 (34,0–40,0) |
Диаметр правого желудочка, мм Me (Q1-Q3) | 26,0 (24,0–28,0) |
Индекс массы миокарда левого желудочка, г/м² (M ± SD) | 105,3 ± 22,7 |
Относительная толщина стенок Me (Q1-Q3) | 0,4 (0,4–0,5) |
Гипо-, акинезы, n (%) | 18/43 (41,9) |
Аневризма левого желудочка, n (%) | 7/43 (16,3) |
Фракция выброса левого желудочка, % Me (Q1-Q3) | 58,0 (52,0–62,0) |
Систолическая дисфункция, n (%) | 9/50 (18,0) |
Диастолическая дисфункция, n (%) | 28/47 (59,6) |
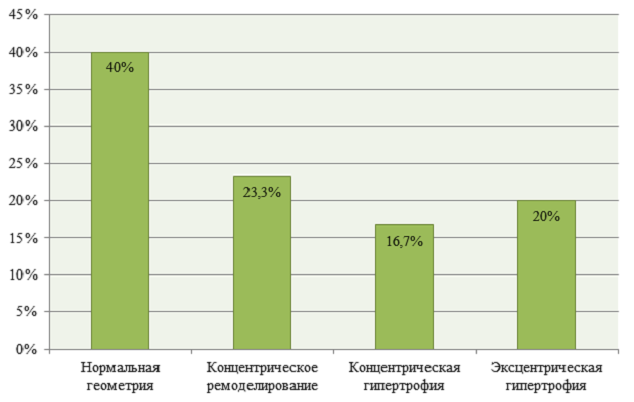
У каждого пятого пациента наблюдался дезадаптивный тип ремоделирования сердца – эксцентрическая гипертрофия левого желудочка (см. рисунок).
Рис. 1. Типы ремоделирования левого желудочка у молодых пациентов с инфарктом миокарда
Fig. 1. Types of left ventricular remodeling in young patients with myocardial infarction
По результатам длительного мониторирования ЭКГ в когорте молодых пациентов не достигались целевые значения частоты сердечных сокращений, у трети имелась частая желудочковая экстрасистолия с трансформацией у каждого десятого в пробежки желудочковой тахикардии. В 12,5 % случаев сохранялись эпизоды ишемической депрессии сегмента ST (табл. 7).
Таблица 7
Table 7
Показатели длительного мониторирования электрокардиограммы у молодых пациентов с инфарктом миокарда
Holter monitor parameters in young patients with myocardial infarction
Параметр | n = 108 |
Средняя частота сердечных сокращений, уд/мин (M ± SD) | 72,5 ± 6,7 |
Частая наджелудочковая экстрасистолия, n (%) | 2/34 (5,9) |
Частая желудочковая экстрасистолия, n (%) | 10/33 (30,3) |
Наджелудочковая тахикардия, n (%) | 1/22 (4,5) |
Желудочковая тахикардия, n (%) | 2/22 (9,1) |
Ишемическая депрессия сегмента ST, n (%) | 4/32 (12,5) |
В группе пациентов молодого возраста в целом наблюдалась высокая приверженность к приему рекомендованных лекарственных препаратов. Несколько ниже была приверженность к приему статинов – 82,8 % (табл. 8).
Таблица 8
Table 8
Приверженность молодых пациентов к лечению
Treatment adherence of young patients
Параметр | n = 108 |
Ацетилсалициловая кислота | 103/104 (99,0) |
Блокаторы P2Y12-рецепторов тромбоцитов | 88/96 (91,7) |
Бета-адреноблокаторы | 95/100 (95,0) |
Блокаторы ренин-ангиотензин-альдостероновой системы | 70/81 (86,4) |
Статины | 82/99 (82,8) |
Антагонисты минералокортикоидных рецепторов | 19/21 (90,5) |
Через 12 месяцев после ИМ комбинированная конечная точка наступила у 24 % молодых пациентов. Летальность составила 3 %, повторный ИМ развился в 4 % случаев, нестабильная стенокардия – в 7 %, потребность в плановой реваскуляризации составила 9 %.
С помощью критерия χ2 Пирсона были отобраны факторы, которые достоверно ассоциировались с достижением комбинированной конечной точки (табл. 9).
Таблица 9
Table 9
Факторы, ассоциированные с достижением комбинированной конечной точки
Factors associated with achieving the composite endpoint
Параметр | Комбинированная конечная точка (+), | Комбинированная конечная точка | р |
Курение, n (%) | 18/24 (75,0) | 42/76 (55,3) | 0,017 |
Высокая экскреция альбумина с мочой, n (%) | 6/8 (75,0) | 4/14 (28,6) | 0,035 |
Частая желудочковая экстрасистолия, n (%) | 7/13 (53,8) | 3/20 (15,0) | 0,018 |
Приверженность к приему статинов, n (%) | 13/23 (56,5) | 63/70 (90,0) | 0,000 |
Данные факторы в дальнейшем были исследованы с помощью логистической регрессии. Для них также был рассчитан ОР (табл. 10).
Таблица 10
Table 10
Факторы, ассоциированные с достижением комбинированной конечной точки по данным однофакторного регрессионного анализа
Factors associated with achieving the composite endpoint according to univariate regression analysis
Фактор | OR | 95 % ДИ | p |
Курение | 3,11 | 1,04–9,32 | 0,024 |
Высокая экскреция альбумина с мочой | 2,86 | 0,82–9,92 | 0,046 |
Частая желудочковая экстрасистолия | 1,84 | 1,00–3,41 | 0,024 |
Приверженность к приему статинов | 0,23 | 0,10–0,53 | 0,001 |
Таким образом, независимыми факторами, достоверно ассоциирующимися с достижением комбинированной конечной точки на амбулаторном этапе лечения у молодых пациентов, явились курение и низкая приверженность к приему статинов.
Прогноз пациентов с ИМ во многом зависит от контроля над факторами риска [Osteresch et al., 2019]. По результатам нашего исследования, у пациентов молодого возраста на амбулаторном этапе лечения, несмотря на проведение реабилитационных мероприятий, сохраняется целый ряд модифицируемых факторов риска, среди которых наиболее распространены курение (65,4 %), избыточная масса тела и ожирение (69,2 %), дислипидемия (58,9 %), АГ (58,8 %), отягощенная по ранней ИБС наследственность (54,6 %). Наши данные согласуются с данными других авторов. Так, среди наиболее распространенных факторов риска у молодых пациентов P. Trzeciak и соавт. отмечают курение, АГ и дислипидемию [Trzeciak et al., 2017]. Подобные данные представлены также в исследовании S.Yandrapalli и соавт., причем отмечается, что как минимум один фактор риска присутствовал у 90,3 % молодых пациентов [Yandrapalli et al., 2019]. Большинство авторов относят курение и дислипидемию к особенностям факторов риска ИМ именно в молодом возрасте [Singh et al., 2018]. По данным нашего исследования, у 45,5 % молодых пациентов отмечается высокая экскреция альбумина с мочой, которая является маркером раннего сосудистого старения, что косвенно подтверждает длительное воздействие факторов риска на данную когорту. В ряде работ установлена взаимосвязь высокой экскреции альбумина с мочой с такими факторами риска, как курение, АГ, СД 2 типа, дислипидемия и малоактивный образ жизни [Wang et al., 2013; Hao et al., 2015].
Через 12 месяцев после ИМ показатели сосудисто-тромбоцитарного и коагуляционного гемостаза, а также фибринолитической системы находились в пределах нормальных значений, что наиболее вероятно обусловлено оптимизацией функции эндотелия и нормализацией агрегации тромбоцитов вследствие высокой приверженности к приему антитромботической терапии и ингибиторов ренин-ангиотензин-альдостероновой системы.
По данным эхокардиографии, на амбулаторном этапе лечения, несмотря на проведенную реваскуляризацию, почти у половины молодых пациентов сохраняются зоны локальной асинергии, практически у каждого пятого сформировались хроническая аневризма сердца, систолическая дисфункция и дезадаптивный тип ремоделирования сердца. Данные структурно-функциональные изменения создают субстрат для формирования жизнеугрожающих желудочковых аритмий. В ряде работ продемонстрировано, что снижение фракции выброса, а также нарушение механики левого желудочка способствуют проявлению электрической нестабильности миокарда [Кузнецов и др., 2015; D'Elia et al., 2015]. По нашим данным, желудочковые нарушения ритма развились у трети пациентов, включенных в исследование.
Пациенты молодого возраста в течение первого года после ИМ имеют неблагоприятный прогноз: частота развития комбинированной конечной точки составила 24 %. У 3 % пациентов наступил летальный исход вследствие осложнений повторного ИМ, что сопоставимо с данными P. Trzeciak и соавт., в работе которых годичная летальность у молодых колебалась от 2,1 до 3,4 %. При этом частота повторного ИМ в данной когорте по результатам нашего исследования была несколько выше – 4 % против 1,3–3,9 % в работе польских авторов [Trzeciak et al., 2017].
Независимыми факторами неблагоприятного прогноза у молодых пациентов, находящихся на амбулаторном этапе лечения, признаны курение и низкая приверженность к приему статинов. По данным нашего исследования, курение в 3,11 раза повышало риск наступления неблагоприятного исхода. В работах отечественных авторов также была установлена взаимосвязь курения у пациентов молодого возраста с риском развития летального исхода после ИМ [Гарганеева и др., 2017]. Углекислый газ и никотин, содержащиеся в сигаретном дыме, вызывают гипоксию в тканях, что влечет за собой спазм коронарных сосудов и увеличение вязкости крови. Длительный «стаж» курения ведет к снижению способности к вазодилатации и повышению агрегации тромбоцитов [Lee et al., 2017]. Все вышеперечисленное способствует развитию и прогрессированию ИБС. По результатам нашего исследования, приверженность к приему статинов у молодых пациентов, достигших комбинированной конечной точки, была значительно ниже, чем у пациентов с благоприятным исходом. При этом в целом отмечалась хорошая переносимость данной группы препаратов: уровень трансаминаз находился в пределах референсных значений. Учитывая вклад статинов в снижение общей и сердечно-сосудистой смертности, они остаются краегульным камнем в лечении больных ИМ. Статины обладают плейотропным эффектом, не только снижая уровень липопротеидов низкой плотности, но и ограничивая процессы воспаления, оксидантного стресса в атеросклеротической бляшке, тем самым приводя к ее стабилизации [Oesterle et al., 2017]. Учитывая, что и курение, и низкая приверженность к приему статинов являются практически полностью модифицируемыми факторами риска, при разработке и реализации программ вторичной профилактики в когорте молодых пациентов следует уделять им особое внимание.
Заключение
Молодые пациенты, перенесшие ИМ, на фоне широкой распространенности на амбулаторном этапе лечения традиционных факторов риска и структурно-функциональных изменений сердечно-сосудистой системы имеют неблагоприятный прогноз. Наиболее часто в данной когорте пациентов встречаются курение (65,4 %), избыточная масса тела и ожирение (69,2 %), дислипидемия (58,9 %), АГ (58,8 %), отягощенная по ранней ИБС наследственность (54,6 %). На фоне проведения реабилитационных мероприятий молодые пациенты не достигают целевых значений ЛПНП. У половины пациентов отмечается высокая экскреция альбумина с мочой, маркирующая эндотелиальную дисфункцию и ранее сосудистое старение. У каждого пятого пациента наблюдается дезадаптивный тип ремоделирования сердца – эксцентрическая гипертрофия левого желудочка, сопровождающаяся систолической дисфункцией. У трети отмечается частая желудочковая экстрасистолия с трансформацией у каждого десятого в пробежки желудочковой тахикардии, в 12,5 % случаев сохраняются эпизоды ишемической депрессии ST. Повторные сердечно-сосудистые события у молодых пациентов, перенесших ИМ, в течение года развились в 24 % случаев. Летальность составила 3 %, повторный ИМ развился в 4 % случаев, нестабильная стенокардия – в 7 %, потребность в плановой реваскуляризации составила 9 %. Независимыми прогностическими факторами в данной когорте признаны курение и низкая приверженность к приему статинов.





Список литературы
Гарганеева А.А., Борель К.Н., Округин С.А., Кужелева Е.А. 2017. Предикторы летального исхода острого инфаркта миокарда у пациентов молодого возраста. Клиническая медицина, 95 (8): 713–718.
Константинова Е.В., Балаян Н.М., Шостак Н.А. 2017. Инфаркт миокарда у молодых: причины и прогноз заболевания. Клиницист, 11 (1): 10–15.
Кузнецов В.А., Тодосийчук В.В., Юркина Ю.А., Лыкасова Е.А., Нохрина О.Ю., Криночкин Д.В., Колунин Г.В., Горбатенко Е.А., Визнер Л.Р., Кутрунов В.Н., Дьячков С.М. 2015. Прогнозирование риска развития желудочковых аритмий высоких градаций у пациентов, направленных на коронарную ангиографию. Сибирский медицинский журнал, 30 (1): 105–111.
Arora S., Stouffer G.A., Kucharska-Newton A.M., Qamar A., Vaduganathan M., Pandey A., Porterfield D., Blankstein R., Rosamond W.D., Bhatt D.L., Caughey M.C. 2019. Twenty Year Trends and Sex Differences in Young Adults Hospitalized With Acute Myocardial Infarction. Circulation, 139 (8): 1047–1056.
Cao C.F., Li S.F., Chen H., Song J.X. 2016. Predictors and in-hospital prognosis of recurrent acute myocardial infarction. J. Geriatr. Cardiol., 13 (10): 836–839.
D'Elia N., D'hooge J., Marwick T.H. 2015. Association Between Myocardial Mechanics and Ischemic LV Remodeling. JACC Cardiovasc. Imaging, 8 (12): 1430–1443.
Haffner S.M., Lehto S., Rönnemaa T., Pyörälä K., Laakso M. 1998. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N. Engl. J. Med., 339 (4): 229–234.
Hao G., Wang Z., Zhang L., Chen Z., Wang X., Guo M., Tian Y., Shao L., Zhu M. 2015. Prevalence of microalbuminuria among middle-aged population of China: a multiple center cardiovascular epidemiological study. Angiology, 66 (1): 49–56.
Jernberg T., Hasvold P., Henriksson M., Hjelm H., Thuresson M., Janzon M. 2015. Cardiovascular risk in post-myocardial infarction patients: nationwide real world data demonstrate the importance of a long-term perspective. Eur. Heart J., 36 (19): 1163–1170.
Kangovi S., Grande D. 2011. Hospital readmissions – not just a measure of quality. JAMA, 306 (16): 1796–1797.
Lee W., Hwang S.H., Choi H., Kim H. 2017. The association between smoking or passive smoking and cardiovascular diseases using a Bayesian hierarchical model: based on the 2008–2013 Korea Community Health Survey. Epidemiol Health, e2017026.
Maron D.J., Mancini G.B.J., Hartigan P.M., Spertus J.A., Sedlis S.P., Kostuk W.J., Berman D.S., Teo K.K., Weintraub W.S., Boden W.E. COURAGE Trial Group. 2018. Healthy behavior, risk factor control, and survival in the COURAGE Trial. J. Am. Coll. Cardiol., 72 (19): 2297–2305.
Myftiu S., Sulo E., Burazeri G., Daka B., Sharka I., Shkoza A., Sulo G. 2017. Clinical Profile and Management of Patients with Incident and Recurrent Acute Myocardial Infarction in Albania – a Call for More Focus on Prevention Strategies. Zdr Varst., 56 (4): 236–243.
Oesterle A., Laufs U., Liao J.K. 2017. Pleiotropic effects of statins on the cardiovascular system. Circ. Res. 120 (1): 229–243.
Osteresch R., Fach A., Schmucker J., Eitel I., Langer H., Hambrecht R., Wienbergen H. 2019. Long-Term Risk Factor Control After Myocardial Infarction-A Need for Better Prevention Programmes. J. Clin. Med., 8 (8): 1114.
Piepoli M.F., Hoes A.W., Agewall S., Albus C., Brotons C., Catapano A.L., Cooney M.T., Corra U., Cosyns B., Deaton C., Graham I., Hall M.S., Hobbs F.D.R., Løchen M.L., Löllgen H., Marques-Vidal P., Perk J., Prescott E., Redon J., Richter D.J., Sattar N., Smulders Y., Tiberi M., van der Worp H.B., van Dis I., Verschuren W.M.M., Binno S. ESC Scientific Document Group. 2016. European Guidelines on cardiovascular disease prevention in clinical practice: The sixth joint task force of the european society of cardiology and other societies on cardiovasular disease prevention in clinical practice (constituted by representatives of 10 societies and by invited experts). Eur. Heart J., 37 (29): 2315–2381.
Rapsomaniki E., Thuresson M., Yang E., Blin P., Hunt P., Chung S.C., Stogiannis D., Pujades-Rodriguez M., Timmis A., Denaxas S.C., Danchin N., Stokes M., Thomas-Delecourt F., Emmas C., Hasvold P., Jennings E., Johansson S., Cohen D.J., Jernberg T., Moore N., Janzon M., Hemingway H. 2016. Using big data from health records from four countries to evaluate chronic disease outcomes: a study in 114 364 survivors of myocardial infarction. Eur. Heart J. Qual. Care Clin. Outcomes, 2 (3): 172–183.
Shah N., Kelly A.M., Cox N., Wong C., Soon K. 2016. Myocardial infarction in the «young»: Risk factors, presentation, management and prognosis. Heart. Lung. Circ., 25 (10): 955–960.
Singh A., Collins B.L., Gupta A., Fatima A., Qamar A., Biery D., Baez J., Cawley M., Klein J., Hainer J., Plutzky J., Cannon C.P., Nasir K., Di Carli M.F., Bhatt D.L., Blankstein R. 2018. Cardiovascular risk and statin eligibility of young adults after an MI: partners YOUNG-MI registry. J. Am. Coll. Cardiol., 71 (3): 292–302.
Trzeciak P., Gierlotka M., Polonski L., Gąsior M. 2017. Treatment and outcomes of patients under 40 years of age with acute myocardial infarction in Poland in 2009–2013: an analysis from the PL‑ACS registry. Pol. Arch. Intern. Med., 127 (10): 666–673.
Virani S.S., Alonso A., Benjamin E.J., Bittencourt M.S., Callaway C.W., Carson A.P., Chamberlain A.M., Chang A.R., Cheng S., Delling F.N., Djousse L., Elkind M.S.V., Ferguson J.F., Fornage M., Khan S.S., Kissela B.M., Knutson K.L., Kwan T.W., Lackland D.T., Lewis T.T., Lichtman J.H., Longenecker C.T., Loop M.S., Lutsey P.L., Martin S.S., Matsushita K., Moran A.E., Mussolino M.E., Perak A.M., Rosamond W.D., Roth G.A., Sampson U.K.A., Satou G.M., Schroeder E.B., Shah S.H., Shay C.M., Spartano N.L., Stokes A., Tirschwell D.L., VanWagner L.B., Tsao C.W. American heart association council on epidemiology and prevention statistics committee and stroke statistics subcommittee. 2020. Heart disease and stroke statistics – 2020 update: a report from the American Heart Association. Circulation, 141 (9): e139-e596.
Wang J., Li L., Ma N., Zhang X., Qiao Y., Fang G., Li G., Zhong T. 2020. Clinical investigation of acute myocardial infarction according to age subsets. Exp. Ther. Med., 20 (5): 120.
Wang Y., Yuan A., Yu C. 2013. Correlation between microalbuminuria and cardiovascular events. Int. J. Clin. Exp. Med., 6 (10): 973–978.
Yandrapalli S., Nabors C., Goyal A., Aronow W.S., Frishman W.H. 2019. Modifiable risk factors in young adults with first myocardial infarction. J. Am. Coll. Cardiol., 73 (5): 573–584.