Характеристика морфофункциональных параметров сердца и биомаркеров повреждения миокарда у пациентов различных возрастных групп на фоне терапии антрациклиновыми антибиотиками
Aннотация
Антрациклиновые антибиотики широко применяются в лечении онкологических заболеваний. Однако кардиотоксичность, обусловленная их применением, в значительной степени лимитирует их использование. Целью исследования была оценка изменений внутрисердечной гемодинамики, а также уровней тропонина I и N-терминального пропептида натрийуретического гормона (NT-proBNP) при достижении средних кумулятивных доз антрациклинов (250 мг/м2 по доксорубицину) у пациентов различных возрастных групп. В исследование были включены 155 пациентов, не имевших патологии сердечно-сосудистой системы в анамнезе, получавших антрациклины в составе различных схем полихимиотерапии по поводу онкогематологических заболеваний. Больные были разделены на две группы в зависимости от возраста – 1-ю группу составили 67 больных в возрасте от 21 до 44-х лет, 2-ю – 88 пациентов в возрасте от 45 до 74-х лет. Пациентам дважды выполнялась трансторакальная эхокардиография и определение уровней кардиальных биомаркеров (тропонин I и NT-proBNP). В результате исследования было выявлено, что применение антрациклинов в общей дозе 250 мг/м2 не оказывало влияния на структурные параметры сердца у обследуемых пациентов – достоверных различий между группами и в динамике отмечено не было (p > 0,05). Среди показателей, оцениваемых посредством импульсно-волновой допплерографии, как исходно, так и после достижения кумулятивной дозы доксорубицина 250 мг/м2 были выявлены статистически значимые различия у пациентов разных возрастных групп (p < 0,0001). В частности, межгрупповые различия значений E и E’ обусловлены естественными физиологическими процессами старения и проявляются нарушением диастолической податливости стенок ЛЖ вследствие возрастных изменений состава и структуры соединительнотканного матрикса. Терапия антрациклинами у всех обследованных больных приводила к значимому повышению сывороточных концентраций тропонина I и NT-proBNP, хотя достоверных межгрупповых различий выявлено не было
(p > 0,05).
Ключевые слова: химиотерапия, кардиотоксичность, антрациклиновая кардиомиопатия, эхокардиография, кардиальные биомаркеры
Введение
Антрациклиновые антибиотики представляют собой высокоэффективную группу противоопухолевых препаратов, имеют широкое применение в онкологической и онкологематологической практике [Pai, Nahata, 2000; Senkus, Jassem, 2011; Manrique et al., 2017]. Однако их токсические эффекты, в первую очередь обусловленные влиянием на сердечную мышцу, зачастую приводят к снижению качества и продолжительности жизни пациентов, в том числе излечившихся от онкологической патологии [Biasillo et al., 2017; McGowan et al., 2017].
Ввиду того, что манифестация кардиотоксических эффектов антрациклинов может наблюдаться даже через несколько лет после окончания противоопухолевого лечения, крайне важной задачей является возможность диагностики повреждения миокарда на этапе отсутствия выраженных клинических проявлений, появление которых, как правило, свидетельствует о вовлечении в патологический процесс достаточно большого количества кардиомиоцитов [Гендлин, Емелина, 2017; Raj et al., 2014].
Несмотря на проводимые многочисленные исследования, механизм повреждения миокарда при воздействии антрациклинов до сих пор достоверно неизвестен и, вероятнее всего, имеет многофакторную природу. К возможным механизмам антрациклиновых повреждений сердца на сегодняшний день относят развитие оксидативного стресса, повреждение ДНК кардиомиоцитов, ингибирование аутофагии, апоптоз с участием эндоплазматического ретикулума, нарушение экспрессии кардиальных генов, дисфункцию симпатоадреналовой системы, а также нарушение гомеостаза ионов кальция [Raj et al., 2014; Santos, Goldenberg, 2018; Michel, Rassaf, 2019].
Учитывая имеющиеся в литературе данные о существенном отличии показателей вариабельности сердечного ритма в разных возрастных группах, а также о снижении антиоксидантной защиты у лиц пожилого возраста, по результатам проведенных нами ранее исследований, было выявлено, что кардиотоксические эффекты антрациклинов, опосредованные вегетативной дисфункцией и активацией процессов перекисного окисления липидов, у пациентов различных возрастных групп проявляются также по-разному [Ватутин, Эль-Хатиб, 2021; Эль-Хатиб, Ватутин, 2021].
К настоящему времени установлено, что частота развития кардиотоксичности (КТ) четко коррелирует с их кумулятивной дозой. Так, при дозе более 550 мг/м2 по доксорубицину риск возникновения кардиальных осложнений достигает 60 %, а при суммарной дозе доксорубицина 250–400 мг/м2 – 10 %. При этом считается, что при дозе свыше 250 мг/м2 у пациентов уже имеются признаки кардиотоксичности, обусловленные гибелью кардиомиоцитов на фоне воздействия антрациклинов, однако ввиду отсутствия высокочувствительных и специфичных методов диагностики верифицировать повреждение миокарда на данном этапе не представляется возможным [Снеговой и др., 2015; Селиверстова, Евсина, 2016; Sawyer et al., 2010; McGowan et al., 2017]. Большинство исследований, посвященных диагностике КТ антрациклиновых антибиотиков, основаны на оценке систолической функции левого желудочка, в частности фракции выброса левого желудочка (ФВЛЖ) [Jiji et al., 2012; Neilan et al., 2012; Zamorano et al., 2016]. При этом нарушение систолической функции, как правило, выявляется уже при достижении высоких кумулятивных доз антрациклинов. Между тем характер изменений диастолической функции по-прежнему остается малоизученным.
Кроме визуализирующих методов исследования для раннего выявления кардиотоксических эффектов противоопухолевой терапии возможно исследование уровня сердечных биомаркеров, которые являются высокочувствительными и широко доступными методами тестирования на предмет повреждения миокарда. Несмотря на то, что теоретически определение уровней тропонина I и N-терминального пропептида натрийуретического гормона (NT-proBNP) могут быть сопоставлены с данными визуализации сердца для раннего выявления КТ, на сегодняшний день четко не определены сроки лабораторного обследования во время и после химиотерапии, верхняя граница нормы для конкретного лабораторного теста, а также дальнейшая тактика при выявлении аномальных результатов [De Luliis et al., 2016; Riddell, Lenihan, 2018].
В связи с этим целью нашего исследования явилась оценка изменений внутрисердечной гемодинамики, а также уровней тропонина I и NT-proBNP при достижении средних кумулятивных доз антрациклинов (250 мг/м2 по доксорубицину) у пациентов различных возрастных групп.
Объекты и методы исследования
Исследование проводилось на клинической базе кафедры внутренних болезней № 3 Донецкого национального медицинского университета имени М. Горького – Институте неотложной и восстановительной хирургии имени В.К. Гусака, г. Донецк. Исследование выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинской Декларации. Протокол исследования одобрен этическим комитетом при Донецком национальном медицинском университете имени М. Горького.
После подписания информированного добровольного согласия было обследовано 155 пациентов (88 мужчин и 67 женщин). Условиями включения в исследование были: возраст от 18 до 74 лет, установленный диагноз онкогематологического заболевания (острый миелоидный или лимфобластный лейкоз, лимфогранулематоз, неходжкинские лимфомы), по поводу которого планировалось проведение антрациклин-содержащих курсов химиотерапии. Не включали в исследование пациентов, имевших в анамнезе врожденные и приобретенные пороки сердца, стенокардию напряжения, перенесенный инфаркт миокарда, дилятационную, гипертрофическую и рестриктивную кардиомиопатию, гипертоническую болезнь, хроническую сердечную недостаточность, эндокринную патологию, алкогольную и/или наркотическую зависимость, ВИЧ-инфекцию, а также ожидаемую продолжительность жизни менее 6 месяцев.
Среди обследованных 48 пациентов (31 %) страдало острым миелобластным лейкозом, 14 – острым лимфобластным лейкозом (9 %), 19 – лимфогранулематозом (12 %), 74 – неходжкинскими лимфомами (48 %). Пациенты были разделены на две группы в зависимости от возраста – 1-ю группу составили 67 больных в возрасте от 21 до 44-х лет, 2-ю – 88 пациентов в возрасте от 45 до 74-х лет. Существенных различий по полу, площади поверхности тела и кумулятивной дозе антрациклинов между сравниваемыми группами не было (p > 0,05). Основные характеристики обследованных пациентов представлены в таблице 1.
Таблица 1
Table 1
Характеристика групп пациентов, включенных в исследование Me [Q1; Q3]
Characteristics of patient groups included in the study Me [Q1; Q3]
Параметр | Группа 1 | Группа 2 | p |
Возраст, лет | 34,0 [26,0; 39,0] | 60,5 [52,5; 67,0] | < 0,0001 |
Мужской пол, n (%) | 33 (49,2 %) | 50 (56,8 %) | 0,37 |
Площадь поверхности тела, м2 | 1,86 [1,80; 1,96] | 1,89 [1,82; 1,95] | 0,61 |
Средняя кумулятивная доза антрациклинов, мг/м2 | 409 [321,8; 477] | 419 [338; 481] | 0,61 |
Трансторакальную эхокардиографию (Эхо-КГ) проводили в B и М режимах с применением импульсного и тканевого импульсного допплера на аппарате «Aplio MX SSA-780 A» (Toshiba Medical Systems Corporation, Япония) с помощью датчика 2,5 МГц с углом секторального развертки 75°. Исследование выполнялось после небольшого отдыха (не менее 15–20 минут), при спокойном дыхании, в положении больного лежа на спине или на левом боку. Эхокардиографические измерения выполнялись в течение трех кардиальных циклов. Для последующего анализа использовались средние значения соответствующих показателей.
Концентрации тропонина I и NT-proBNP оценивали на анализаторе Chem Well 2910 (USA) иммуноферментным методом с использованием соответствующих наборов реагентов производства Вектор-Бест (Российская Федерация).
Обследование пациентов проводилось дважды: до начала антрациклин-содержащих курсов химиотерапии и после достижения кумулятивной дозы 250 мг/м2 по доксорубицину.
Обработку полученных данных путем применения стандартных статистических методов проводили с использованием программного обеспечения MedCalc 19.1.2 (MedCalc Software Ltd, Belgium). Для проверки распределения на нормальность применяли критерий Колмогорова – Смирнова, величины ассиметрии и эксцесса. Все полученные переменные не подчинялись нормальному закону распределения, в связи с чем указывалась медиана (Ме) и межквартильный размах [Q1; Q3]. Для сравнения количественных величин между двумя независимыми группами был использован U-тест Манна – Уитни с определением межмедианной разницы Ходжеса – Лемана и ее 95 % доверительный интервал (95 % CI). Для сравнения количественных величин, полученных до и после лечения, использовали критерий Уилкоксона. Статистически значимыми отличия считали при р < 0,05.
Результаты исследования и их обсуждение
Проведенными исследованиями установлено, что исходно между пациентами различных возрастных групп до проведения химиотерапии статистически значимых различий в структурных параметрах сердца, таких как конечный систолический объем (КСО), конечный диастолический объем (КДО), конечный систолический размер (КСР), конечный диастолический размер (КДР) по данным Эхо-КГ выявлено не было (p > 0,05) (табл. 2). В том числе рассчитанные показатели индекса массы миокарда ЛЖ (ИММЛЖ) и индекса объема левого предсердия (ИОЛП) также были сравнимы между группами (p > 0,05).
Таблица 2
Table 2
Показатели структурных параметров сердца по данным эхокардиографии у пациентов различных возрастных групп, получающих терапию антрациклинами Me [Q1; Q3]
Cardiac structural parameters according to echocardiography in different age groups patients, receiving anthracycline therapy Me [Q1; Q3]
Параметры | 18-44 лет (n = 67) | 45-74 лет (n = 88) | P | |
КДО/ППТ мл/м2 | до лечения | 59,71 [50,11; 67,67] | 56,88 [49,44; 64,26] | 0,08 |
после лечения | 59,07 [50,32; 67,09] | 57,89 [50,46; 63,01 ] | 0,19 | |
КСО/ППТ, мл/м2 | до лечения | 21,28 [18,51; 25,13] | 20,86 [19,42; 23,08] | 0,94 |
после лечения | 19,84 [16,81; 26,61] | 20,37 [18,13; 24,88] | 0,57 | |
КДР, см | до лечения | 4,78 [4,51; 4,99] | 4,82 [4,62; 5,06] | 0,23 |
после лечения | 4,74 [4,44; 5,03] | 4,87 [4,49; 5,09] | 0,29 | |
КСР, см | до лечения | 3,24 [2,96; 3,62] | 3,34 [3,12; 3,59] | 0,51 |
после лечения | 3,28 [3,04; 3,63 ] | 3,37 [3,11; 3,69] | 0,24 | |
ИММЛЖ, г/м2 | до лечения | 72,98 [66,86; 83,01] | 75,98 [68,74; 83,17] | 0,42 |
после лечения | 74,88 [67,29; 81,96] | 75,31 [68,86; 83,46] | 0,79 | |
ИОЛП, мл/м2 | до лечения | 21,56 [17,89; 23,94] | 21,89 [18,63; 25,89] | 0,51 |
после лечения | 21,69 [17,93; 24,61 ] | 21,86 [18,57; 26,13] | 0,55 | |
ФВЛЖ, % | до лечения | 64,71 [60,45; 67,38] | 62,41 [58,32; 66,18] | 0,06 |
после лечения | 63,57 [60,41; 68,36] | 62,39 [58,65; 66,89] | 0,21 | |
По данным повторного Эхо-КГ исследования, применение антрациклинов в общей дозе 250 мг/м2 не оказывало влияния на структурные параметры сердца у обследуемых пациентов – достоверных различий между группами и в динамике отмечено не было
(p > 0,05) (табл. 2). Также необходимо отметить, что в обеих группах ни в одном из случаев не отмечалось снижение ФВЛЖ более чем на 10 % от исходного значения либо ниже показателя 50 % за время наблюдения.
Среди показателей, оцениваемых посредством импульсно-волновой допплерографии, как исходно, так и после достижения кумулятивной дозы доксорубицина 250 мг/м2 были выявлены статистически значимые различия у пациентов разных возрастных групп (p < 0,0001) (табл. 3).
В частности, у лиц молодого возраста до лечения значение пика Е было достоверно (p < 0,0001) выше на 18,2 см/с (95 % CI: 12,4–23,1), после проведения химиотерапии – на 17,3 см/с (95 % CI: 11,4–23,4) (p < 0,0001). Соответственно, отношения Е/А также было достоверно (p < 0,0001) выше в первой группе на 0,28 усл. ед. (95 % CI: 0,17–0,37) – до химиотерапии и на 0,27 усл. ед. (95 % CI: 0,18–0,38) – после химиотерапии (p < 0,0001).
Таблица 3
Table 3
Основные показатели диастолической функции по данным эхокардиографии у пациентов различных возрастных групп, получающих терапию антрациклинами Me [Q1; Q3]
Main cardiac diastolic function parameters according to echocardiography in different age groups patients, receiving anthracycline therapy Me [Q1; Q3]
Параметры | 18–44 лет (n = 67) | 45–74 лет (n = 88) | P | |
Е, см/с | до лечения | 91,1 [78,36; 108,11] | 74,12 [62,11; 89,33] | < 0,0001 |
после лечения | 90,22 [77,14; 108,02] | 75,12 [62,11; 88,14] | < 0,0001 | |
А, см/с | до лечения | 0,74 [0,56; 0,93] | 0,75 [0,58; 1,01] | 0,52 |
после лечения | 0,73 [0,56; 0,95] | 0,78 [0,68; 0,94] | 0,37 | |
Е/А, усл. ед. | до лечения | 1,24 [0,99; 1,51] | 0,96 [0,78; 1,19] | < 0,0001 |
после лечения | 1,25 [1,00; 1,56] | 0,96 [0,79; 1,18] | < 0,0001 | |
E’ см/с | до лечения | 15,45 [12,36; 18,55] | 8,51 [6,67; 9,89] | < 0,0001 |
после лечения | 15,32 [12,19; 18,67] | 8,56 [6,71; 9,59] | < 0,0001 | |
E/E’ усл. ед. | до лечения | 5,97 [4,67; 7,57] | 8,83 [6,93; 11,09] | < 0,0001 |
после лечения | 5,85 [4,47; 7,52] | 8,93 [7,28; 11,45] | < 0,0001 | |
IVRT, мс | до лечения | 109,30 [95,89; 121,27] | 102,19 [89,81; 120,81] | 0,22 |
после лечения | 108,31 [92,98; 120,79] | 107,23 [98,61; 120,89] | 0,48 | |
DT, мс | до лечения | 176,78 [162,49; 192,49] | 190,32 [168,93; 207,42] | 0,12 |
после лечения | 185,33 [170,26; 199,87] | 187,43 [167,03; 205,83] | 0,59 | |
По данным тканевой допплерографии пик Е` в группе молодых лиц был также достоверно (p < 0,0001) выше на 7,13 см/с (95 % CI: 6,04–8,38) – до лечения, и на 7,19 см/с (95 % CI: 6,02–8,47) – после лечения (p < 0,0001). Как следствие, отношение E/E’ было значимо (p < 0,0001) ниже у молодых больных на 2,96 усл. ед. (95 % CI: 2,22–3,81) до химиотерапии и на 3,06 усл. ед. (95 % CI: 2,31–3,84) – после лечения (p < 0,0001). В то же время при анализе интервальных показателей диастолической функции ЛЖ (IVRT, DT) достоверных отличий между сравниваемыми группами выявлено не было (p > 0,05). При этом накопление кумулятивной дозы доксорубицина 250 мг/м2 не привело к появлению статистически значимых отличий (p > 0,05) показателей диастолической функции в динамике (табл. 3).
Исследование сывороточных концентраций тропонина I и NT-proBNP до проведения химиотерапии показало отсутствие достоверных (p > 0,05) различий между сравниваемыми группами (рис. 1, рис. 2).
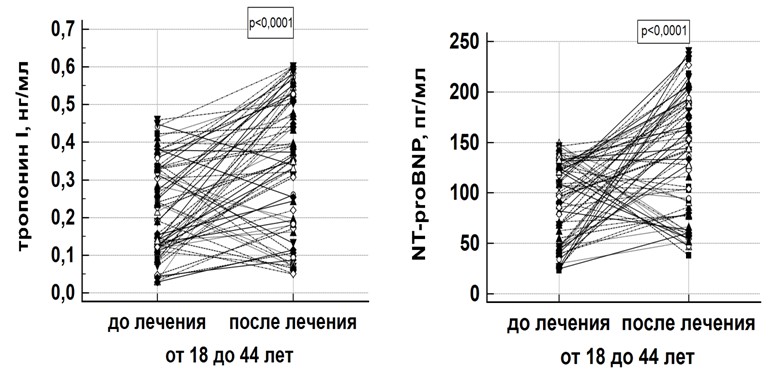
Рис. 1. Точечно-линейная диаграмма сравнения сывороточных концентраций тропонина I и NT-proBNP у пациентов молодого возраста до начала лечения и после достижения кумулятивной дозы доксорубицина 250 мг/м2
Fig. 1. Point-linear comparison diagram of serum troponin I and NT-proBNP concentrations in young patients group before treatment and after reaching cumulative doxorubicin dose of 250 mg/m2
При этом следует отметить, что частота встречаемости уровней тропонина I и NT-proBNP выше референтных пределов при первичном обследовании пациентов составила 32,8 % (22 пациента) и 61,1 % (41 пациент) случай соответственно в группе пациентов молодого возраста и 36,4 % (32 пациента) и 51,3 % (45 пациентов) случаев соответственно в группе пациентов старшего возраста. Достоверных отличий по частоте встречаемости случаев повышения тропонина I (p = 0,64) и NT-proBNP (p = 0,21) выше референтных пределов между сравниваемыми группами выявлено не было.
При исследовании показателей после достижения кумулятивной дозы 250 мг/м2 по доксорубицину в обеих группах было выявлено достоверное (p < 0,0001) увеличение концентраций тропонина I и NT-proBNP (рис. 1, рис. 2). В группе пациентов молодого возраста уровень тропонина I повысился (p < 0,0001) на 0,13 нг/мл (95 % CI: 0,08–0,17),
NT-proBNP – на 50,38 пг/мл (95 % CI: 31,06–70,08) (p < 0,0001). В группе пациентов старшего возраста сывороточная концентрация тропонина I достоверно (p = 0,0045) увеличилась на 0,07 нг/мл (95 % CI: 0,02–0,12), NT-proBNP – на 52,01 пг/мл (95 % CI: 36,45–67,07)
(p < 0,0001).
 Рис. 2. Точечно-линейная диаграмма сравнения сывороточных концентраций тропонина I и NT-proBNP у пациентов старшей возрастной группы до начала лечения и после достижения кумулятивной дозы доксорубицина 250 мг/м2
Рис. 2. Точечно-линейная диаграмма сравнения сывороточных концентраций тропонина I и NT-proBNP у пациентов старшей возрастной группы до начала лечения и после достижения кумулятивной дозы доксорубицина 250 мг/м2
Fig. 2. Point-linear comparison diagram of serum troponin I and NT-proBNP concentrations in old patients group before treatment and after reaching cumulative doxorubicin dose of 250 mg/m2
При анализе морфо-функциональных параметров сердца в динамике между группами пациентов разного возраста были выявлены достоверные различия (p < 0,05) в показателях, оцениваемых посредством импульсно-волновой и тканевой допплерографии. В частности, в группе пациентов молодого возраста показатели Е, Е’ и отношение Е/А были достоверно (p < 0,05) выше, соответственно, отношение E/E’ было значимо ниже у молодых больных (p < 0,001). При этом за время накопления кумулятивной дозы антрациклиновых антибиотиков 250 мг/м2 по доксорубицину в выбранной когорте пациентов не происходило значимых изменений структурных показателей и параметров диастолической функции. Также не было зарегистрировано случаев, которые можно идентифицировать как острую или подострую КТ.
Полученные нами данные подтверждаются результатами проведенных ранее многочисленных исследований, согласно которым малые кумулятивные дозы антрациклинов, менее 350–700 мг/м2, не оказывают существенного влияния на структурно-функциональные параметры сердца, в частности на ФВЛЖ, при условии выполнения эхокардиографического исследования в момент накопления кумулятивной дозы [Jiji et al., 2012; Huang et al., 2017; Song et al., 2017; Zhang et al., 2017]. На сегодняшний день установлено, что показатель деформации в продольном направлении – GLS, снижение которого более чем на 15 % от нормы является критерием развития КТ, обладает более высокой чувствительностью в отношении ранней диагностики антрациклиновой КТ, и его снижение регистрируются уже при достижении небольших кумулятивных доз антрациклинов [Senkus, Jassem, 2011; Huang et al., 2017].
Существует несколько причин более низкой чувствительности Эхо-КГ для диагностики КТ на фоне химиотерапии. Во-первых, снижение ФВЛЖ регистрируется в том случае, когда объем повреждения кардиомиоцитов уже достаточно велик и является причиной снижения компенсаторных механизмов сердца; во-вторых – погрешность измерения ФВЛЖ составляет в среднем, по данным различных авторов, 10 % [Zamorano et al., 2016; Huang et al., 2017; Negishi, Negishi, 2018].
Выявленные в нашем исследовании межгрупповые различия значений Е и Е’ обусловлены естественными физиологическими процессами старения и проявляются нарушением диастолической податливости стенок ЛЖ вследствие возрастных изменений состава и структуры соединительнотканного матрикса [Nagueh et al., 2016].
Также по итогу проведенного исследования установлено, что исходно между пациентами различных возрастных групп до проведения химиотерапии достоверных различий сывороточных концентраций тропонина I и NT-proBNP выявлено не было (p > 0,05). При этом в представленной когорте имелись случаи повышения уровня кардиальных биомаркеров выше референтных интервалов, при отсутствии клинических и инструментальных проявлений кардиальной дисфункции. Достоверных отличий по частоте встречаемости случаев повышения тропонина I и NT-proBNP выше референтных пределов между сравниваемыми группами не было (p > 0,05). Терапия антрациклинами у всех обследованных больных приводила к значимому (p < 0,05) повышению сывороточных концентраций тропонина I и NT-proBNP, хотя достоверных межгрупповых различий при этом выявлено не было.
Одним из подходов к диагностике ранней КТ является определение концентрации кардиальных биомаркеров, таких как тропонины и натрийуретические пептиды [Sandri et al., 2005; Riddell, Lenihan, 2018]. Однако на сегодняшний день не существует стандартизированной схемы оценки КТ с использованием определения их уровней, что обуславливает необходимость проведения дальнейших исследований, которые смогли бы позволить сформулировать четкие рекомендации по использованию кардиальных биомаркеров с целью оценки КТ при проведении химиотерапии [Zamorano et al., 2016]. При этом повышение кардиальных биомаркеров не всегда ассоциировано с наличием у пациента повреждения миокарда. Так, к настоящему моменту достоверно известно, что сердечные тропонины при использовании ультрачувствительных анализов определяются в крови всех здоровых людей и могут считаться продуктами нормального метаболизма миокарда [Romano et al., 2011; Christenson et al., 2015]. При этом механизмы высвобождения тропонинов в кровоток из миокарда здоровых людей пока достоверно неизвестны. Можно предположить, что высовобождение происходит при процессах регенерации кардиомиоцитов, повышения проницаемости клеточных мембран, незначительных некротических и апоптотических процессах при субклиническом течении воспалительных и ишемических заболеваний, а также при избыточных физических нагрузках и стрессах. Также следует учитывать, что концентрация сердечных тропонинов может быть обусловлена не только процессами их высвобождения из кардиомиоцитов, но и механизмами их элиминации из кровяного русла [Riddell, Lenihan, 2018].
Также установлено, что уровень кардиоспецифических тропонинов повышается при системном воспалении, при этом механизмы их повышения многообразны. В ряде случаев повышенные концентрации тропонинов не могут быть объяснены, несмотря даже на тщательное клиническое обследование. Такие случаи называются ложноположительными и чаще всего связаны со следующими причинами: гетерофильными антителами, ревматоидным фактором, щелочной фосфатазой, перекрестными реакциями с тропонинами скелетных мышц и др. [Pavo et al., 2015].
На уровень натрийуретических пептидов значимое влияние могут оказывать гендерные и возрастные факторы, наличие коморбидной патологии, к примеру, ожирения, почечной недостаточности, а также физические нагрузки, прием ряда препаратов и ложноположительные факторы интерференции [Sandri et al., 2005].
NT-proBNP является низкомолекулярным пептидом и, следовательно, способен проникать через гломерулярный фильтр в мочу. Было установлено, что нарушение гломерулярной фильтрации, характерное для хронической почечной недостаточности, сопровождается ростом сывороточного уровня натрийуретических пептидов [Sandri et al., 2005]. Прогрессирование почечной недостаточности приводит к значительному увеличению их концентрации в сыворотке крови [Cardinale et al., 2004]. Ложноположительное повышение может быть обусловлено появлением гетерофильных антител. Механизм интерференции связан с влиянием гетерофильных антител на иммунологическую реакцию между диагностическим антителом, направленным против натрийуретических пептидов, и искомым антигеном [Cardinale et al., 2004; Pavo et al., 2015].
Учитывая вышесказанное, выявленное нами исходное, до начала антрациклин-содержащей химиотерапии, повышение уровня сердечных биомаркеров выше референтных интервалов у части пациентов может быть объяснено наличием некоронарогенных причин, которые в нашем исследовании не были учтены.
Согласно ряду проведенных исследований, критической для выявления КТ считается кумулятивная доза доксорубицина 250 мг/м2 [Zamorano et al., 2016], в связи с чем повторное определение уровня сердечных биомаркеров проводилось после достижения вышеуказанной кумулятивной дозы. При данных дозах доксорубицина в обеих группах было выявлено достоверное (p < 0,005) увеличение концентраций тропонина I и NT-proBNP. Полученные нами результаты согласуются с данными литературы. Так, в исследовании Lu et al. у 149 женщин, страдающих раком молочной железы, было выявлено повышение уровня BNP после доксорубицин-содержащих курсов полихимиотерапии по сравнению с исходными данными (р < 0,001) [Конончук и др., 2013]. В исследовании A. Zidan et al. повышение уровня NT-proBNP выявлено у 24 из 80 пациентов, получающих терапию доксорубицином по поводу лимфомы Ходжкина, неходжкинских лимфом и ряда солидных опухолей. По данным мета-анализа 61 исследования, включившего в себя 5 691 пациентов, получающих терапию цитостатиками, обладающих кардиотоксичными побочными эффектами, было продемонстрировано повышение уровней BNP/NT-proBNP у 14,3 % пациентов [Romano et al., 2011].
Таким образом, проведенное нами исследование продемонстрировало отсутствие достоверных изменений структурно-функциональных параметров сердца у пациентов различных возрастных групп непосредственно в момент накопления малых кумулятивных дох антрациклинов, что, по-видимому, обусловлено недостаточной чувствительностью метода двухмерной эхокардиографии для диагностики ранней КТ антрациклинов. Также терапия антрациклинами приводит к достоверному повышению уровня кардиальных биомаркеров у всех обследованных больных, вне зависимости от возрастной категории.
Заключение
Согласно данным проведенного исследования, за время накопления кумулятивной дозы антрациклиновых антибиотиков 250 мг/м2 по доксорубицину в выбранной когорте пациентов статистически значимых изменений структурных показателей и параметров диастолической функции выявлено не было, что, вероятнее всего, обусловлено недостаточной чувствительностью метода двухмерной эхокардиографии для диагностики ранней КТ антрациклинов. Выявленные, как исходно, так и на фоне терапии антрациклинами, межгрупповые различия значений E и E’ обусловлены естественными физиологическими процессами старения и проявляются нарушением диастолической податливости стенок ЛЖ вследствие возрастных изменений состава и структуры соединительнотканного матрикса. В представленной когорте исходно, до проведения химиотерапии, имелись случаи повышения уровня кардиальных биомаркеров выше референтных интервалов при отсутствии клинических и инструментальных проявлений кардиальной дисфункции, при этом достоверных межгрупповых отличий по частоте встречаемости случаев повышения тропонина I и NT-proBNP выше референтных пределов между сравниваемыми группами не было. Выявленные случаи были обусловлены некоронарогенными причинами. Терапия антрациклиновыми антибиотиками у всех обследованных больных приводила к статистически значимому повышению сывороточных концентраций тропонина I и NT-proBNP, хотя достоверных межгрупповых различий при этом выявлено не было.





Список литературы
Ватутин Н.Т., Эль-Хатиб М.А. 2021. Особенности вариабельности сердечного ритма у пациентов различных возрастных групп, получающих терапию антрациклинами. Таврический медико-биологический вестник, 24 (1): 74–79.
Гендлин Г.Е., Емелина Е.И. 2017. Современный взгляд на кардиотоксичность химиотерапии онкологических заболеваний, включающей антрациклиновые антибиотики. Российский кардиологический журнал, 3: 143–154.
Конончук Н.Б., Митьковская Н.П., Абрамова Е.С., Шаповал Е.В., Конончук С.Н. 2013. Кардиотоксичность, индуцированная химиотерапией рака молочной железы: факторы риска, патогенез. Медицинский журнал (Минск), 45 (3): 4–7.
Селиверстова Д.В., Евсина О.В. 2016. Кардиотоксичность химиотерапии. Сердце: журнал для практикующих врачей, 15: 50–57.
Снеговой А.В., Виценя М.В., Копп М.В. 2015. Практические рекомендации по коррекции кардиоваскулярной токсичности, индуцированной химиотерапией и таргетными препаратами. Злокачественные опухоли, 4: 369–378.
Эль-Хатиб М.А., Ватутин Н.Т. 2021. Динамика показателей перекисного окисления липидов и антиоксидантной системы у пациентов различных возрастных групп, получающих терапию антрациклиновыми антибиотиками. Медико-социальные проблемы семьи, 26 (3): 71–77.
Biasillo G., Cipolla G., Cardinaleurr D. 2017. Cardio-oncology: gaps in knowledge, goals, advances, and educational efforts. Oncol Rep, 19 (8): 55.
Cardinale D., Sandri M.T., Colombo A., Colombo N., Boeri M., Lamantia G., Civelli M., Peccatori F., Martinelli G., Fiorentini C., Cipolla C.M. 2004. Prognostic value of troponin I in cardiac risk stratification of cancer patients undergoing high-dose chemotherapy. Circulation, 109 (22): 2749–54.
Christenson E.S., James T., Agrawal V., Park B.H. 2015. Use of biomarkers for the assessment of chemotherapy-induced cardiac toxicity. Clin Biochem., 48 (4–5): 223–35.
De Iuliis F., Salerno G., Taglieri L., De Biase L., Lanza R., Cardelli P., Scarpa S. 2016. Serum biomarkers evaluation to predict chemotherapy-induced cardiotoxicity in breast cancer patients. Tumour Biol., 37 (3): 3379–87.
Huang J., Yan Z.N., Rui Y.F., Shen D., Fan L., Chen D.L. 2017. Longitudinal rotation: a new way to detect the cardiotoxicity of anthracycline-based chemotherapy in breast cancer patients. Oncotarget, 8 (41): 70072–70083.
Jiji R.S., Kramer C.M., Salerno M. 2012 Non-invasive imaging and monitoring cardiotoxicity of cancer therapeutic drugs. J. Nucl. Cardiol., 19 (2): 377–88.
Manrique C.R., Park M., Tiwari N., Plana J.C., Garcia M.J. 2017. Diagnostic Strategies for Early Recognition of Cancer Therapeutics-Related Cardiac Dysfunction. Clin. Med. Insights. Cardiol., 11: 1–12.
McGowan J.V., Chung R., Maulik A., Piotrowska I., Walker J.M., Yellon D.M. 2017. Anthracycline Chemotherapy and Cardiotoxicity. Cardiovasc. Drugs. Ther., 31 (1): 63.
Michel L., Rassaf T. 2019. Cardio-oncology: need for novel structures. Eur. J. Med. Res., 24 (1): 1.
Nagueh S.F., Smiseth O.A., Appleton C.P., Byrd B.F. 3rd, Dokainish H., Edvardsen T., Flachskampf F.A., Gillebert T.C., Klein A.L., Lancellotti P., Marino P., Oh J.K., Popescu B.A., Waggoner A.D. 2016. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr., 29 (4): 277–314.
Negishi T., Negishi K. 2018. Echocardiographic evaluation of cardiac function after cancer chemotherapy. J. Echocardiogr., 16 (1): 20–27.
Neilan T.G., Coelho-Filho O.R., Pena-Herrera D., Shah R.V., Jerosch-Herold M., Francis S.A., Moslehi J., Kwong R.Y. 2012. Left ventricular mass in patients with a cardiomyopathy after treatment with anthracyclines. The American journal of cardiology, 110 (11): 1679–1686.
Pai V.B., Nahata M.C. 2000. Cardiotoxicity of chemotherapeutic agents: incidence, treatment and prevention. Drug. Saf., 22 (4): 263–302.
Pavo N., Raderer M., Hülsmann M., Neuhold S., Adlbrecht C., Strunk G., Goliasch G., Gisslinger H., Steger G.G., Hejna M., Köstler W., Zöchbauer-Müller S., Marosi C., Kornek G., Auerbach L., Schneider S., Parschalk B., Scheithauer W., Pirker R., Drach J., Zielinski C., Pacher R. 2015. Cardiovascular biomarkers in patients with cancer and their association with all-cause mortality. Heart, 101 (23): 1874–80.
Raj S., Franco V.I., Lipshultz S.E. 2014. Anthracycline-induced cardiotoxicity: a review of pathophysiology, diagnosis, and treatment. Curr. Treat. Options. Cardiovasc. Med.,16 (6): 315.
Riddell E., Lenihan D. 2018. The role of cardiac biomarkers in cardio-oncology. Curr. Probl. Cancer., 42 (4): 375–385.
Romano S., Fratini S., Ricevuto E., Procaccini V., Stifano G., Mancini M., Di Mauro M., Ficorella C., Penco M. 2011. Serial measurements of NT-proBNP are predictive of not-high-dose anthracycline cardiotoxicity in breast cancer patients. Br. J. Cancer., 105 (11): 1663–8.
Sandri M.T., Salvatici M., Cardinale D., Zorzino L., Passerini R., Lentati P., Leon M., Civelli M., Martinelli G., Cipolla C.M. 2005. N-terminal pro-B-type natriuretic peptide after high-dose chemotherapy: a marker predictive of cardiac dysfunction? Clin. Chem., 51 (8): 1405–10.
Santos D.S., Goldenberg R.C.S. 2018. Doxorubicin-induced cardiotoxicity: from mechanisms to development of efficient therapy (Chapter 1). Cardiotoxicity: Intech. Open. P. 3–24.
Sawyer D.B., Peng X., Chen B., Pentassuglia L., Lim C.C. 2010. Mechanisms of anthracycline cardiac injury: can we identify strategies for cardioprotection? Prog Cardiovasc Dis., 53 (2): 105–113.
Senkus E., Jassem J. 2011. Cardiovascular effects of systemic cancer treatment. Cancer Treat Rev., 37 (4): 300–11.
Song F.Y., Shi J., Guo Y., Zhang C.J., Xu Y.C., Zhang Q.L., Shu X.H., Cheng L.L. 2017. Assessment of biventricular systolic strain derived from the two-dimensional and three-dimensional speckle tracking echocardiography in lymphoma patients after anthracycline therapy. Int. J. Cardiovasc. Imaging, 33 (6): 857–868.
Zamorano J.L., Lancellotti P., Rodriguez Muñoz D., Aboyans V., Asteggiano R., Galderisi M., Habib G., Lenihan D.J., Lip G.Y.H., Lyon A.R., Lopez Fernandez T., Mohty D., Piepoli M.F., Tamargo J., Torbicki A., Suter T.M. 2016. ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur. Heart. J., 37 (36): 2768–2801.
Zhang C.J., Pei X.L., Song F.Y., Guo Y., Zhang Q.L., Shu X.H., Hsi D.H., Cheng L.L. 2017. Early anthracycline-induced cardiotoxicity monitored by echocardiographic Doppler parameters combined with serum hs-cTnT. Echocardiography, 34 (11): 1593–1600.