Особенности гуморального иммунного ответа на антигены оппортунистических микроорганизмов у больных системной красной волчанкой
Aннотация
В настоящее время уделяется большое внимание изучению роли оппортунистических микроорганизмов при системной красной волчанке, исследователей все больше интересуют различные стороны их потенциального влияния. Механизмы взаимодействия оппортунистических микроорганизмов с иммунной системой больного, способствующие развитию и поддержанию хронического воспаления и аутоиммунитета, требуют дальнейшего всестороннего исследования. Цель работы: изучение у больных СКВ особенностей гуморального иммунного ответа на антигены оппортунистических микроорганизмов. Проведено клинико-лабораторное обследование 26 больных СКВ и 30 условно здоровых лиц контрольной группы. В сыворотке крови обследуемых лиц проведено изучение уровня IgG антител к антигенам оппортунистических бактерий методом ИФА. Анализ наличия антител класса G к условно-патогенным бактериям в сыворотке крови больных системной красной волчанкой выявило более частое обнаружение антител к антигенам бактерий родаStreptococcus, S. aureus, E. coli, K. рneumoniae по сравнению с группой контроля. У больных СКВ выявлен статистически значимый более высокий уровень IgG-антител к антигенам S. aureus, S. epidermidis, E. coli и K. рneumoniae. Изменение уровня антител характеризует особенности антигенной нагрузки и подтверждает наличие дисбиотических нарушений при системной красной волчанке, что следует учитывать при осуществлении оптимальной терапии.
Введение
Системная красная волчанка (СКВ) – системное аутоиммунное заболевание неизвестной этиологии, при котором возникают нарушения процессов иммунорегуляции, приводящие к гиперпродукции широкого спектра аутоантител, и которое характеризуется аномальной активностью иммунной системы [Шостак, Клименко, 2011; Kiriakidou, Ching, 2020]. В этиологии СКВ обсуждается роль различных инфекционных агентов – как вирусных, так и бактериальных. В настоящее время все большее внимание уделяется оппортунистическим микроорганизмам, которые, колонизируя организм человека, прямо или косвенно связаны с аутоиммунными заболеваниями. Проводимые в данном направлении исследования показывают, что доклинический период системной аутоиммунной реакции может быть обусловлен нарушением регуляции иммунных взаимодействий с синантропной микрофлорой [Лила и др., 2021]. Взаимодействие микробиоты и иммунной системы больного способствует развитию и поддержанию хронического воспаления и аутоиммунитета [Yacoub et al., 2018]. Условно-патогенные микроорганизмы являются наиболее сильным стимулом для иммунной системы, они способны вызывать дисрегуляцию иммунной системы, оказывать иммуномодулирующее действие, участвуя в патогенетических механизмах иммунно-опосредованных заболеваний [Katz-Agranov, Zandman-Goddard, 2017; Ostrov, Amsterdam, 2017; Visitación, 2019]. Механизмы данного участия бактериальной флоры в патогенезе аутоиммунных заболеваний разнообразны и пока еще недостаточно изучены. Бактериальные виды микробиоты могут как способствовать воспалению (высвобождая иммуноактивирующие соединения, такие как лиганды TLR), так и подавлять воспаление (способствуя развитию регуляторных иммунных клеток) [Battaglia, Garrett-Sinha, 2021]. Патогены могут высвобождать бактериальную ДНК, связанную с другими бактериальными молекулами, которая, действуя на врожденные стимулы рецепторов распознавания, активирует аутореактивные В-клетки с участием феномена молекулярной мимикрии [Qiu et al., 2019]. Наряду с этим условно-патогенные микроорганизмы в составе микробиоты вызывают заметную стимуляцию В-клеток и индукцию синтеза иммуноглобулинов [Li et al., 2020]. Также кишечные микроорганизмы могут способствовать возникновению или развитию СКВ через глубокое воздействие на баланс про- и противовоспалительных цитокинов [Zhong et al., 2018]. Дисрегуляция цитокинов, характерная для СКВ, нарушает функции как провоспалительных, так и иммунорегуляторных цитокинов [Howe, Leung, 2019]. При СКВ бактерии в составе микробиоты могут влиять на дифференцировку клеток иммунной системы. Так, стимуляция CD4+ Т-клеток приводит к значительному снижению дифференцировки иммуносупрессивных T-клеток, а нарушение выработки иммуносупрессивных T-клеток в ответ на бактерии может способствовать хронической активации иммунитета у пациентов с СКВ [Lopez et al., .2016]. Микроорганизмы вовлекаются в инициацию СКВ через гибель нейтрофилов и перекрестную реактивность с комменсальными бактериями [Konig, 2020]. Учитывая роль микробиома в формировании иммунных реакций, изучение адаптивных гуморальных реакций на антигены оппортунистических микроорганизмов может расширить представление о нарушении процессов иммунорегуляции и стать основой для разработки новых стратегий лечения СКВ, направленных на коррекцию процессов антителообразования.
Цель исследования. Изучение у больных СКВ особенностей гуморального иммунного ответа на антигены оппортунистических микроорганизмов.
Объекты и методы исследования
Проведено клинико-лабораторное обследование 26 больных СКВ и 30 условно здоровых лиц контрольной группы. Диагностика СКВ проводилась в соответствии с диагностическими критериями SLICC/ACR (2012). В группу исследования включены женщины в возрасте 49,8 ± 7,74 лет с длительностью заболевания 13,05 ± 10,51 лет. Пациенты имели низкую/среднюю степень активности заболевания (индексы SLEDAI и ECLAM). В комплексном лечении у 57,6 % больных использованы средние дозы глюкокортикоидов (5–15 мг в сутки), 34,6 % пациентов эпизодически использовали нестероидные противовоспалительные препараты. У больных СКВ и лиц контрольной группы в сыворотке венозной крови определяли частоту индикации и титр антител класса G к оппортунистическим бактериям. Для изучения IgG-антител использован метод ИФА. В сыворотке крови одновременно выявляли наличие и титр IgG-антител к бактериальным антигенам оппортунистических микроорганизмов: стафилококков (видов Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus); стрептококков (Streptococcus pneumoniae, Streptococcus spp.); бактерий семейства Enterobacteriaceae (видов Escherichia coli, Proteus vulgaris, Salmonella (O-12), Klebsiella pneumoniae); Pseudomonas aeruginosa; Haemophilus influenzae; тейхоевым кислотам клеточной стенки S. aureus. Использовали рабочие разведения сывороток: 1:100–1:1 600, регистрация результатов ИФА осуществлялась на спектрофотометре при длине волны 450 нм.
Статистический анализ полученных результатов проведен при помощи программы STATISTICA 10.0 (StatSoftInc. США). Данные были проверены на предмет характера распределения. Для количественных признаков использовали вычисление медианы и интерквартильного размаха между 25 и 75 процентилями (Me 25–75 %). Показатели сравнивали с помощью критерия Манна – Уитни. При сравнении дискретных величин использовали критерия χ2 Пирсона с коррекцией на непрерывность по Йейтсу. Критический уровень значимости принимали равным 0,05.
Результаты и их обсуждение
Изучение наличия антител класса G к условно-патогенным бактериям в сыворотке крови больных СКВ показало статистически значимое более частое обнаружение антител к некоторым бактериальным антигенам (см. рисунок). Существенно чаще выявлялись IgG-антитела к антигенам бактерий рода Streptococcus до 84,6 % против их распространения у 53,3 % здоровых лиц (p = 0,027). IgG-антитела к антигенам S. aureus были обнаружены у 53,8 % больных, у лиц контрольной группы они выявлялись в 16,6 % случаев (p = 0,009). Статистически значимо чаще выявлено наличие антител к антигенам бактерий семейства Enterobacteriaceae видов E. coli и K. рneumoniae – соответственно до 73,1 % и 100 %. В контроле данные показатели были в пределах 23,3 % и 60 % (p = 0,001). Наряду с этим следует отметить существенно более редкую частоту выявления IgG-антител к антигенам коагулазоотрицательных стафилококков видов S. epidermidis и S. saprophyticus. Частота обнаружения IgG-антител к антигенам S. epidermidis у больных СКВ соответствовала 65,4 % против их обнаружения у здоровых лиц в 100 % случаев (p = 0,002). При СКВ IgG антитела к антигенам S. saprophyticus не выявлялись, у здоровых они были выделены в 50 % случаев (p = 0,001).
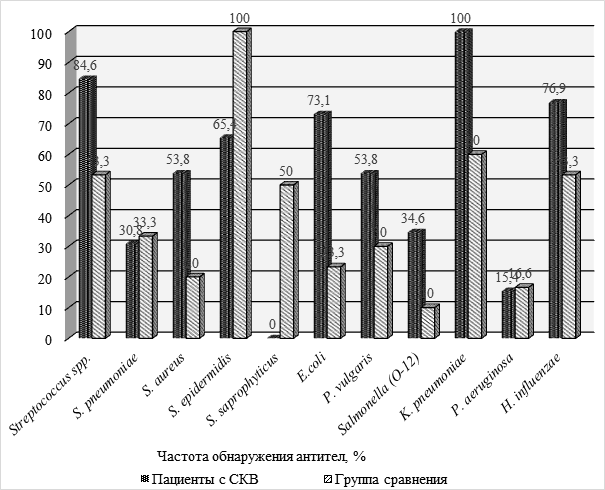
Рис. Частота обнаружения антител класса IgG к бактериальным антигенам у больных СКВ
Fig. Frequency of detection of IgG class antibodies to bacterial antigens in patients with SLE
Качественные особенности антительного состава сыворотки крови больных СКВ сопровождалось количественными изменениями титра IgG-антител к бактериальным антигенам (см. таблицу). Так, у больных количество антител к антигенам стафилококков видов S. aureus (0,22 (0,20–0,24) и S. epidermidis (0,30 (0,28–0,34) было статистически значимо выше, чем у лиц группы сравнения. У здоровых лиц IgG-антитела к антигенам S. aureus и S. epidermidis были соответственно в пределах 0,14 (0,14–0,15) и 0,20 (0,16–0,23) (p = 0,000). При СКВ у пациентов количество IgG-антител к антигенам E. coli было статистически значимо выше, чем у здоровых лиц, соответственно 0,16 (0,15–0,20) и 0,06 (0,04–0,10) (p=0,010). Однотипными были изменения уровня антител к антигенам K. pneumoniae. У больных данный показатель достигал значений 0,29 (0,28–0,32) против 0,20 (0,14–0,24) у здоровых лиц (p = 0,000). Высокая частота определения и более высокий уровень IgG-антител к антигенам коагулазоположительного, более патогенного стафилококка определили целесообразность изучения уровня IgG-антител к тейхоевым кислотам клеточной стенки S. aureus у больных, имеющих в составе микробиома коагулазоположительные стафилококки. У больных СКВ и лиц группы сравнения частота выявления IgG-антител к тейхоевым кислотам клеточной стенки S. aureus не имела статистически значимых различий (85,71 % и 83,33 % соответственно, p = 0,937). Не отмечено статистически значимых различий в уровне IgG-антител к тейхоевым кислотам клеточной стенки стафилококка в сыворотке крови больных и здоровых лиц, показатели были соответственно в пределах 0,30 (0,20–0,38) и 0,20 (0,20–0,23) (p = 0,717).
Таблица
Table
Уровень IgG-антител к бактериальным антигенам у больных СКВ
The level of IgG antibodies to bacterial antigens in patients with SLE
Бактериальные антигены | Обследованные лица | ||
Больные СКВ, n = 26 | Контрольная группа, n = 30 | p | |
Титр IgG антител | |||
Me (Q25 – Q75) | Me (Q25 – Q75) | ||
Streptococcus spp. | 0,15 (0,14–0,20) | 0,14 (0,12–0,14) | 0,201 |
S. pneumoniae | 0,06 (0,04–0,09) | 0,13 (0,12–0,14) | 0,077 |
S. aureus | 0,22 (0,20–0,24) | 0,14 (0,14–0,15) | 0,004 |
S. epidermidis | 0,30 (0,28–0,34) | 0,20 (0,16–0,23) | 0,000 |
S. saprophyticus | 0 | 0,20 (0,16–0,24) | 0,000 |
E. coli | 0,16 (0,15–0,20) | 0,06 (0,04–0,10) | 0,010 |
P. vulgaris | 0,10 (0,08–0,10) | 0,07 (0,04–0,10) | 0,976 |
Salmonella (O-12) | 0,08 (0,06–0,10) | 0,06 (0,05–0,07) | 0,937 |
K. pneumoniae | 0,29 (0,28–0,32) | 0,20 (0,14–0,24) | 0,000 |
P. aeruginosa | 0,05 (0,04–0,08) | 0,04 (0,02–0,10) | 0,404 |
H. influenzae | 0,19 (0,15–0,20) | 0,14 (0,14–0,16) | 0,257 |
Проведенные исследования показали, что у больных СКВ формирование адаптивного иммунитета проявлялось образованием антибактериальных антител к антигенам оппортунистических бактерий. Количественные и качественные характеристики уровня IgG-антител имели характерные особенности, отмечалось статистически значимое изменение уровня антител к отдельным видам оппортунистических микроорганизмов. При СКВ наблюдалось увеличение частоты распространения IgG-антител к антигенам бактерий рода Streptococcusspp, Значительно чаще обнаруживались антитела к патогенным коагулазоположительным стафилококкам вида S. aureus. Одновременно возрастал уровень IgG-антител к антигенам S. aureus и определялись антитела к тейхоевым кислотам клеточной стенки S. aureus. Наличие IgG-антител к антигенам S. aureus могут свидетельствовать о колонизации организма больных более патогенным стафилококком, что повышает риск возникновения коморбидных инфекций при дисфункции иммунной защиты у больных СКВ. S. aureus может также идентифицирован как потенциальный маркер инфекционных поражений кожи при СКВ [Huang et al., 2019]. При СКВ наблюдалось статистически значимое увеличение частоты выявления антител к антигенам энтеробактерий видов E. coli и K. рneumoniae. Одновременно к данным антигенам возрастали титры антибактериальных антител. Данное повышение уровня антител может свидетельствовать о вовлечении кишечных бактерий в патологический процесс, формируя соответствующие иммунные реакции, способствующие развитию СКВ, через глубокое воздействие на баланс между про- и противовоспалительными иммунными ответами и снижая иммунную защиту [Meesiri, 2016; Zhong, 2018]. Повышенный уровень антител к антигенам энтеробактерий также может свидетельствовать об увеличении антигенной нагрузки и увеличении колонизации организма больных условно-патогенными энтеробактериями, при этом активация аутоиммунитета может происходить за счет того, что кишечная палочка и сальмонеллы имеют бактериальный амилоид – белковый компонент сложного внеклеточного матрикса (curli), комплексы curli/ДНК могут активировать аутоиммунитет, действуя как сигналы опасности, молекулярные имитаторы и микробные шапероны нуклеиновых кислот [Qiu et al., 2019]. В то же время антитела против curli/eDNA E. coli могут служить признаком системного воздействия бактериальных продуктов при СКВ [Pachucki et al., 2020]. Образование широкого спектра антител к бактериальным антигенам (Staphylococcus aureus, S. epidermidis, Escherichia coli, Klebsiella pneumoniae) может свидетельствовать о возможной активации поликлональных В-клеток, что обеспечивает защиту от микроорганизмов за счет взаимодействия антител с консервативными структурами оппортунистических микроорганизмов. С другой стороны, поликлональная активация В-клеток потенциально может включать иммунные реакции на собственные антигены и приводить к аутоиммунным проявлениям. В то же время снижение уровня антител и даже их отсутствие (к антигенам S. saprophyticus) может быть связано с уменьшением соответствующей антигенной нагрузки в результате развития дисбиотических нарушений в организме пациентов, так как сывороточные антибактериальные антитела коррелируют при СКВ c наличием определенных микроорганизмов в кишечнике пациентов [Azzouz et al., 2019]. В настоящее время всё большее внимание уделяется разработке более информативных маркеров иммунных нарушений при СКВ. Наряду с клиническими и иммунологическими биомаркерами циркулирующие антитела к оппортунистическим бактериям можно использовались в качестве маркеров для определения текущей бактериальной нагрузки или в качестве индикаторов воздействия бактерий на гуморальные иммунных реакций при СКВ [Bagavant et al., 2019; Yu et al., 2021]. Определение наличия антител к определенным оппортунистическим микроорганизмам может позволить улучшить персонифицированный подход в лечении больных СКВ с учетом повышенной антигенной нагрузки.
Выводы
- При СКВ в сыворотке крови больных наблюдаются количественные и качественные изменения уровня IgG-антител к антигенам оппортунистических микроорганизмов, что может быть связано с изменением антигенной нагрузки и нарушением характера микробиома при развитии аутоиммунных патологических процессов.
- Обнаружена большая частота распространения IgG-антител к антигенам стрептококков, коагулазоположительных стафилококков, кишечной палочки и клебсиелл. К антигенам коагулазоотрицательных стафилококков видов S. epidermidis и S. saprophyticus, отличающихся менее выраженной патогенностью, IgG-антитела формируются с меньшей частотой, что свидетельствует о колонизации организма более патогенными микроорганизмами.
- У больных СКВ выявлен статистически значимый более высокий уровень IgG-антител к антигенам золотистого стафилококка, кишечной палочки и клебсиелл, что свидетельствует о выраженном гуморальном ответе на антигены микроорганизмов, имеющих большее распространение в микробиоме больных.
- Изучение уровня IgG-антител к антигенам оппортунистических микроорганизмов может иметь практическое значение как в плане разработки биомаркеров бактериальной нагрузки и особенностей гуморального иммунного ответа у конкретных больных, так и в плане оптимизации методов терапии, реализуя персонифицированный подход в лечении больных СКВ с учетом повышенной антигенной нагрузки при колонизации организма условно-патогенными микроорганизмами.





Список литературы
Лила А.М., Галушко Е.А., Гордеев А.В., Семашко А.С. 2021. Роль микробиома в патогенезе иммуно-воспалительных заболеваний (дискуссионные вопросы). Современная ревматология, 1: 15–19.
Шостак Н.А., Клименко А.А. 2011. Системная красная волчанка в практике врача-интерниста: современные вопросы диагностики и лечения. Consil. Medicum, 9: 51–56.
Azzouz D., Omarbekova А., Adriana Heguy А., Schwudke D., Gisch N., Rovin В., Caricchio R., Buyon Р., Alekseyenko А., Silverman G. 2019. Lupus nephritis is linked to disease-activity associated expansions and immunity to a gut commensal, Ann Rheum Dis. 78 (7): 947–956.
Bagavant Н., Dunkleberger М., Wolska N., Sroka М., Rasmussen A., Adrianto I., Montgomery С., Sivils К., Guthridge J., James J., Merrill J., Deshmuk U. 2019. Antibodies to periodontogenic bacteria are associated with higher disease activity in lupus patients, Clin. Exp. Rheumatol., 37 (1): 106–111.
Battaglia М., Garrett-Sinha L. А. 2021. Bacterial infections in lupus: Roles in promoting immune activation and in pathogenesis of the disease. J. Transl. Autoimmun., 4: 100078.
Howe H.S., Leung B.P.L. 2019. Anti-cytokine autoantibodies in systemic lupus erythematosus. Cells, 9.
Huang C., Yi X., Long H., Zhang G., Wu H., Zhao M., Lu Q., Huang C. J. 2020. Disordered cutaneous microbiota in systemic lupus erythematosus. Autoimmun. 108: 102391.
Katz-Agranov N., Zandman-Goddard G. 2017. The microbiome and systemic lupus erythematosus. Immunol Res. 65 (2): 432–437.
Kiriakidou M., Ching C.L. 2020. Systemic Lupus Erythematosus. Ann. Intern. Med., 2; 172 (11): ITC81-ITC96.
Konig M.F. 2020. The microbiome in autoimmune rheumatic disease. Best Pract. Res. Clin. Rheumatol., 34 (1): 101473.
Li H., Limenitakis J.P., Greiff V., Yilmaz B., Schären O., Urbaniak C., Zünd M., Lawson M., Young I.D., Rupp S., Heikenwälder M., McCoy K.D., Hapfelmeier S., Ganal-Vonarburg S.C., Macpherson A.J. 2020. Mucosal or systemic microbiota exposures shape the B cell repertoire. Nature. 584 (7820): 274–278.
Lopez P., de Paz B., Rodriguez-Carrio J., Hevia A., Sanchez B., Margolles A. 2016. Th17 responses and natural IgM-antibodies are related to gut microbiota composition in systemic lupus erythematosus patients. Sci. Rep., 6: 24072.
Meesiri S. 2017. Pyomyositis in a patient with systemic lupus erythaematosus and a review of the literature. BMJ Case Rep. 18: 10.
Ostrov B.E., Amsterdam D. 2017. Immunomodulatory interplay of the microbiome and therapy of rheumatic diseases. Immunol. Invest. 46 (8): 769–792.
Pachucki R.J., Corradetti C., Kohler L., Ghadiali J., Gallo P.M., Nicastro L., Tursi S.A., Gallucci S., Tükel Ç., Caricchio R. 2020. Persistent Bacteriuria and Antibodies Recognizing Curli/eDNA Complexes from Escherichia coli are linked to Flares in Systemic Lupus Erythematosus Arthritis. Rheumatol. 72 (11): 1872–1881.
Qiu C.C., Caricchio R., Gallucci S. 2019. The Role of Bacterial Infections in the Extracellular Exposure of Lupus. Nuclear Autoantigens Front Immunol. 8; 10: 2608.
Visitación N., Robles-Vera I., Toral M. 2019. Protective Effects of Probiotic Consumption in Cardiovascular Disease in Systemic Lupus Erythematosus, Nutrients, 11 (11): 2676.
Yacoub R., Alexander J., Wlaschin J., McGregor M., Alexander J. 2018. Lupus: The microbiome angle. Immunobiology, 223 (6–7): 460–465.
Yu H., Nagafuchi Y., Fujio K. 2021. Clinical and Immunological Biomarkers for Systemic Lupus Erythematosus. Biomolecules, 22; 11 (7): 928.
Zhong D., Wu C., Zeng X., Wang Q. 2018. The role of gut microbiota in the pathogenesis of rheumatic diseases, Clin. Rheumatol., 37 (1): 25–34.