Случай вторичной артериальной гипертензии, развившейся на фоне нейроэндокринной опухоли надпочечников
Aннотация
Цель работы.Акцентировать внимание на важности выявления причин артериальной гипертензии (АГ) и дифференциальной диагностики. АГ остаётся одной из самых обсуждаемых тем среди всего медицинского сообщества. АГ рассматривается как медико-социальная проблема ввиду широкой распространённости во всём мире. Большинство клинических примеров сопровождается наличием эссенциальной формы АГ, однако порядка 5–25 % случаев отводится именно на вторичные (симптоматические) формы АГ (ВтАГ). В представленной статье рассматривается такой случай у пациента молодого возраста на фоне феохромоцитомы. Данный клинический случай является иллюстрацией развития ВтАГ, нуждающейся в грамотном изучении первопричины ввиду сложности диагностики на начальных этапах развития заболевания, а также правильно подобранной тактики ведения пациента.
Ключевые слова: симптоматическая артериальная гипертензия, феохромоцитома, нейроэндокринная опухоль надпочечников, катехоламины, эндокринные нарушения
Введение
Клиническое проявление вторичной артериальной гипертензии (ВтАГ), в отличие от эссенциальной формы, сопровождается более выраженной тяжестью течения, довольно часто может развиваться в молодом возрасте и иметь резистентность к проводимой медикаментозной терапии. Однако несмотря на то, что процент диагностики ВтАГ возрос на фоне современных комплексных лабораторно-инструментальных методов диагностики, большое количество случаев ВтАГ остается недиагностированным или же диагноз ввиду ряда причин выставляется только через 5–10 лет [Чихладзе и др., 2020; Аксенова и др., 2021; Sarathy et al., 2022].
При определении оптимальной тактики ведения главную роль занимает грамотная постановка клинического диагноза с учетом предположительно имеющихся изменений в системах и органах-мишенях, а также определение их функциональной активности. Наиболее частыми причинами ВтАГ являются заболевания почек, такие как поликистоз, гидронефроз, заболевания сосудов почек, врожденные аномалии, атеросклероз почечных артерий. Такие заболевания сердечно-сосудистой системы, как гипертрофическая кардиомиопатия, коарктация аорты, могут послужить причиной возникновения ВтАГ [Юкина и др., 2015; Antonio et al., 2020]. Значительную роль играют эндокринные нарушения, такие как опухоли хромаффинной ткани надпочечников – феохромоцитома, первичный гиперальдостеронизм и синдром эндогенного гиперкортицизма – синдром Иценко-Кушинга. В этом и заключается сложность дифференциального диагностирования и назначения медикаментозной терапии для конкретной патологии, так как артериальная гипотензия (АГ) является частой причиной обращения к специалистам, но и частой причиной возникновения необратимых изменений в органах-мишенях, формированию резистентных форм АГ и повышению риска развития сердечно-сосудистых осложнений (ССО) [Мельниченко и др., 2015; Чихладзе, 2020; Чихладзе и др., 2022; Кобалава и др., 2024; Aygun, Uludag, 2020].
Эндокринные гипертензии обусловлены нарушениями секреции гормонов надпочечников. Решение проблемы постановки диагноза определяется необходимостью обращения пациента к довольно широкому кругу смежных специалистов, в процессе которого важно выявить патологическое нарушение, а также с помощью дополнительных скрининг-методов лабораторного исследования на определение уровня катехоламинов, кортизола и альдостерона в плазме крови и в суточном анализе мочи, послуживших причиной возникновения вторичной артериальной гипертензии [Артамонова и др., 2025; Antonio et al., 2020; Mete et al., 2022].
Клинический случай
Пациент, мужчина 49 лет, обратился за помощью к врачу-кардиологу по месту жительства с жалобами на высокие цифры артериального давления (АД), головную боль, головокружение, боль и тяжесть в области сердца, тахикардию, повышенное потоотделение и одышку при минимальной физической нагрузке в течение года.
Анамнез заболевания
В течение года пациент наблюдался у участкового терапевта, на визите отмечал жалобы: внезапные эпизоды повышения цифр АД до значений 185/110 мм рт. ст., (максимальные числа систолического артериального давления (САД) составили 200 мм рт. ст.); сохранялись периодически продолжительные головные боли, сопровождающиеся приступами сильного головокружения; тахикардия с приступами резкой боли в сердце; тяжесть и одышку при малейшей физической нагрузке. На основании жалоб, физикального осмотра и данных лабораторного анализа пациенту был выставлен следующий диагноз: гипертоническая болезнь (ГБ) 2 стадии, 3 степени, риск 4 (очень высокий). Поэтапно были назначены различные комбинации лекарственных препаратов: лерканидипин 20 мг, кандесартан 32 мг, моксонидин 0,6 мг, эплеренон 100 мг, торасемид 5 мг. На фоне безуспешного эффекта медикаментозной терапии сохранялись жалобы и высокие цифры АД, пациент обращается к кардиологу.
Анамнез жизни
Наследственность отягощена – у матери наблюдается ГБ и сахарный диабет второго типа. Из вредных привычек у пациента несбалансированное питание, курение по полпачки в сутки с 18 лет (индекс курения 15,5), прием алкогольных напитков редко. Пациент с детского возраста отмечает продолжительные головные боли, однако на постоянной основе у терапевта и кардиолога не обследован. Эпидемиологический анамнез: туберкулез, вирус иммунодефицита человека, гепатиты отрицает. Контакта с инфекционными больными за последние 3 месяца не имел. Компоненты крови не переливались.
Объективные данные
Сознание: ясное, положение активное. Рост 172 см, вес 90 кг. Индекс массы тела равен 30,5 кг/м². Телосложение: нормостеническое. Кожные покровы физиологической окраски, патологические изменения, пигментации, сыпи, сосудистые звёздочки, шелушения, кровоизлияния не найдены. Кожа средней эластичности, пальпаторно безболезненная. Конъюнктивы и слизистые оболочки полости рта розовые и чистые. Доступные для пальпации лимфатические узлы не увеличены, безболезненны, не спаяны с окружающей тканью и кожей. Подкожная жировая клетчатка выражена умеренно. Костно-мышечная система без патологических изменений. Щитовидная железа не пальпируется. Грудная клетка: форма нормостеническая, асимметрия отсутствует, обе половины грудной клетки участвуют в акте дыхания. Тип дыхания: смешанный, присутствует одышка. Перкуторный звук на симметричных участках грудной клетки ясный легочный. При аускультации легких дыхание везикулярное с обеих сторон, хрипов нет, частота дыхательных движений 18 в минуту, уровень насыщения крови кислородом 98 %. Перкуторно смещение границы относительной тупости сердца кнаружи на 0,5 см от левой срединно-ключичной линии. Аускультация сердца: тоны сердца ясные, ритм правильный, частота сердечных сокращений – 112 в минуту, АД – 190/110 мм рт. ст. В полости рта слизистая оболочка внутренних поверхностей губ, щёк, мягкого и твёрдого нёба розовой окраски; высыпания, изъязвления отсутствуют. Язык нормальной величины и формы, расположен по средней линии, розовой окраски, влажный, обложен у корня белым налетом. Живот округлой формы, симметричный, при пальпации безболезненный, участвует в акте дыхания. Печень у края реберной дуги. Периферических отеков нет. Физиологические отправления без особенностей.
Лабораторная диагностика
Клинический анализ крови: лейкоциты – 7,8 × 10 9/л, эритроциты – 4,68 × 10 12/л, гемоглобин – 139 г/л, гематокрит – 41,2 %, тромбоциты – 308 × 10 9/л, палочкоядерные – 3 %, сегментоядерные – 52 %, лимфоциты – 32 %, моноциты – 9 %, эозинофилы – 4 %.
Биохимический анализ крови. Мочевина – 6,6 ммоль/л, креатинин – 102 ммоль/л, мочевая кислота – 366 мкмоль/л, общий белок – 79 г/л, альбумин – 50 г/л, билирубин – 18,4 мкмоль/л, АЛТ – 26 ЕД/л, АСТ – 23 ЕД/л, глюкоза – 6,05 ммоль/л, гликированный гемоглобин – 5,7 %, калий – 4,39 ммоль/л, натрий – 141,9 ммоль/л, кальций общий – 2,25 ммоль/л. Липидограмма: общий холестерин – 6,41 ммол/л, холестерин липопротеиды высокой плотности – 1,02 ммоль/л, холестерин липопротеиды низкой плотности – 5,5 ммоль/л, триглицериды – 1,9 ммоль/л, индекс атерогенности – 5,28.
Анализ гормонов щитовидной железы. Тиреотропный гормон (ТТГ) – 3,8 мкМЕ/мл, тироксин (Т4) – 19,6 пмоль/л, трийодтиронин (Т3) – 4,4 пмоль/л, антитела к тиреоидной пероксидазе (АТ к ТПО) – 14,3 ЕД/мл.
Анализ мочи. Норметанефрин – 1518 мкг/сут (норма 119,0–451,0 мкг/сут), метанефрин – 268 мкг/сут (норма 44,0–261,0 мкг/сут).
Инструментальная диагностика
Электрокардиография ЭКГ (рисунок 1). Ритм синусовый, правильный. ЧСС – 68 ударов минуту. Электрическая ось сердца отклонена резко влево (угол альфа – 60°). Блокада передней ветви левой ножки пучка Гиса. Нарушение процессов реполяризации левого желудочка (ЛЖ). Гипертрофия миокарда ЛЖ.
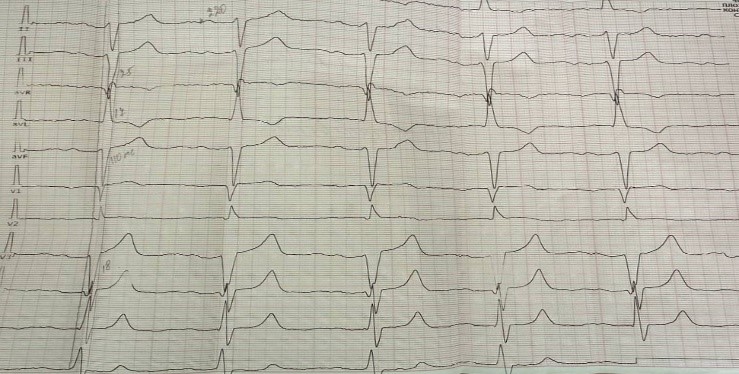
Рис. 1. Электрокардиография
Fig. 1. Electrocardiography
Эхокардиография. Основание аорты – 35 мм, восходящий отдел – 32 мм. Аортальный клапан: трехстворчатый, створки уплотнены. Митральный клапан: створки уплотнены. Индексированный размер корня аорты на рост – 2,03 см/м. Индексированный размер восходящей аорты – 1,86 см/м. Индексированный объем – 21,77 мл/м2. Конечный диастолический объем по Симпсону (КДО) – 135 мл. Индекс КДО – 65 мл/м2. Конечный диастолический объем (КДО) – 51 мл. Конечный систолический размер (КСР) – 35 мм. Межжелудочковая перегородка (МЖП) – 12 мм. Задняя стенка левого желудочка (ЗСЛЖ) – 12 мм. Фракция выброса (ФВ) по Симпсону 62 %. Масса миокарда – 257 г. Индекс массы миокарда – 123 г/м2. Доплерография трансмитрального потока: Е – 0,56 м/сек, А – 0,7 м/сек, Е/А – 0,80. Продольная систолическая функция миокарда ЛЖ – 15 см/с. Правый желудочек – 32 мм. Продольная систолическая функция миокарда правого желудочка – 17 см/с. Расчетное давление в полости правого желудочка – 18 мм рт. ст.
Заключение. Уплотнение стенок аорты, уплотнение стенок аортального и митрального клапанов. Трехстворчатый клапан – створки тонкие. Функции клапанного аппарата сохранены. Индексированные размеры аорты незначительно меньше нормы (2,1 см/м – норма). Размеры полостей сердца в норме. Глобальная, локальная систолическая функция миокарда ЛЖ в норме. Концентрическая гипертрофия миокарда ЛЖ.
Ультразвуковое исследование (УЗИ) щитовидной железы (рисунок 2). Топография не изменена, структуры хорошо дифференцированы. Расположение типичное. Контуры ровные, чёткие. Капсула не уплотнена. Кровоснабжение правой доли 1 типа, левой доли 1 типа. Скорость по артериям щитовидной железы – 14,00 см/сек. Региональные лимфоузлы (паратрахеальные, яремные) не увеличены.
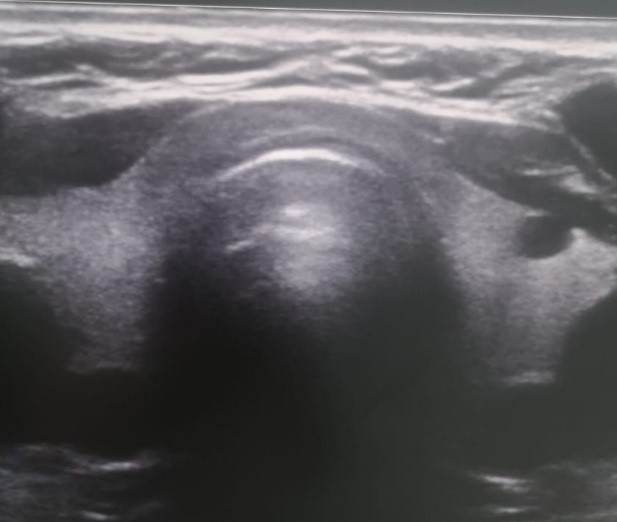
Рис. 2. УЗИ щитовидной железы. Патологических изменений не выявлено
Fig. 2. Ultrasound of the thyroid gland. No pathological changes were detected
Заключение. Тиреоидный объем – 14,68 см3. Патологических изменений щитовидной железы не выявлено.
УЗИ почек. Левая: размеры в пределах возрастных норм 113×52 мм. Расположение типичное. Контуры ровные, чёткие. Визуализируемые фрагменты капсулы без особенностей. Рисунок интраренальных структур хорошо дифференцирован во всех отделах. Толщина паренхимы – 19 мм. Эхоструктура паренхимы однородная, эхогенность обычная. Чашечно-лоханочная система (ЧЛС) не расширена, уплотнена. В ортостазе смещаемость в пределах физиологической нормы. Правая: размеры в пределах возрастных норм, 113×51 мм. Расположение типичное. Контуры ровные, чёткие. Визуализируемые фрагменты капсулы без особенностей. Рисунок интраренальных структур хорошо дифференцирован во всех отделах. Толщина паренхимы – 19 мм. Эхоструктура паренхимы однородная, эхогенность обычная. Чашечно-лоханочная система (ЧЛС) не расширена, уплотнена. В ортостазе смещаемость в пределах физиологической нормы.
Заключение. Умеренные диффузные изменения почечных синусов с двух сторон.
Доплерография почечных артерий и вен (рисунок 3). Внутрипочечный кровоток равномерный, прослеживается до капсулы. Индекс почечной артерии Ао = 0,9. Чётко прослеживается рисунок ветвей ренальных сосудов всех порядков до кортикальных фрагментов включительно, диаметр их не изменён, пульсация сохранена.
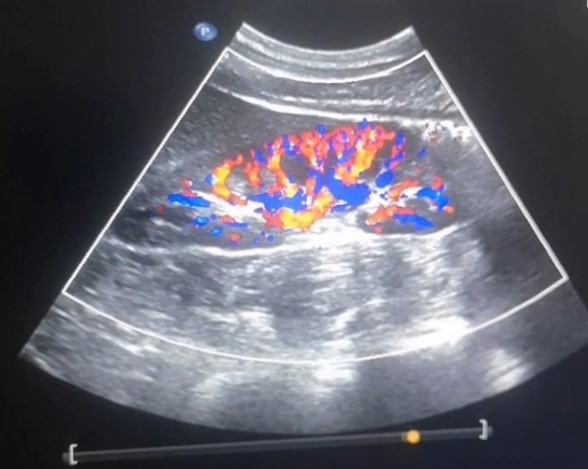
Рис. 3. Доплерография почечных артерий и вен. Патологических изменений не выявлено
Fig. 3. Dopplerography of renal arteries and veins. No pathological changes were detected
Заключение. Гемодинамически значимых стенозов почечных артерий не выявлено. Почечные вены проходимы с двух сторон.
УЗИ мочевого пузыря (рисунок 4). Положение типичное, обычной формы. Объем –337 мл. Рисунок структур стенок на визуализируемых участках хорошо дифференцирован, без выявляемых изменений. Содержимое гомогенное. Признаков дополнительных организованных включений в просвете пузыря, проекции его стенок, устьев мочеточников и паравезикальных пространствах не выявляются. Проявлений дилатации дистальных отделов мочеточников, а также эктопии их устьев не отмечается. Объем остаточной мочи – 17 мл.
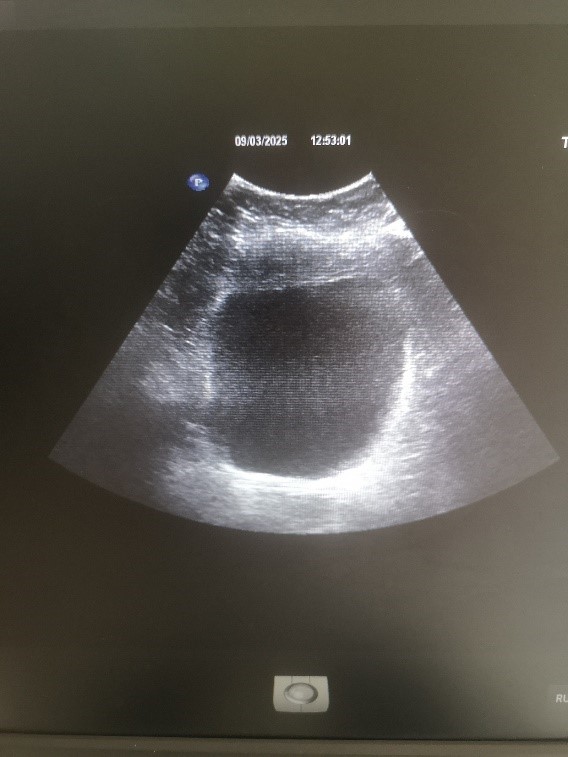
Рис. 4. УЗИ мочевого пузыря. Патологических изменений не выявлено
Fig. 4. Ultrasound of the bladder. No pathological changes were detected
Заключение. Мочевой пузырь без патологических изменений. Наличие остаточной мочи в допустимом количестве.
УЗИ экстракраниального отдела брахиоцефальных артерий (рисунок 5 а, б). Позвоночная артерия интракраниального отдела справа – 51 см/сек, слева – 46 см/сек. Кровоток по подключённым артериям магистральных типа с двух сторон. Внутренняя яремная вена справа: кровоток фазный, проходима, 16 мм. Внутренняя яремная вена слева: кровоток фазный, проходима, 11 мм. Позвоночные вены и подключичные вены проходимы с двух сторон. Слева в устье внутренней сонной артерии лоцируется локальная гиперэхогенная атеросклеротическая бляшка, стеноз до 10 %. Мягкая непрямолинейность позвоночных артерий с двух сторон.
а 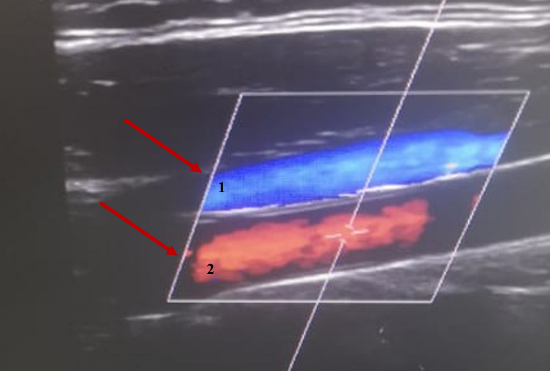 б
б 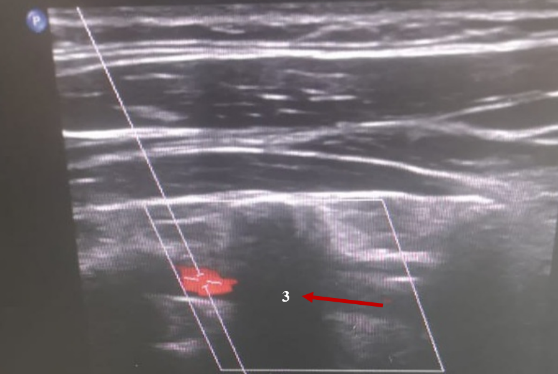
Рис. 5. УЗИ брахиоцефальных артерий. 1 – внутренняя яремная вена без патологических изменений; 2 – общая сонная артерия без патологических изменений; 3 – позвоночная артерия без патологических изменений
Fig. 5. Ultrasound of the brachiocephalic arteries. 1 – internal jugular vein without pathological changes; 2 – common carotid artery without pathological changes; 3 – vertebral artery without pathological changes
Заключение. Комплекс интима-медиа незначительно утолщен, уплотнен. Гемодинамически значимых стенозов экстракраниальных артерий нет. Линейные скоростные показатели кровотока в пределах возрастной нормы.
УЗИ надпочечников (рисунок 6). Левый надпочечник: размеры 24×20 мм, форма обычная, контуры четкие, ровные, структура однородная, эхогенность нормальная, положение типичное. Правый надпочечник: размеры 26×22 мм, форма обычная, контуры четкие, ровные, структура однородная, лоцируется гипоэхогенное образование размерами 17×13 мм с периферическим кровотоком при цветном доплеровском картировании, эхогенность нормальная, положение типичное.
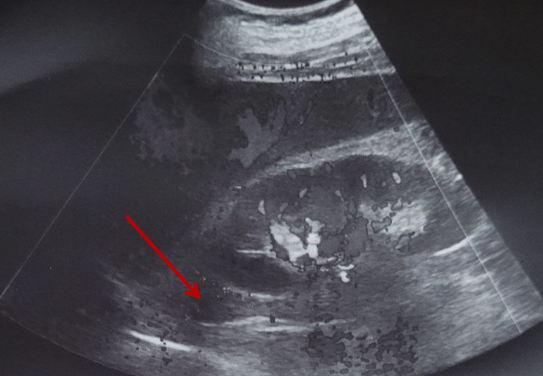
Рис. 6. УЗИ правого надпочечника. В структуре обнаружена аденома
Fig. 6. Ultrasound of the right adrenal gland. An adenoma was found in the structure
Заключение. Выявлено в структуре правого надпочечника гипоэхогенное образование размерами 17×13 мм с периферическим кровотоком.
Проведена серия компьютерных томограмм (КТ) по стандартной методике с последующей мультипланарной и трехмерной реконструкцией и реформацией полученных аксиальных изображений: печень не увеличена, максимальный вертикальный размер правой доли – 131 мм (норма – до 150 мм), поперечный размер левой доли – 84 мм (норма – до 50 мм), билобарный размер на уровне ворот печени – 202 мм (норма – до 210 мм), структура паренхимы однородная. Денситометрические показатели +38HU. Портальная вена не расширена – 13 мм (норма – до 15 мм). Внутри- и внепеченочные желчные протоки не расширены. Желчный пузырь грушевидной формы, содержимое однородное, стенки не утолщены. Рентгеноконтрастных конкрементов не определяется. Холедох не расширен. Селезенка не увеличена, однородная, паренхима не изменена. Селезеночная вена не расширена. Поджелудочная железа имеет дольчатое строение, размеры в области головки – 28 мм, тела – 21 мм, хвоста – 22 мм, структура паренхимы поджелудочной железы однородная. Вирсунгов проток не расширен. Парапанкреатическая клетчатка не уплотнена. Надпочечники в типичном месте, Y-образной формы, обычных размеров. Образование латеральной ножки правого надпочечника. 72,6 % – абсолютный индекс вымывания. 81,8 % – относительный индекс вымывания. Правая почка расположена в типичном месте, обычной формы, контуры ровные, четкие, размеры 57×49×104 мм. Паренхима не истончена (норма – 15 мм и более), с гомогенной структурой. Дифференцировка коркового и мозгового слоев удовлетворительная. Чашечно-лоханочная система не расширена. Паранефральная клетчатка не изменена. Рентгеноконтрастных конкрементов не определяется. Экскреторная функция удовлетворительная, уродинамика не нарушена. Левая почка расположена в типичном месте, обычной формы, контуры ровные, четкие, размеры 53×56×107 мм. Паренхима не истончена (норма – 15 мм и более), с гомогенной структурой. Дифференцировка коркового и мозгового слоев удовлетворительная. Чашечно-лоханочная система не расширена. Паранефральная клетчатка не изменена. Рентгеноконтрастных конкрементов не определяется. Экскреторная функция удовлетворительная, уродинамика не нарушена. Правый мочеточник достоверно не расширен, ход неизменен, в просвете рентгеноконтрастных конкрементов не определяется. В выделительную фазу, равномерно контрастирован на всем протяжении. Левый мочеточник достоверно не расширен, ход неизменен, в просвете рентгеноконтрастных конкрементов не определяется. В выделительную фазу, равномерно контрастирован на всем протяжении. Пузырно-мочеточниковые соустья без признаков патологического контрастного усиления. Мочевой пузырь овоидной формы, удовлетворительного наполнения, контуры ровные, четкие, стенки не утолщены.
Заключение. Признаки образования латеральной ножки правого надпочечника.
Консультация окулиста. Заключение. Ангиопатия сетчатки обоих глаз.
Консультация эндокринолога. Заключение. Феохромоцитома правого надпочечника, персистирующей формы, средней степени тяжести. Вторичная артериальная гипертензия. Рекомендовано: контроль гемодинамики согласно рекомендациям кардиолога; консультация хирурга для решения вопроса о тактики ведения.
Клинический диагноз
Феохромоцитома правого надпочечника, персистирующей формы, средней степени тяжести. Вторичная артериальная гипертензия. Гипертрофия миокарда левого желудочка. Дислипидемия. Хроническая болезнь почек (ХБП) С2. Скорость клубочковой фильтрации (СКФ) (CKD-EPI 74 мл/мин/1,73 м2). Ожирение I степени.
Лечение
Рекомендовано. Диетотерапия с ограничением потребления соли до 5 г/сутки и мясных продуктов в рационе, ограничение жареной и острой пищи, увеличение содержания свежих овощей и фруктов, орехов, рыбы и молочных продуктов. Медикаментозная терапия: доксазозин 2 мг, амлодипин 10 мг, индапамид 2,5 мг утром, розувастатин 10 мг вечером. Контроль АД и пульса. Лабораторный контроль липидограммы и биохимического анализа крови, анализа мочи на изучение динамики изменений уровня катехоламинов в моче. Консультация хирурга с целью определения показаний к оперативному вмешательству, наблюдение у эндокринолога, кардиолога.
На фоне проводимой терапии пациент отмечает улучшение состояния, нормализацию цифр АД, отсутствие эпизодически выраженной головных болей, снижение приступов тахикардии и выраженности одышки при физических нагрузках.
Обсуждение
АГ является достаточно широко распространённым заболеванием, однако наравне с этим и трудно контролируемым на популяционном уровне. Одной из высоковероятных причин высоких цифр АД, не поддающегося медикаментозному контролю в пределах целевых значений, может являться ВтАГ. Особенность многогранности природы возникновения вторичных форм АГ для их дифференциальной диагностики определяет проведение детального обследования пациента с использованием более углубленного и «патогенетически-обоснованного» комплекса лабораторно-инструментальных методов обследования. Немаловажным является не только выявление поражения органов мишеней, но и детальная оценка всевозможных факторов риска развития сердечно-сосудистых осложнений [Вайчулис и др., 2019; Schmiemann et al., 2012].
В течение длительного периода пациент, представленный в данном клиническом случае, отмечал эпизодически повышенные цифры АД, сопровождающиеся продолжительной головной болью, тахикардией, слабостью и одышкой при незначительной физической нагрузке. При первичном обращении за медицинской помощью был установлен диагноз: гипертоническая болезнь II стадии, 3 степени, риск 4 (очень высокий). Назначена антигипертензивная терапия в виде комбинированных гипотензивных препаратов, однако на ее фоне положительный эффект отсутствовал, жалобы сохранялись, что и послужило поводом для повторного обращения к врачу-кардиологу для дополнительной оценки симптоматики, а также проведения детального комплексного лабораторного и инструментального обследования с целью выявления истинной причины АГ и формирования дальнейшей тактики ведения пациента [Аксенова, 2021; Schmiemann et al., 2012].
Вероятной причиной развития подобной клинической картины на фоне проводимой медикаментозной терапии в виде эпизодов подъема цифр САД до 200 мм рт. ст. с сохраняющимися вышеуказанными жалобами может являться нейроэндокринная опухоль. Среди обширного круга заболеваний эндокринной системы стоит обратить внимание на несколько известных состояний, таких как феохромоцитома, синдром Иценко – Кушинга и первичный гиперальдостеронизм. Каждое из вышеперечисленных заболеваний характеризуется стойким повышением цифр АД, изменением специфических биохимических показателей, возможным отягощённым наследственным анамнезом и выявлением патологического образования в области надпочечника [Мурадян и др., 2020; Чихладзе, 2020]. Анализируя анамнестические, клинические, лабораторные данные и результаты инструментальных методов исследования была диагностирована опухоль мозгового слоя надпочечников – феохромоцитома.
Данное заболевание характеризуется довольно низкой распространенностью (0,2–0,6 %) среди всех форм АГ, часто обнаруживается у пациентов молодого возраста, а также тем, что длительное время пациенты могут оставаться без подтвержденного диагноза. Согласно проведенному анализу результатов аутопсийных исследований, было установлено, что невыявленные опухоли обнаруживаются у 0,05–0,1 % пациентов. Примерно 5–12 % пациентов имеют отягощенную наследственность по данному заболеванию [Чазова и др., 2023; Mills et al., 2020]. К вышесказанному стоит добавить, что, согласно последним данным литературы, известно, что феохромоцитома обладает злокачественным потенциалом и способностью к метастазированию с последующим утяжелением общего состояния пациента [Вайчулис и др., 2019; Чазова и др., 2023]. Именно поэтому необходимость своевременной диагностики феохромоцитомы обусловлена тем, что при отсутствии вовремя подобранной тактики ведения пациента персистирующая гиперсекреция катехоламинов приводит к развитию ССО и неблагоприятному исходу [Boot, 2023; Lima, Kater, 2023; Passman; Wachtel, 2024].
С целью сужения круга поиска среди таких причин, как эссенциальная и ВтАГ, врожденные и приобретенные пороки сердца, коарктация аорты, гипертрофическая кардиомиопатия, инфильтративные заболевания миокарда, способствующие развитию и прогрессированию ремоделирования миокарда ЛЖ в виде гипертрофии, пациенту был назначен первичный комплекс обследований. По результатам ЭКГ были выявлены признаки гипертрофии миокарда ЛЖ. Также была выполнена эхокардиография с целью выявления возможных морфологических изменений миокарда, оценки размеров камер сердца, сократительной способности миокарда, определения функциональной сохранности клапанного аппарата, по результатам которой была выявлена концентрическая гипертрофия миокарда ЛЖ.
Опираясь на полученные данные при сборе анамнеза и имеющиеся клинические рекомендации, пациенту в качестве метода первичной диагностики было предложено выполнить скрининговое исследование на фракционированные метанефрины в суточной моче с целью исключения или подтверждения диагноза – феохромоцитома [Мельниченко и др., 2015; Чазова и др., 2023; Sharma, Fishbein, 2023]. По результатам проведённого анализа были обнаружены крайне высокие значения метанефрина (повышен почти в 2 раза) и норметанефрина (повышен почти в 3 раза). Когда подтвердились повышенные уровни фракционированных метанефринов, было принято решение о проведении углубленного инструментального исследования.
Основной причиной развития феохромоцитомы, как уже было упомянуто выше, являются опухоли надпочечников, дифференцировать которые позволяют современные визуализирующие методы инструментальной диагностики, такие как УЗИ с использованием цветового допплеровского картирования, спиральная и мультиспиральная рентгеновская КТ, магнитно-резонансная томография, позволяющие достаточно точно визуализировать структурные и функциональные изменения при поражении данного органокомплекса [Ebbehoj et al., 2021; Nölting et al., 2022; Marcus, Subramaniam, 2023]. Согласно данным УЗИ органов брюшной полости и забрюшинного пространства, у нашего пациента было обнаружено гипоэхогенное образование правого надпочечника. Выполненное в последующем КТ исследование подтвердило структурное изменение латеральной ножки правого надпочечника.
Благодаря комплексному лабораторно-инструментальному обследованию у пациента обнаружена причина ВтАГ – феохромоцитома правого надпочечника. Основная сложность дифференциального диагностического поиска на начальных этапах ведения пациента заключается в симптоматической схожести проявлений, свойственных как для феохромоцитомы, так и некоторых других заболеваний эндокринной системы. Согласно данным литературы, примерно до 20 % всех случаев имеют наследственный характер. Таким пациентам рекомендуется выполнение генетического обследования [Чазова и др., 2023; Aygun, Uludag, 2020; Dogrul et al., 2022]. У нашего пациента данное исследование не проводилось. Данный метод позволяет выявить заболевания, которые могут стать причиной феохромоцитомы: множественная эндокринная неоплазия 2 типа, болезнь фон Гиппеля – Линдау, нейрофиброматоз 1 типа [Мельниченко и др., 2015; Мурадян и др., 2020]. Однако ввиду высокой стоимости данного исследования показания к нему определяются индивидуально.
Выполнив анализ изначальной тактики ведения пациента с подбором медикаментозной терапии, можно сделать вывод, что не всегда рутинное обследование и назначение стандартной комбинированной гипотензивной терапии является эффективным. Согласно клиническим рекомендациям ведения пациентов с установленным диагнозом феохромоцитома, рекомендована тактика предоперационной медикаментозной стабилизации с последующей хирургической тактикой с целью устранения основного источника гиперпродукции катехоламинов.
Всем пациентам с подозрением и/или установленным диагнозом рекомендуется назначение α-адреноблокаторов с целью снижения таких периоперационных рисков, как реактивная тахикардия и плохо контролируемая постоянная послеоперационная гипотония. Для дополнительного контроля цифр АД рекомендуется прием дигидропиридиновых блокаторов кальциевых каналов [Чазова и др., 2023; Garcia-Carbonero et al., 2021]. Вопрос применения β-адреноблокаторов и других имеющихся в арсенале врача комбинаций гипотензивных препаратов у пациентов с феохромоцитомой остается дискутабельным, так как имеется риск спровоцировать состояние неуправляемой гемодинамики, характеризующееся эпизодической сменой повышенного и пониженного АД. Довольно серьезной опасностью является развитие катехоламинового шока, сопровождающегося стойкой гиповолемией, обусловленной патофизиологическими особенностями гемодинамики в виде централизации кровообращения с последующим уменьшением объема циркулирующей крови, а также гипотонией, присоединяющейся на фоне нарушений ритма сердца и сниженного сердечного выброса. Данное состояние объясняется изменёнными и нарушенными механизмами гемодинамики, инактивации катехоламинов, а также дестабилизированной чувствительностью адренорецепторов на фоне персистирующей стимуляции и нарушениями, происходящими в клетках проводящей системы сердца. Однако все же имеются некоторые малочисленные данные использования β-адреноблокаторов, но обязательным условием для этого всегда являлось предварительное «насыщение» в течение 3–4 дней в формате стандартной терапии блокаторами α-адренорецепторов. Основной целью медикаментозной предоперационной подготовки пациентов с феохромоцитомой является достижение критериев ее эффективности (нормализация цифр АД, достижение целевого значения ЧСС, а также устранение гиповолемического синдрома при его наличии) [Мельниченко и др., 2015; Чазова и др., 2023; Dogrul et al., 2022].
Нашему пациенту была назначена патогенетическая медикаментозная терапия в виде доксазозина, амлодипина, индапамида, розувастатина. На фоне данной терапии пациент отмечал улучшение общего состояния, стабильные переносимые цифры АД и ЧСС, отсутствие эпизодически выраженной головной боли, снижение выраженности одышки при физических нагрузках. Также пациент направлен на консультацию к хирургу с целью оценки общего состояния и определения показаний к оперативному вмешательству.
Выводы
При подозрении на ВтАГ важной и неотъемлемой частью является повышение не только настороженности широкого круга смежных специалистов, участвующих в наблюдении молодого пациента, но и осведомленности о вариантах проявления заболеваний, сопровождающихся высокими цифрами АД, необходимости ранней диагностики с последующим формированием индивидуальной тактики ведения с целью улучшения не только прогноза, но и такого важного показателя, как качество жизни.
Определяющим звеном благоприятного прогноза в данном клиническом случае служит верно выбранная тактика ведения пациента, заключающаяся в назначении патогенетического лечения с целью предоперационной подготовки и планируемом последующем оперативном вмешательстве с целью устранения основной причины ВтАГ – феохромоцитомы.
Благодарности
Информированное согласие. Получено информированное согласие пациента на публикацию данных его осмотра, обследования, клинического наблюдения. Все данные пациента были деидентифицированы.





Список литературы
Аксенова А.В., Сивакова О.А., Блинова Н.В., Данилов Н.М., Елфимова Е.М., Кисляк О.А., Литвин А.Ю., Ощепкова Е.В., Фомин В.В., Чихладзе Н.М., Щелкова Г.В., Чазова И.Е. 2021. Консенсус экспертов Российского медицинского общества по артериальной гипертонии по диагностике и лечению резистентной артериальной гипертонии. Терапевтический архив. 93(9): 1018–1029. doi: 10.26442/00403660.2021.09.201007
Артамонова Е.В., Бельцевич Д.Г., Бохян В.Ю., Гелиашвили Т.М., Горбунова В.А., Делекторская В.В., Долгушин М.Б., Егоров А.В, Емельянова Г.С., Жукова Л.Г., Жуликов Я.А., Каспшик С.М., Крылов А.С., Кузьминов А.Е., Любимова Н.В., Маркович А.А., Мельниченко Г.А., Орел Н.Ф., Орлов С.В., Орлова К.В., Орлова Р.В., Пронин А.И., Романов И.С., Трифанов В.С., Хомяков В.М., Петров Л.О., Пирогов С.С., Феденко А.А., Болотина Л.В., Фалалеева Н.А., Филоненко Е.В. 2025. Клинические рекомендации «Нейроэндокринные опухоли», Российская ассоциация эндокринологов, Ассоциация онкологов России, Общероссийская общественная организация «Российское общество клинической онкологии». https://gastroscan.ru/literature/authors/15346
Вайчулис И.А., Шапошник И.И. 2019. Основные положения международных рекомендаций по выявлению эндокринных гипертензий. Кардиология. 59(10): 88–96. doi: 10.18087/cardio.2019.10.2669
Кобалава Ж.Д., Конради А.О., Недогода С.В., Шляхто Е.В., Арутюнов Г.П., Баранова Е.И., Барбараш О.Л., Бойцов С.А., Вавилова Т.В., Виллевальде С.В., Галявич А.С., Глезер М.Г., Гринева Е.Н., Гринштейн Ю.И., Драпкина О.М., Жернакова Ю.В., Звартау Н.Э., Иртюга О.Б., Кисляк О.А., Козиолова Н.А., Космачева Е.Д., Котовская Ю.В., Бобкова Н.В., Либис Р.А., Лопатин Ю.М., Небиридзе Д.В., Недошивин А.О., Никулина С.Ю., Остроумова О.Д., Ощепкова Е.В., Ратова Л. Г., Саласюк А.С., Скибицкий В.В., Ткачева О.Н., Троицкая Е.А., Чазова И.Е, Чесникова А.И., Чумакова Г.А., Шальнова С.А., Шестакова М.В., Якушин С.С., Янишевский С.Н. 2024. Клинические рекомендации «Артериальная гипертензия у взрослых» 2024. Российский кардиологический журнал. 29(9): 6117. doi: 10.15829/1560-4071-2024-6117. EDN: GUEWLU
Мельниченко Г.А., Дедов И.И., Белая Ж.Е., Рожинская Л.Я., Вагапова Г.Р., Волкова Н.И., Григорьев А.Ю., Гринева Е.Н., Марова Е.И., Мкртумян А.М. 2015. Болезнь Иценко – Кушинга: клиника, диагностика, дифференциальная диагностика, методы лечения. Проблемы Эндокринологии. 61(2): 55–77. doi: 10.14341/proderalbl201561255-77 144
Мурадян А.Г., Костин А.А., Воробьев Н.В., Толкачев А.О. 2020. Метастатические опухоли надпочечника. Эпидемиология, этиология, диагностика. Онкология. Журнал им. П.А. Герцена. 9(3): 53–60. doi: 10.17116/onkolog2020903153
Чазова И.Е., Чихладзе Н.М., Блинова Н.В., Белая Ж.Е., Данилов Н.М., Елфимова Е.М., Литвин А.Ю., Рожинская Л.Я., Свириденко Н.Ю., Швецов М.Ю., Азизов В.А., Григоренко Е.А., Митьковская Н.П., Мустафаев И.И., Полупанов А.Г., Сарыбаев А.Ш., Хамидуллаева Г.А. 2023. Евразийские клинические рекомендации по диагностике и лечению вторичных (симптоматических) форм артериальной гипертонии (2022). Евразийский кардиологический журнал. 1: 6–65. doi: 10.38109/2225-1685-2023-1-6-65
Чихладзе Н.М. 2020. Первичный гиперальдостеронизм как возможная причина резистентного течения артериальной гипертонии. Системные гипертензии. 17(4): 20–23. doi: 10.26442/ 2075082X.2020.4.200338
Чихладзе Н.М. 2022. Первичный гиперальдостеронизм: показания для скрининга. Терапевтический архив. 94(1): 107–113. doi: 10.26442/00403660.202 2.01.201324
Юкина М.Ю., Трошина Е.А., Бельцевич Д.Г. 2015. Наследственные синдромы, ассоциированные с феохромоцитомой. Часть 1. Терапевтический архив. 87(9): 102–105. doi: 10.17116/ terarkh2015879102-105
Antonio K., Valdez M.M.N., Mercado-Asis L., Taïeb D., Pacak K. 2020. Pheochromocytoma/ paraganglioma: Recent Updates in Genetics, Biochemistry, Immunohistochemistry, Metabolomics, Imaging and Therapeutic Options. Gland Surg. 9(1): 105–123. doi: 10.21037/gs.2019.10.25
Aygun N., Uludag M. 2020. Pheochromocytoma and Paraganglioma: From Epidemiology to Clinical Findings. Sisli Etfal Hastan Tip Bul. 54: 159–68. doi: 10.14744/SEMB.2020.18794
Boot C.S. 2023. A Laboratory Medicine Perspective on the Investigation of Phaeochromocytoma and Paraganglioma. Diagnostics (Basel). 13: 2940. doi: 10.3390/diagnostics13182940
Dogrul A.B., Cennet O., Dincer A.H. 2022. Minimally Invasive Techniques in Benign and Malignant Adrenal Tumors. World J Clin cases. 10(35): 12812–12821. doi: 10.12998/wjcc.v10.i35.12812
Ebbehoj A., Stochholm K., Jacobsen S.F. Trolle Ch., Jepsen P., Robaczyk M.G., Rasmussen A.K., Feldt-Rasmussen U., Thomsen R.W., Søndergaard E., Poulsen P.L. 2021. Incidence and Clinical Presentation of Pheochromocytoma and Sympathetic Paraganglioma: A Population-based Study. J. Clin. Endocrinol. Metab. 106(5): e2251-e2261. doi: 10.1210/clinem/dgaa965
Garcia-Carbonero R., Matute Teresa F., Mercader-Cidoncha E., Mitjavila-Casanovas M., Robledo M., Tena I., Alvarez-Escola C., Arístegui M., Bella-Cueto M.R., Ferrer-Albiach C., Hanzu F.A. 2021. Multidisciplinary Practice Guidelines for the Diagnosis, Genetic Counseling and Treatment of Pheochromocytomas and Paragangliomas. Clin Transl Oncol. 23: 1995–2019. doi: 10.1007/s12094-021-02622-9
Lima J.V., Kater C.E. 2023. The Pheochromocytoma/Paraganglioma Syndrome: An Overview on Mechanisms, Diagnosis and Management. Int Braz J Urol. 49: 307–19. doi: 10.1590/S1677-5538.IBJU.2023.0038
Marcus C., Subramaniam R.M. 2023. Paragangliomas and Pheochromocytomas: Positron Emission Tomography/Computed Tomography Diagnosis and Therapy. PET Clin. 18: 233–42. doi: 10.1016/j.cpet.2022.11.006
Mete O., Asa S.L., Gill A.J., Kimura N., de Krijger R.R., Tischler A. 2022. Overview of the 2022 WHO Classification of Paragangliomas and Pheochromocytomas. Endocr Pathol. 33: 90–114. doi: 10.1007/s12022-022-09704-6
Mills K.T., Stefanescu A., He J. 2020. The Global Epidemiology of Hypertension. Nat Rev Nephrol. 16(4): 223–37. doi: 10.1038/s41581-019-0244-2
Nölting S., Bechmann N., Taieb D., Beuschlein F., Fassnacht M., Kroiss M., Graeme Eisenhofer G., Grossman A., Pacak K. 2022. Personalized Management of Pheochromocytoma and Paraganglioma. Endocr Rev. 43: 199–239. doi: 10.1210/endrev/bnab019
Passman J.E., Wachtel H. 2024. Management of Pheochromocytomas and Paragangliomas. Surg Clin North Am. 104:863–81. doi: 10.1016/j.suc.2024.02.014
Sarathy H., Salman L.A., Lee C., Cohen J.B. 2022. Evaluation and Management of Secondary Hypertension. Med Clin North Am. 106(2): 269–83. doi: 10.1016/j.mcna.2021.11.004
Schmiemann G., Gebhardt K., Hummers-Pradier E., Egidi G. 2012. Prevalence of Hyperaldosteronism in Primary Care Patients with Resistant Hypertension. J Am Board Fam Med. Jan-Feb; 25(1): 98–103. doi: 10.3122/jabfm.2012.01.110099
Sharma S., Fishbein L. 2023. Diagnosis and Management of Pheochromocytomas and Paragangliomas: A Guide for the Clinician. Endocr Pract. 29: 999–1006. doi: 10.1016/j.eprac.2023.07.027