Использование в комплексном лечении криосупернатантной фракции плазмы для коррекции тромбогеморрагического синдрома у септических больных
Aннотация
Гнойно-воспалительные заболевания широко распространены и составляют 1/3 всей хирургической патологии. Тяжелым жизнеугрожающим состоянием является развитие сепсиса, летальность при котором достигает 43 %. Цель исследования – сравнение динамики течения тромбогеморрагического синдрома при применении криосупернатантной фракции плазмы и свежезамороженной плазмы у больных с флегмонами и сепсисом. Сформировано 2 группы больных с флегмонами мягких тканей и сепсисом. В основной группе (34 пациента, 47,9 %) в составе криоплазменно-антиферментной терапии проводились трансфузии криосупернатантной фракции плазмы, а в группе сравнения (37 пациентов, 52,1 %) – свежезамороженной плазмы. Исследование показателей гемостаза указывало на наличие томбогеморрагического синдрома. Эффективность проводимой терапии оценивалась спустя 8–10 дней от ее начала. Дополнение комплексной терапии криосупернатантной фракцией плазмы способствует более эффективному купированию тромбогеморрагического синдрома по сравнению с применением свежезамороженной плазмы и улучшению результатов лечения, что проявляется в ускорении очищения ран и заполнения их грануляционной тканью на 3,7 суток, снижении летальности в 1,7 раз, отсутствии осложнений септического процесса тромботического или тромбоэмболического характера.
Введение
Гнойно-воспалительные заболевания мягких тканей широко распространены среди хирургических заболеваний. Тяжесть течения заболевания зависит от степени распространенности гнойно-некротических поражений и напрямую обуславливает количество осложнений [Аль-Канани и др., 2020; Баранцевич и др., 2020; Трубчанина и др., 2024; Malykh et al., 2024]. Тяжелым жизнеугрожающим состоянием, возникающим вследствие прогрессирования гнойно-воспалительного процесса, является развитие поражения органов и систем (полиорганная недостаточность), отдаленных от гнойных очагов, являющееся неотъемлемой частью сепсиса согласно критериям современной классификации Сепсис-3. Летальность при данном осложнении остается на достаточно высоком уровне (до 43 %), в виду чего не теряет актуальности и требует новых подходов в лечении [Руднов, Калабухов, 2016; Гоманова, 2020; Гоманова, Бражников, 2021; Гусев и др., 2021; Плоткин, 2021]. Данные изменения сопровождаются нарушением циркуляции крови в микрососудистом русле [Литвицкий, 2020; Iba et al., 2016; Levi, Scully, 2018] и обусловлены тромбогеморрагическим синдромом [Чирский и др., 2020; Куликов и др., 2022]. Эффективность коррекции тромбогмеррагического синдрома путем применения трансфузий свежезамороженной плазмы (СЗП) в составе криоплазменно-антиферментной терапии доказана при лечении флегмон [Цеймах и др., 2021]. Однако трансфузии свежезамороженной плазмы приводят к внутрисосудистому повышению факторов свертывания и изменению микроциркуляции, что требует обязательного совместного применения гепарина. Наряду с этим гепаринотерапия создает опасность возникновения «рикошетных» тромбозов, коагулопатии, кровотечений [Степанов и др., 2021; Цеймах и др., 2022]. На долю тромбогеморрагических осложнений в структуре хирургической патологии приходится 28–33 % случаев. Ряд зарубежных авторов отмечает лучший эффект при трансфузии криосупернатантной фракции плазмы в сравнении со свежезамороженной плазмой при лечении гематоуремического синдрома, тромбогеморрагической пурпуры и других заболеваний [Селиверстов и др., 2023]. Все выше перечисленное обусловило решение о возможности купирования тромбогеморрагического синдрома у септических больных на фоне распространенных флегмон мягких тканей путем применения трансфузии криосупернатантной фракции плазмы (КСНП) (методика получения разработана Елыкомовым В.А. и соавторами (1978 г) и заключается в удалении из СЗП криопреципитата) [Галстян и др., 2020] в составе криоплазменно-антиферментной терапии [Цеймах и др., 2024].
Цель исследования – сравнение динамики течения тромбогеморрагического синдрома при применении криосупернатантной фракции плазмы и свежезамороженной плазмы у больных с флегмонами и сепсисом.
Материалы и методы
Критериями отбора больных для исследования были наличие флегмоны мягких тканей и сепсиса. Место проведения исследования – отделение гнойной хирургии КГБУЗ «Городская больница № 8», г Барнаул, являющееся клинической базой ФГБОУ ВО АГМУ МЗ РФ. Численность больных – 71 человек.
Мужчин в исследовании было 47 (66,2 %), а женщин – 24 (33,8 %). Средний возраст 67 + 3,45 лет. Ограниченные флегмоны (1 анатомическая область) отмечены у 25 (35,2 %) пациентов, а распространенные (2 и более анатомических областей) – у 46 (64,8 %) пациентов. При вскрытии гнойный экссудат получен у 28 (39,4 %), гнилостный – у 3 (4,2 %), некротические изменения отмечены у 40 (56,3 %). В зависимости от глубины распространения гнойно-некротического процесса отмечены субфасциальные флегмоны у 20 (28,2 %) больных, межмышечные – у 49 (69 %) больных, забрюшинные –
у 2 (2,8 %) больных. Диагноз сепсиса выставлен на основании критериев классификации Сепсис-3 у всех больных. При бактериологическом исследовании крови на стерильность микрофлора из периферической крови выделена у 39 (55 %) больных. Наиболее частым возбудителем сепсиса является Staphylococcus aureus, однако высока и доля Гр-флоры, она составила 13 (33,3 %) случаев, что представлено на рисунке 1.
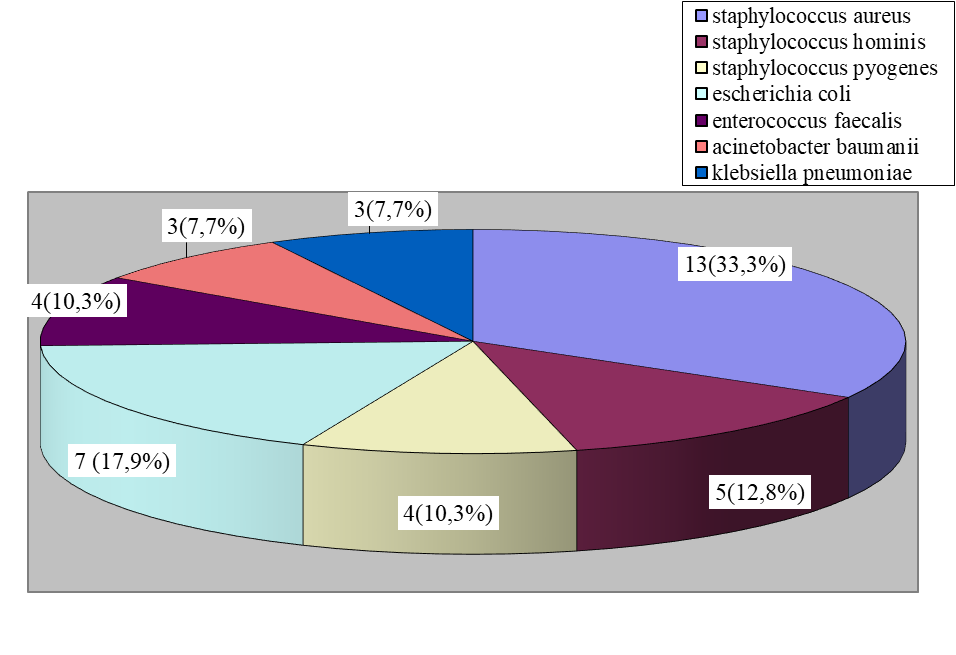
Рис. 1. Характер микрофлоры, выделенной из периферической крови у септических больных на фоне флегмон мягких тканей
Fig. 1. The nature of the microflora isolated from peripheral blood in septic patients against the background of phlegmon of soft tissues
При этом в 25 (64,1 %) случаях выделялись микроорганизмы, чувствительные к антибиотикам, а в 14 (35,9 %) случаях – резистентные. Наиболее часто встречаемые осложнения септического процесса были: стафилококковая деструкция легких и плевры у 19 (26,8 %) больных, гематогенный остеомиелит – у 7 (9,9 %), метастатические абсцессы мягких тканей, печени, почек – у 13 (18,3 %), медиастенит (передний и задний) – у 6 (8,4 %), кровотечения из острых язв желудочно-кишечного тракта – у 9 (12,7 %), бактериальный эндокардит – у 5 (7 %). Обе группы были полностью сопоставимы по гендерным признакам, имеющимся осложнениям септического процесса, характеру проведенных операций у больных. Диагностические мероприятия, проводимые у больных при поступлении и в процессе лечения, носили комплексный характер и включали углубленное изучение изменений в системе гемокоагуляции и фибринолиза:
- Общие коагуляционные тесты:
- активированное частичное тромбопластиновое время (АЧТВ);
- протромбиновое время (ПТВ).
- Тесты конечного этапа свертывания:
- фибриноген;
- тромбиновое время (ТВ).
- Физиологические антикоагулянты:
- антитромбин III (АТ III).
- Показатели фибринолиза:
- XIIa-калликреинзависимый фибринолиз (XIIa-ЗФ).
- Показатели уровня тромбинемии:
- ортофенатролиновый тест (ОФТ).
- Показатели уровня продуктов деградации фибриногена:
- Д-димер.
- Показатели сосудисто-тромбоцитарного гемостаза:
- уровень тромбоцитов.
Первоочередным мероприятием, проводившимся при поступлении, было вскрытие и дренирование флегмоны мягких тканей с обязательным назначением антибактериальной терапии, инфузионной (дезинтоксикационной) терапии, криоплазменно-антиферментной терапии (трансфузии КСНП/СЗП, гепарин, ингибиторы протеиназ), адекватного обезболивания, а при необходимости – блокаторов протонной помпы, физиолечения и нутритивной поддержки.
Выделено 2 группы больных:
- Основная группа (34 пациента, (47,9 %) – больные с флегмонами мягких тканей и сепсисом, у которых в составе криоплазменно-антиферментной терапии проводились трансфузии криосупернатантной фракции плазмы.
- Группа сравнения (37 пациентов, 52,1 %) – больные с флегмонами мягких тканей и сепсисом, у которых в составе криоплазменно-антиферментной терапии проводились трансфузии свежезамороженной плазмы.
Статистическая достоверность подтверждалась посредствам программы STATISTICA – 7.0.
Результаты исследования
Показатели системы гемокоагуляции и фибринолиза отчетливо указывали на развитие тромбогеморрагического синдрома при септическом течении воспалительного процесса. Данные общих коагуляционных тестов, представленные на рисунках 2 и 3, и тестов конечного этапа свертывания на рисунках 4 и 5 указывали на наличие у больных гиперкоагуляционного синдрома.
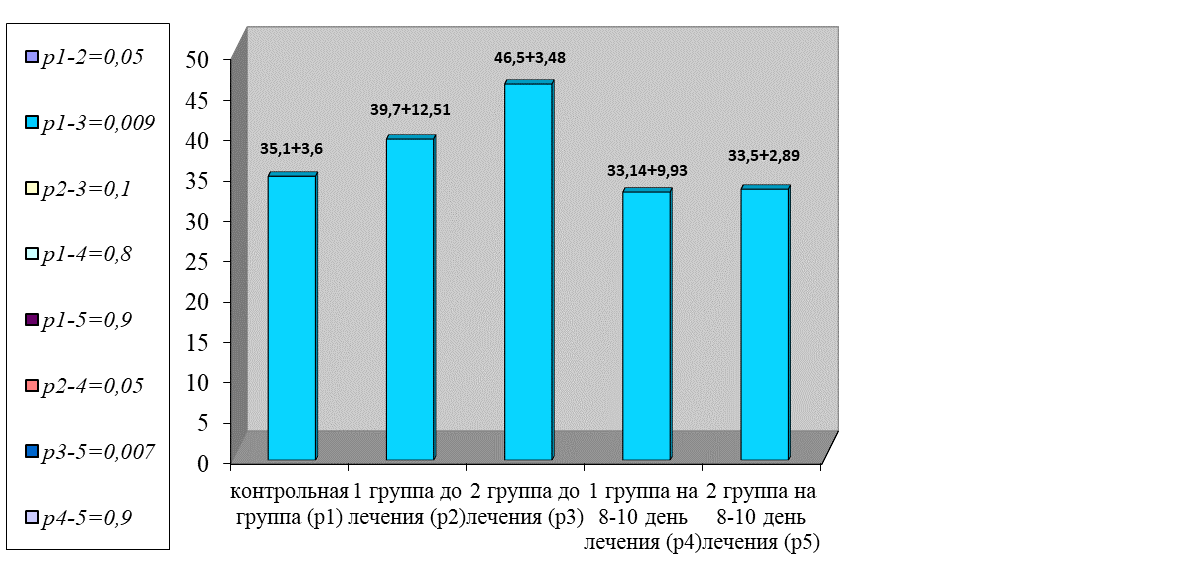
Рис. 2. Динамика изменения активированного частичного тромбопластинового времени
Fig. 2. Dynamics of changes in activated partial thromboplastin time
Нарастание АЧТВ в обеих группах отмечено в одинаковой мере и превышало показатели в контрольной группе в среднем в 1,2 раза (р = 0,05).
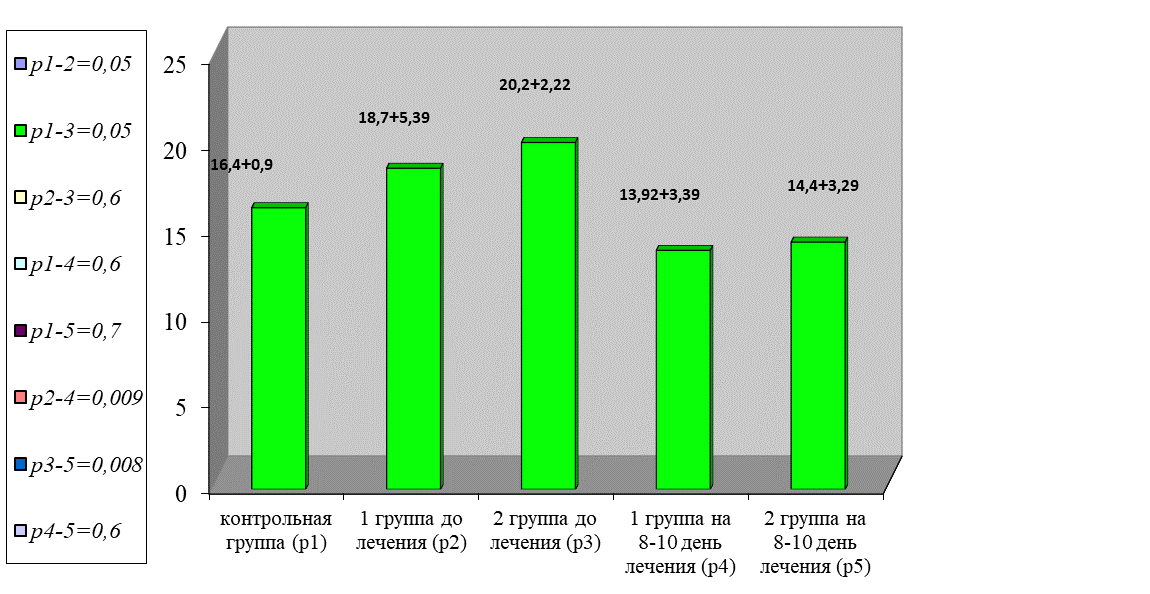
Рис. 3. Динамика изменения протромбинового времени
Fig. 3. Dynamics of changes in prothrombin time
Увеличение показателей ПТВ в обеих группах превышало показатели в контрольной группе в среднем в 1,2 раза (р = 0,05).
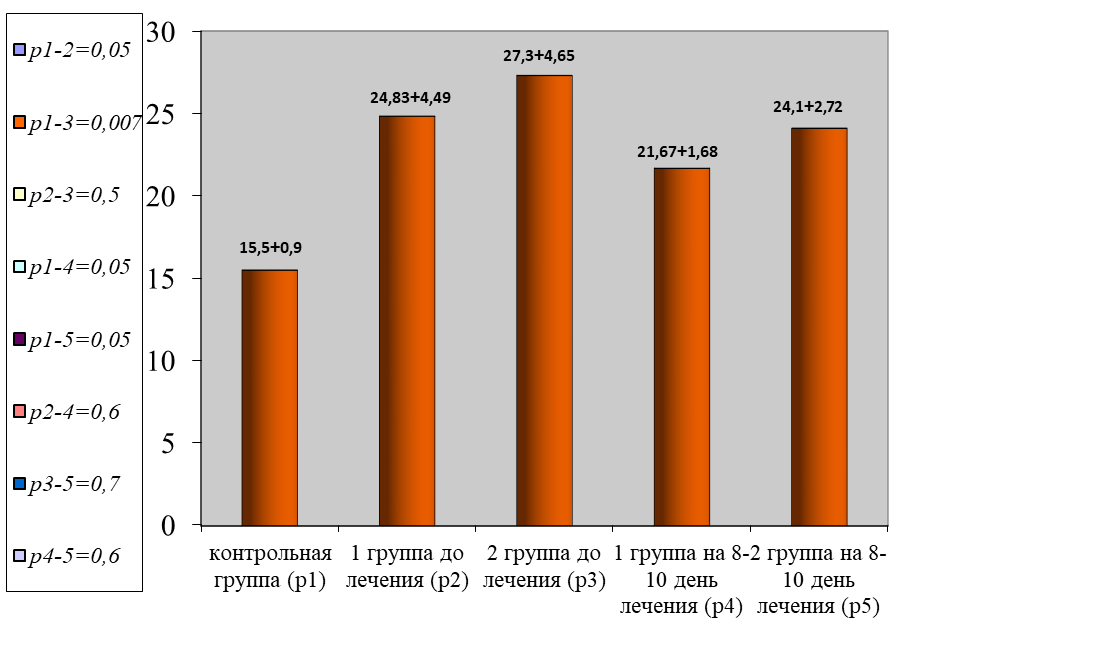
Рис. 4. Динамика изменения тромбинового времени
Fig. 4. Dynamics of thrombin time changes
Показатели ТВ в обеих группах превышали показатели в контрольной группе в среднем в 1,2 раза (р = 0,05). Так, наиболее выражено было нарастание фибриногенемии. Уровень фибриногена у больных превышал данный показатель в контрольной группе в 2,8 раза (р = 0,006).
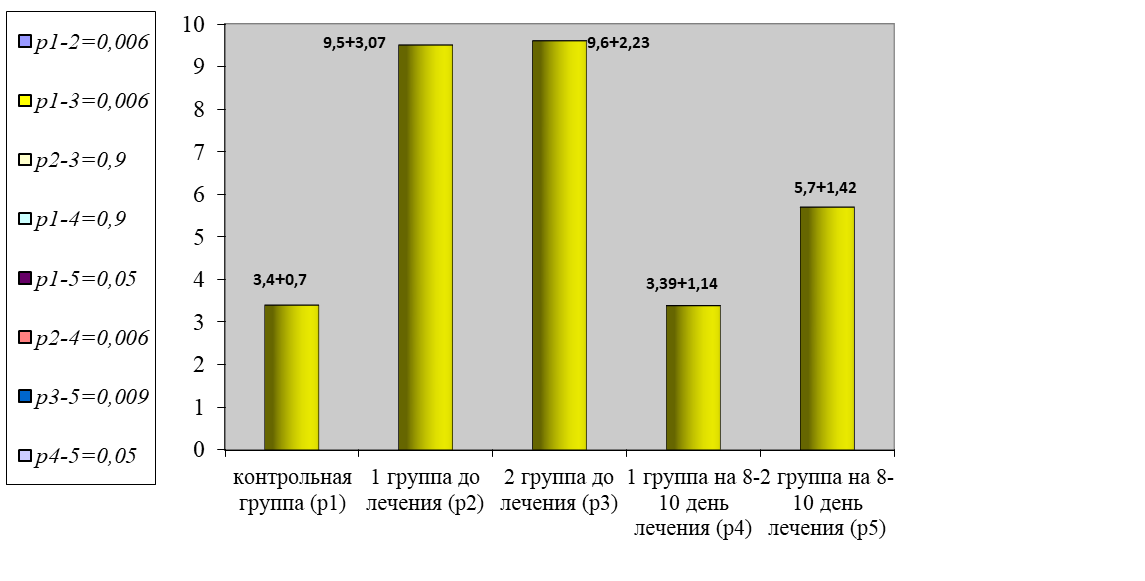
Рис. 5. Показатели уровня фибриногена
Fig. 5. Fibrinogen level indicators
Отмечено падение физиологических антикоагулянтов по данным АТ III в 1,6 раза в сравнении с показателями контрольной группы (р < 0,001), рисунок 6.
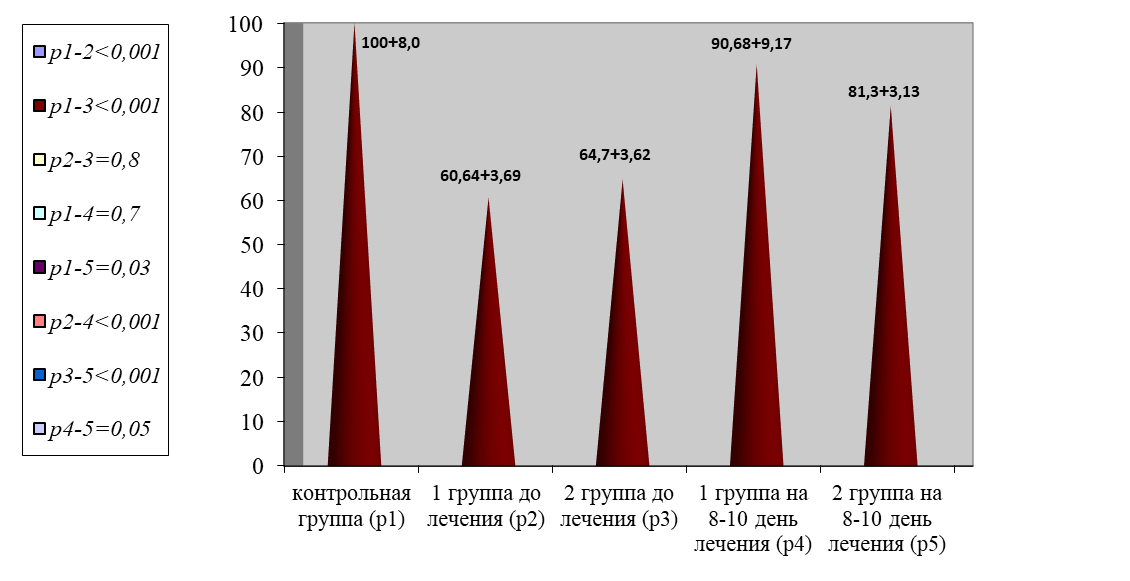
Рис. 6. Динамика изменения уровня антитромбина III
Fig. 6. Dynamics of changes in antithrombin III levels
Так же отмечена депрессия фибринолиза. Так, по данным XIIa-ЗФ, отмечено увеличение показателей в обеих группах в 7,8 раза в сравнении с нормой (р < 0,001), рисунок 7.
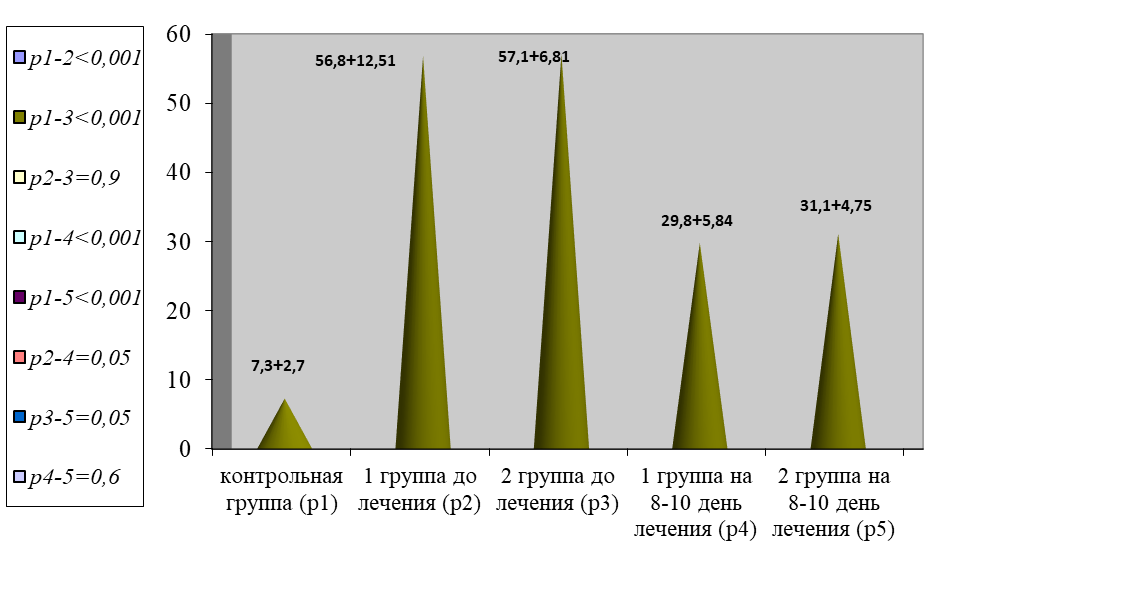
Рис. 7. Динамика изменения показателей фибринолиза
Fig. 7. Dynamics of changes in fibrinolysis indices
Наряду с этим прослеживалась выраженная тромбинемия. По данным ОФТ, отмечено нарастание показателей в обеих группах в 5,7 раза в сравнении с нормой (р < 0,001), рисунок 8.
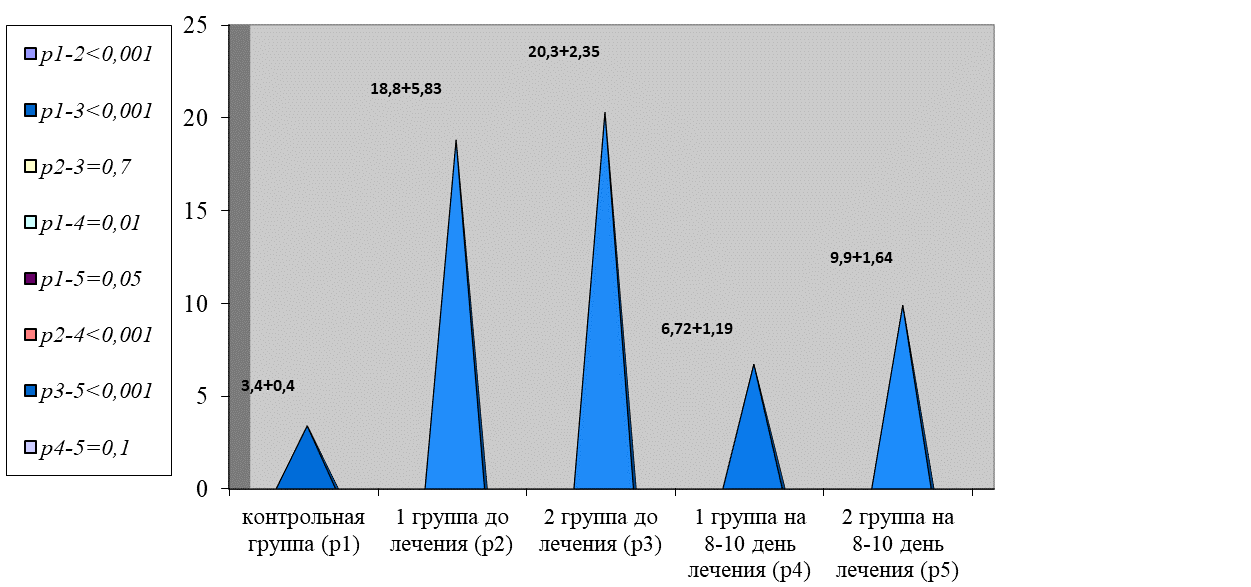
Рис. 8. Динамика изменения показателей тромбинемии
Fig. 8. Dynamics of changes in thrombinemia parameters
По данным показателей деградации фибрина отмечено нарастание Д-димера в 95 раз в сравнении с контрольной группой (р < 0,001), рисунок 9.
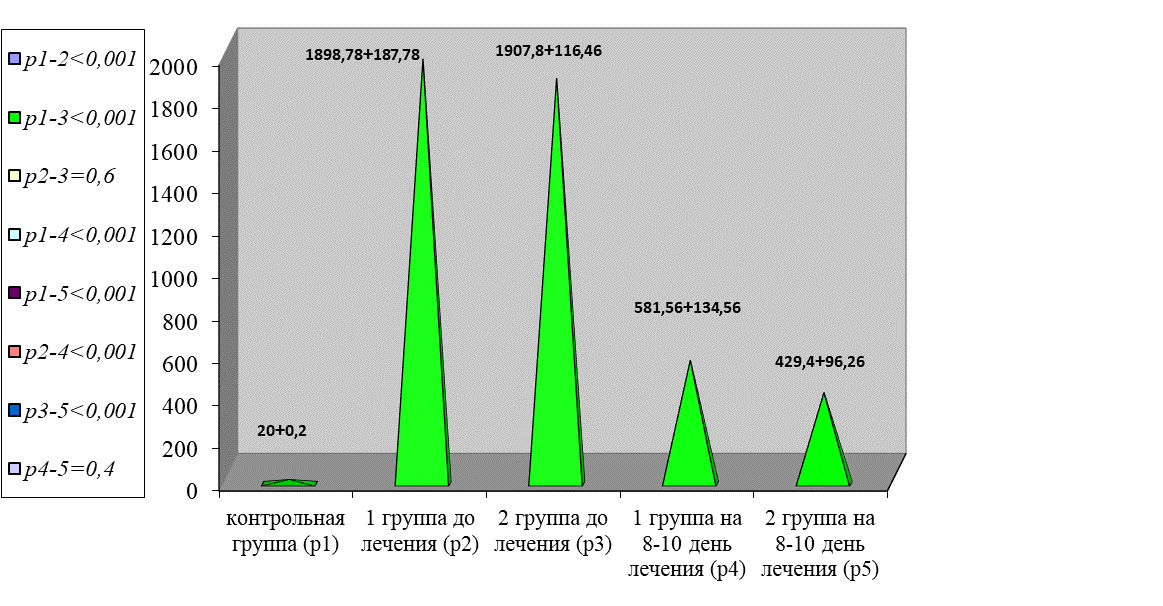
Рис. 9. Динамика изменения показателей уровня продуктов деградации фибрина
Fig. 9. Dynamics of changes in indicators of the level of fibrin degradation products
А количество тромбоцитов увеличивалось в 1,8 раз в сравнении с нормой (р = 0,05), что представлено на рисунке 10.
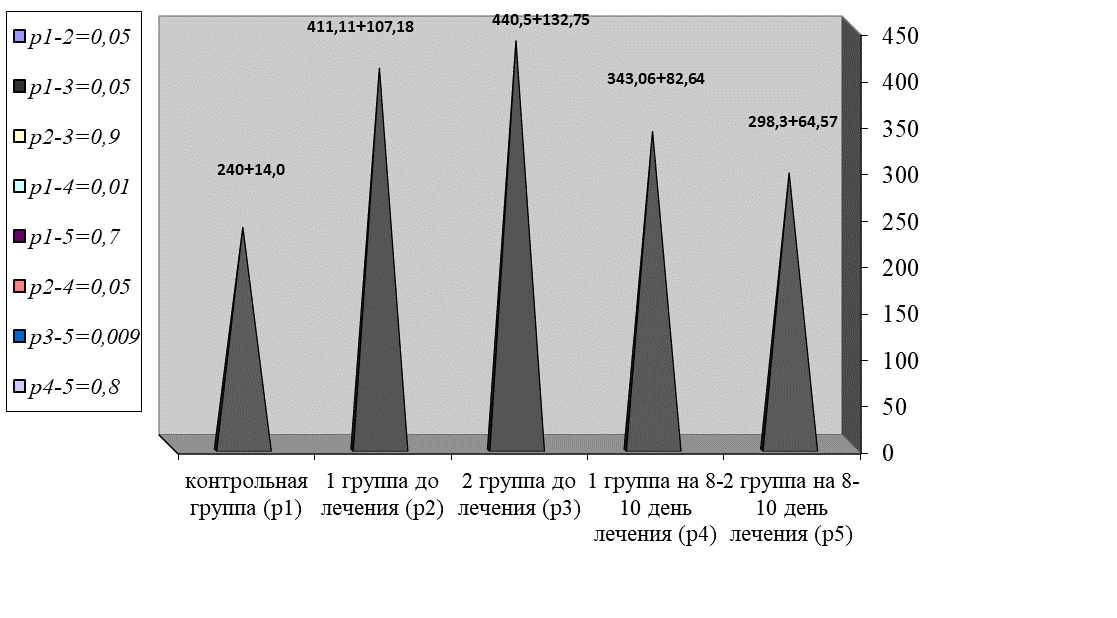
Рис. 10. Динамика изменения уровня тромбоцитов
Fig. 10. The dynamics of changes in platelet levels
Следствием нарастающего тромбогеморрагического синдрома является нарушение микроциркуляции за счет изменения реологии крови, которое непосредственно препятствует достаточному поступлению лекарственных препаратов (антибиотики и так далее) в зоны гнойно-воспалительного процесса и зоны отдаленных поражений (паренхиматозные органы). В свою очередь, это приводит к нарастанию протеолиза в этих зонах. Для подавления тромбогеморрагического синдрома и, как следствие, эффективному деблокированию микроциркуляции, в комплексное лечение была введена криоплазменно-антиферментная терапия (переливание СЗП либо КСНП, гепарин, ингибиторы протеолиза).
Эффективность проводимой терапии оценивалась спустя 8–10 дней от ее начала. При этом при использовании КСНП отмечено более выраженное улучшение по ряду показателей системы гемокоагуляции и фибринолиза. Уровень фибриногена в основной группе был в пределах нормы и ниже, чем в группе сравнения, на 2,31 г/л (р = 0,05). Уровень антитромбина III был в пределах нормы в обеих группах, однако в основной группе он был выше на 9,4 %, чем в группе сравнения (р = 0,05). Наблюдалась отчетливая тенденция к купированию тромбинемии в обеих группах, однако наряду с этим в основной группе показатель ортофенантролинового теста практически входил в предел нормальных значений и был ниже на 3,18 мн/100мл, чем в группе сравнения (р = 0,05), что показано на расположенных выше рисунках 2–10.
Анализ течения раневого процесса показал улучшение динамики его течения при применении криосупернатантной плазмы в сравнении со свежезамороженной. Так, за счет улучшения микроциркуляции вследствие купирования тромбогеморрагического синдрома отмечалось в основной группе отсутствие некрозов на 2,2 суток раньше (р = 0,05) и заполнение грануляционной тканью ран – на 3,7 суток быстрее (р = 0,009), чем в группе сравнения. Наряду с этим отрицательный бактериологический посев из раны был получен в первой группе на 2,2 суток быстрее, чем во второй группе (р = 0,05), рисунок 11.
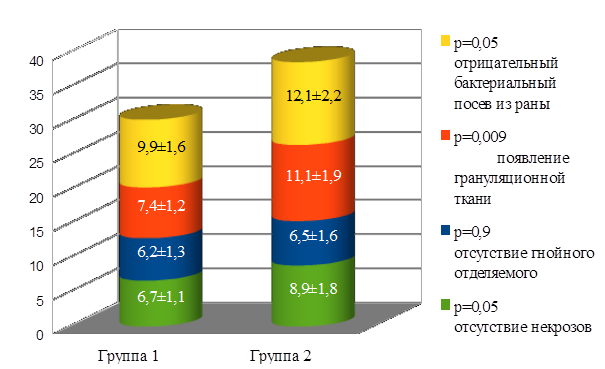
Рис. 11. Динамика купирования местных изменений гнойно-воспалительного процесса у септических больных с флегмонами мягких тканей
Fig. 11. Dynamics of relief of local changes in the purulent-inflammatory process in septic patients with phlegmon of soft tissues
При анализе клинических исходов заболевания у больных в основной группе отмечено в 1,7 раз меньше количества умерших пациентов (р = 0,04), рисунок 12.
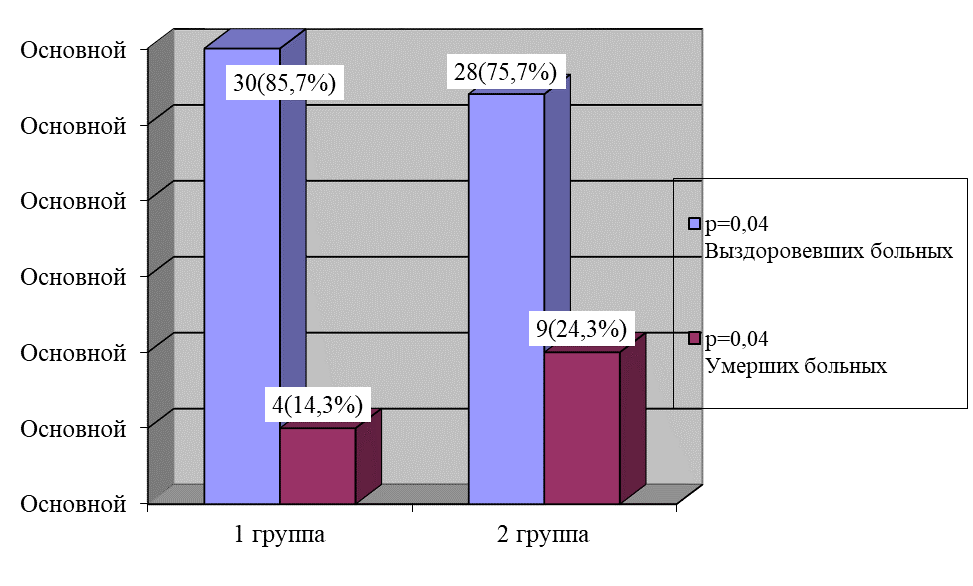
Рис. 12. Клинические исходы заболевания у септических больных
Fig. 12. Clinical outcomes of the disease in septic patients
При этом количество случаев септического шока как непосредственной причины смерти в обеих группах было практически одинаковым, а количество случаев прогрессирования полиорганной недостаточности в первой группе было в 1,9 раз ниже, чем во второй группе (р = 0,04), и не наблюдалось осложнений тромботического и тромбоэмболического характера (р = 0,05), рисунок 13.
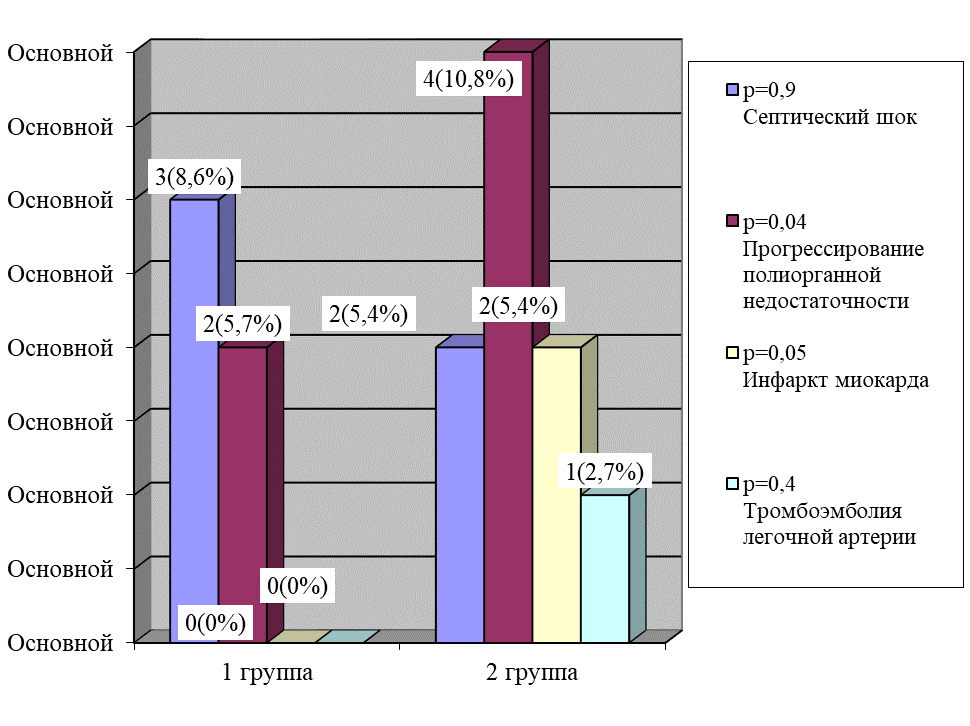
Рис. 13. Основные причины, приведшие к смерти больного
Fig. 13. The main causes that led to the death of the patient
Обсуждение
На сегодняшний день, согласно литературным источникам, базовой терапией сепсиса остается трансфузия СЗП. Имеются данные об успешном применении КСНП. Однако нет четких данных о дифференцированном применении компонентов криоплазменно-антиферментного комплекса и показаний к его применению [Галстян и др., 2020; Селиверстов и др., 2023].
Как известно, ДВС-синдром имеет следующие стадии: гиперкоагуляцию и гипокоагуляцию. В стадии гипокоагуляции в виду выраженного дефицита компонентов системы гемостаза, в том числе факторов свертывания, создаются условия для возможности возникновения профузных кровотечений, при этом применение в составе криоплазменно-антиферментного комплекса трансфузии СЗП способствует восполнению недостающих компонентов [Цеймах и др., 2021]. В стадию гиперкоагуляции отмечается дефицит компонентов системы гемостаза при сохранении факторов свертывания, что создает условия для повышения внутрисосудистого свертывания, а трансфузии СЗП могут усилить тромботический потенциал. КСНП лишена факторов свертывания и не вызывает повышения агрегации, тем самым способствует более эффективному купированию тромбогеморрагического синдрома.
При сравнении эффективности применения в комплексном лечении больных флегмонами мягких тканей и сепсисом криосупернатантной плазмы и свежезамороженной плазмы отмечены более лучшие результаты лечения в 1 группе. По данным показателей системы гемокоагуляции и фибринолиза, в обеих группах отмечена тенденция к нормализации показателей, однако при применении криосупернатантной плазмы она была более выраженной. Изучение эффективности применения КСНП и СЗП у больных с воспалительными заболеваниями мягких тканей и сепсисом позволит более эффективно воздействовать на тромбогеморрагический синдром за счет дифференцированного применения компонентов криоплазменно-антиферментного комплекса в зависимости от стадии ДВС-синдрома.
Вывод
Дополнение комплексной терапии трансфузиями криосупернатантной фракции плазмы у септических больных на фоне распространенных флегмон мягких тканей способствует более эффективному купированию тромбогеморрагического синдрома по сравнению с применением свежезамороженной плазмы и способствует улучшению результатов лечения, что проявляется в улучшении динамики течения раневого процесса, снижении летальности, профилактике осложнений септического процесса тромботического или тромбоэмболического характера.





Список литературы
Аль-Канани Э.С., Куликовский В.Ф., Гостищев В.К., Ярош А.Л., Карпачев А.А., Солошенко А.В., Жарко С.В., Линник М.С. 2020. Лечение гнойной инфекции мягких тканей: от истории к настоящему (литературный обзор). Актуальные проблемы медицины. 43(1): 155–164. doi: 10.18413/2687-0940-2020-43-1-155-164
Баранцевич Е.Р., Баринов А.Н., Воробьева О.В., Казюлин А.Н., Страхов М.А. 2020. Междисциплинарная проблема воспаления. Consilium Medicum. 22(9): 96–101 doi: 10.26442/20751753.2020.9.200453
Галстян Г.М., Гапонова Т.В., Шерстнев Ф.С., Купряшов А.А., Оловникова Н.И., Зозуля Н.И., Троицкая В.В, Мазурок В.А., Певцов Д.Э., Салимов Э.Л., Трахтман П.Е., Савченко В.Г. 2020. Клиническое использование криосупернатантной плазмы. Гематология и трансфузиология. 65(3): 351–359. https://doi.org/10.35754/0234-5730-2020-65-3-351-359
Гоманова Л.И., Бражников А.Ю. 2021. Сепсис в XXI веке: этиология, факторы риска, эпидемиологические особенности, осложнения, профилактика. Эпидемиология и Вакцинопрофилактика. 20(3): 107–117. https://doi.org/10.31631/2073-3046-2021-20-3-107-117
Гоманова Л.И. 2020. «Септический шок: перспективные методы диагностики и лечения на основе иммунопатогенеза». Медицинская иммунология. 22(3): 459–472. doi: 10.15789/1563-0625-SSP-1862
Гусев Е.Ю., Зотова Н.В., Черешнев В.А. 2021. «Сепсис-3»: новая редакция – старые проблемы. Анализ с позиции общей патологии. Инфекция и иммунитет. 11(4): 649–662. doi: 10.15789/2220-7619-SAN-1629
Куликов А.В., Шифман Е.М., Проценко Д.Н., Заболотских И.Б., Овезов А.М., Ройтман Е.В., Артымук Н.В., Астахов А.А., Белокриницкая Т.Е., Роненсон А.М., Гороховский В.С., Матковский А.А., Распопин Ю.С., Рязанова О.В., Пылаева Н.Ю. 2022. Диагностика и интенсивная терапия синдрома диссеминированного внутрисосудистого свертывания крови при массивной кровопотере в акушерстве (методические рекомендации). Анестезиология и реаниматология. (2): 5–23. https://doi.org/10.17116/anaesthesiology20220215
Литвицкий П.Ф. 2020. Нарушения регионарного кровотока и микроциркуляции. Регионарное кровообращение и микроциркуляция. 19(1): 82–92.
Плоткин Л.Л. 2021. Рефрактерный септический шок (часть 1). Вестник анестезиологии и реаниматологии. 18(2): 77–83. https://doi.org/10.21292/2078-5658-2021-18-2-77-83
Руднов В.А., Калабухов В.В. 2016. Сепсис-3: обновленные ключевые положения, потенциальные проблемы и дальнейшие практические шаги. Вестник анестезиологии и реанимации. 13(4): 4–11. https://doi.org/10.21292/2078-5658-2016-13-4-4-11
Селиверстов Е.И., Лобастов К.В., Илюхин Е.А., Апханова Т.В., Ахметзянов Р.В., Ахтямов И.Ф., Баринов В.Е., Бахметьев А.С., Белов М.В., Бобров С.А., Божкова С.А., Бредихин Р.А., Булатов В.Л., Вавилова Т.В., Варданян А.В., Воробьева Н.А., Гаврилов Е.К., Гаврилов С.Г., Головина В.И., Горин А.С., Дженина О.В., Дианов С.В., Ефремова О.И., Жуковец В.В., Замятин М.Н., Игнатьев И.А., Калинин Р.Е., Камаев А.А., Каплунов О.А., Каримова Г.Н., Карпенко А.А., Касимова А.Р., Кательницкая О.В., Кательницкий И.И., Каторкин С.Е., Князев Р.И., Кончугова Т.В., Копенкин С.С., Кошевой А.П., Кравцов П.Ф., Крылов А.Ю., Кульчицкая Д.Б., Лаберко Л.А., Лебедев И.С., Маланин Д.А., Матюшкин А.В., Мжаванадзе Н.Д., Моисеев С.В., Муштин Н.Е., Николаева М.Г., Пелевин А.В., Петриков А.С., Пирадов М.А., Пиханова Ж.М., Поддубная И.В., Порембская О.Я., Потапов М.П., Пырегов А.В., Рачин А.П., Рогачевский О.В., Рябинкина Ю.В., Сапелкин С.В., Сонькин И.Н., Сорока В.В., Сушков С.А., Счастливцев И.В., Тихилов Р.М., Трякин А.А., Фокин А.А., Хороненко В.Э., Хруслов М.В., Цатурян А.Б., Цед А.Н., Черкашин М.А., Чечулова А.В., Чуйко С.Г., Шиманко А.И., Шмаков Р.Г., Явелов И.С., Яшкин М.Н., Кириенко А.И., Золотухин И.А., Стойко Ю.М., Сучков И.А. 2023. Профилактика, диагностика и лечение тромбоза глубоких вен. Рекомендации российских экспертов. Флебология. 17(3): 152–296. https://doi.org/10.17116/flebo202317031152
Степанов Е.А., Курашвили Л.В., Микуляк Н.И., Моисеев Я.П., Кинзирский А.С. 2021. Особенности микроциркуляции в пародонте при различных системных заболеваниях. Известия высших учебных заведений. Поволжский регион. Медицинские науки. (2): 137–150. doi:10.21685/2072-3032-2021-2-13
Трубчанина Ю.А., Земскова В.А., Бережнова Т.А., Дядина К.С., Лунёва Е.А., Земсков А.М. 2024. Повышение клинико-лабораторной эффективности базового лечения гнойной инфекции мягких тканей за счет комплекса метаболика с поливалентной системной иммунотерапией. Наука молодых (Eruditio Juvenium). 12(2): 165–174. doi: 10.23888/HMJ2024122165-174
Цеймах Е.А., Зинченко В.Ю., Лавриненко О.Ю., Калашников А.В., Шалабод Е.А. 2024. Применение криосупернатантной фракции плазмы в комплексном лечении больных распространенными флегмонами мягких тканей, осложненных сепсисом. Бюллетень медицинской науки. 1(33): 29–38. https://doi.org/10.31684/25418475-2024-1-29
Цеймах Е.А., Зинченко В.Ю., Лавриненко О.Ю., Черненко В.В., Калашников А.В., Цеймах М.Е., Шалабод Е.А. 2021. Устранение микроциркуляторных нарушений в комплексном лечении больных сепсисом. Бюллетень медицинской науки. 2(22): 78–88. doi.org/10.31684/25418475_2021_2_78
Цеймах Е.А., Зинченко В.Ю., Лавриненко О.Ю., Черненко В.В., Калашников А.В., Шалабод Е.А., Цеймах М.Е. 2022. Коррекция тромбогеморрагического синдрома у больных распространёнными флегмонами мягких тканей и сепсисом. Research'n Practical Medicine Journal. 9(1): 77–90. https://doi.org/10.17709/2410-1893-2022-9-1-7
Чирский В.С., Андреева Е.А., Юзвинкевич А.К., Гайворонский И.В. 2020. Патологоанатомическая характеристика септического шока в условиях современной терапии. Журнал анатомии и гистопатологии. 9(1): 69–76. https://doi.org/10.18499/2225-7357-2020-9-1-69-76
Malykh M.S., Mellin R.V., Tiunova N.V., Ziatdinov B.R., Moiseev D.A., Tatarkin V.V., Karpova E.I., Vdovina L.V., Bakhmet A.A., Васильев Ю.Л. 2024. Клинико-анатомическое обоснование эффективности лечения флегмон дна полости рта и глубоких клетчаточных пространств шеи, осложненных сепсисом. Оперативная хирургия и клиническая анатомия (Пироговский научный журнал). 8(2): 19–25. https://doi.org/10.17116/operhirurg2024802119
Iba T., Gando S., Saitoh D., Wada H., Di Nisio M., Thachil J. 2016. Antithrombin Supplementation and Risk of Bleeding in Patients with Sepsis-Associated Disseminated Intravascular Coagulation. Thromb. Res. 145: 46–50. https://doi.org/10.1016/j.thromres.2016.07.016
Levi M., Scully M. 2018. How I Treat Disseminated Intravascular Coagulation. Blood. 131(8): 845–854. doi:10.1182/blood-2017-10-804096