Объемная фракция интерстициального коллагена миокарда у пациентов со стабильной стенокардией напряжения: связь с состоянием коронарного русла и глобальной продольной деформацией левого желудочка
Aннотация
Цель исследования – оценить объемную фракцию интерстициального коллагена миокарда у пациентов со стабильной стенокардией напряжения в зависимости от состояния коронарного русла и изучить связь с показателем глобальной продольной деформации левого желудочка. Обследовано 63 мужчины с ишемической болезнью сердца: стабильной стенокардией напряжения и сохраненной систолической функцией левого желудочка (фракция выброса левого желудочка более 50 % (метод Симпсона)). На момент исследования у всех пациентов регистрировался синусовый ритм сердца. Коронарография проводилась по стандартной методике. Показатель глобальной продольной деформации левого желудочка оценивался с использованием технологии спекл-трекинг при эхокардиографии. На основании показателя массы миокарда левого желудочка, показателя общего вольтажа комплексов QRS в двенадцати стандартных отведениях электрокардиографии и показателя роста пациента производился расчёт объемной фракции интерстициального коллагена миокарда левого желудочка. Установлено, что у пациентов с ишемической болезнью сердца: стабильной стенокардией напряжения и сохраненной систолической функцией левого желудочка степень интерстициального фиброзирования миокарда левого желудочка, оцененная по показателю объемной фракции интерстициального коллагена миокарда, зависит от степени стеноза коронарных артерий. В группе пациентов с умеренным атеросклеротическим поражением коронарных артерий (стеноз 21–70 %) установлена прямая статистически значимая средней силы корреляционная связь (r = 0,56, р = 0,039) между этими показателями, в группе пациентов с выраженным поражением коронарных артерий (стеноз ≥71 %) выявлена еще более тесная статистически значимая корреляционная связь (r = 0,63, р = 0,031). При прогрессировании атеросклеротического процесса в коронарных артериях степень фиброзирования миокарда левого желудочка увеличивается, что ассоциируется с усилением нарушения глобальной продольной систолической деформации левого желудочка.
Ключевые слова: стабильная стенокардия напряжения, объемная фракция интерстициального коллагена миокарда левого желудочка, глобальная продольная деформация левого желудочка, коронарография, стеноз коронарных артерий
Введение
Распространенность ишемической болезни сердца (ИБС) и ее осложнений, несмотря на некоторое снижение смертности от сердечно-сосудистых заболеваний в последние годы, остается высокой. Самой частой формой ИБС в популяции является стенокардия, причем с возрастом частота ее встречаемости увеличивается [Усачева и др., 2021; Бойцов, 2022].
В последние годы при изучении патофизиологических процессов ремоделирования миокарда вектор интересов сместился с изучения кардиомиоцитов на исследование внеклеточного матрикса, что инициировало активное проведение научных изысканий в этом направлении. Показано, что в перестройке внеклеточного матрикса центральным звеном является нарушение баланса обмена коллагена. Причем для хронических форм ИБС более характерен диффузный фиброз, который формируется в интерстициальном или периваскулярном пространстве миокарда, потерей количества функционирующих клеток миокарда это не сопровождается, но все же оказывает на них негативное воздействие [Гордеева и др., 2022; Schimmel et al., 2022]. Установлено, что фиброзирование внеклеточного матрикса миокарда может изменять контрактильность и биофизические свойства миокарда, которые можно оценить различными методами инструментальной диагностики, не прибегая к инвазивным методикам [Тарасова и др., 2023; Пономарева, Смирнова, 2024; Fan et al., 2020].
Представляет интерес уточнение степени выраженности фиброзных изменений у пациентов с ИБС в зависимости от состояния коронарного русла и выявление возможных статистически значимых связей с показателями инструментальных методов обследования. В связи с этим целью исследования стала оценка объемной фракции интерстициального коллагена миокарда у пациентов со стабильной стенокардией напряжения в зависимости от состояния коронарного русла и изучение связи с показателем глобальной продольной деформации левого желудочка.
Материалы и методы
На базе 2 кардиологического отделения ФГБУ «Клиническая больница № 1» УДП РФ обследовано 63 пациента-мужчины с ишемической болезнью сердца: стабильной стенокардией напряжения и сохраненной систолической функцией левого желудочка (фракция выброса левого желудочка (ФВ ЛЖ) более 50 % (метод Симпсона)). На момент исследования у всех пациентов регистрировался синусовый ритм сердца. Критериями исключения из исследования были возраст старше 65 лет, инфаркт миокарда в анамнезе, нестабильная стенокардия давностью менее 6 месяцев, кардиохирургическое лечение в анамнезе, врожденные пороки сердца, степень стенозирования коронарных артерий менее 20 % по данным коронарографии, злокачественные новообразования, острые инфекционные и воспалительные процессы и/или хронические воспалительные процессы в стадии обострения, эндокринная патология (в стадии декомпенсаци, прием глюкокортикоидов), заболевания почек с нарушением их функции (снижение скорости клубочковой фильтрации менее 60 мл/мин / 1,73 м2); заболевания печени с нарушением ее функций (повышение уровней печеночных ферментов в 3 раза и более), аутоиммунные заболевания, системные заболевания соединительной ткани.
Диагноз устанавливался в соответствии с клиническими рекомендациями «Стабильная ишемическая болезнь сердца» (2024 год) Министерства здравоохранения Российской Федерации и формулировался по Международной классификации болезней (МКБ-10, Женева, 1992 год). Функциональный класс стенокардии устанавливался по классификации Канадского кардиологического общества (1976 год). Диагноз ХСН устанавливался в соответствии с клиническими рекомендациями «Хроническая сердечная недостаточность» (2024 год) Министерства здравоохранения Российской Федерации. С использованием классификации Нью-Йоркской ассоциации кардиологов (New York Heart Association) (1994 год) оценивали тяжесть хронической сердечной недостаточности.
Все пациенты давали информированное добровольное согласие на включение в исследование.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации, протокол исследования был одобрен Этическим комитетом.
Коронарография проводилась на установке Siemens Artis Zee (Германия) по стандартной методике [Абдрахманова и др., 2020; Миронова и др., 2023]. За 1 день до коронарографии проводилась эхокардиография (ЭХОКГ) по стандартной методике на аппарате Philips EPIQ 7 (США), с использованием технологии спекл-трекинг оценивался показатель глобальной продольной деформации левого желудочка (GLS) [Мухаметгареева и др., 2020].
Расчёт объемной фракции интерстициального коллагена в миокарде (ОФИК) производился по формуле, разработанной Shirani J. и соавторами, с использованием показателя массы миокарда левого желудочка (расчёт по формуле Penn Convention по данным ЭХОКГ), показателя общего вольтажа комплексов QRS в двенадцати стандартных отведениях (по данным ЭКГ) и показателя роста пациента:
где ОФИК – объемная фракция интерстициального коллагена, ММЛЖ – масса миокарда ЛЖ.
Референсный диапазон ОФИК составил 2–6 % [Shirani et al., 1992].
Программа STATISTICA 12.0. применялась для статистической обработки данных. В виде значения медианы (Ме) и интерквартильного размаха (от 5 процентиля до 95 процентиля) в результатах исследования приводились полученные в исследовании показатели. Проверка статистических гипотез при сравнении числовых данных двух несвязанных групп производилась с использованием критерия Манна – Уитни (U-критерий). Расчет рангового коэффициента корреляции Спирмена (r) позволял определить интенсивность корреляционной связи. Сравнение качественных показателей в группах производилось при помощи расчета хи-квадрата (χ2) Пирсона.
Результаты и их обсуждение
Для достижения поставленной цели все пациенты в зависимости от степени стеноза коронарных артерий были разделены на две группы: 24 пациента (1 группа) с умеренным атеросклеротическим поражением коронарных артерий (стеноз 21–70 %) и 39 пациентов (2 группа) с выраженным поражением коронарных артерий (стеноз ≥71 %). В таблице 1 представлена краткая сравнительная клиническая характеристика групп пациентов. Приведенные в таблице 1 данные демонстрируют отсутствие статистически значимых различий по сравниваемым показателям.
Таблица 1
Table 1
Клиническая характеристика пациентов исследуемых групп
Clinical characteristics of patients in the study groups
Показатель | 1 группа | 2 группа |
Возраст, годы | 56,4 [48; 63] | 57,8 [48; 64] |
Длительность анамнеза ИБС, годы | 3,5 [2; 5] | 3,8 [2; 6] |
ФК стенокардии | ||
2, n (%) | 21 (87,5 %) | 27 (69 %) |
Показатель | 1 группа | 2 группа |
3, n (%) | 3 (12,5 %) | 12 (31 %) |
Стадия ХСН | ||
I–II A, n (%)* | 20 (95 %) | 36 (92 %) |
II Б–III, n (%) | 1 (5 %) | 3 (8 %) |
ФК ХСН (NYHA) | ||
II, n (%) | 19 (90 %) | 32 (82 %) |
III, n (%) | 2 (10 %) | 6 (18 %) |
Примечание: р1 – уровень статистической значимости различий с 1 группой.
Представленные в таблице 2 данные демонстрируют статистически значимую разницу по показателю ОФИК в сравниваемых группах. В группе пациентов с выраженным поражением коронарных артерий показатель ОФИК был статистически значимо выше, чем в группе пациентов с умеренным атеросклеротическим поражением коронарных артерий (р = 0,019). При этом в обеих группах он превышал референсные значения (2–6 %), что свидетельствует об активации процессов фиброзообразования во внеклеточном матриксе миокарда у пациентов с ишемической болезнью сердца: стабильной стенокардией напряжения и сохраненной систолической функцией левого желудочка. Этот процесс на микроуровне представляется следующим образом. Чем больше степень стеноза коронарных артерий, тем больше гипоксические изменения и окисидативный стресс. Накопление продуктов окисления в миокарде, снижение адаптационных механизмов приводит к активации иммунной системы с развитием провоспалительного и профибротического состояний, которые вызывают структурные, а затем и функциональные изменения миокарда. В этих изменениях ключевую роль играет семейство факторов роста фибробластов, способствуя гипертрофии и фиброзу миокарда через стимуляцию митогенактивируемых протеинкиназ и регуляцию активности α-Klotho (независимого от α-Klotho кальцинурин-/ядерного фактора активированных Т-клеток), который ингибирует фиброзирование внеклеточного матрикса миокарда, индуцированный ангиотензином II, трансформирующим фактором роста-β1 и гиперфосфатемией [Мясоедова, 2017; Калинкина и др., 2021; Frangogiannis, 2021]. Полученные нами результаты говорят о том, что чем больше стеноз коронарных артерий, тем активнее протекает процесс фиброзирования внеклеточного матрикса миокарда.
Таблица 2
Table 2
Показатели объёмной фракции интерстициального коллагена миокарда в сравниваемых группах
Indicators of the volume fraction of interstitial myocardial collagen in the compared groups
Показатель/ | 1 группа | 2 группа |
ОФИК, % | 7,9 [6,8; 10,1] | 9,8 [7,4; 11,6] |
Примечание: р1 – уровень статистической значимости различий с 1 группой.
Важным аспектом изучения фиброзирования миокарда является не только оценка его наличия и степени выраженности, но и рассмотрение взаимосвязи со структурно-функциональными показателями сердца. Известно, что нарушение баланса обмена коллагена во внеклеточном матриксе миокарда вызывает нарушение электрофизиологических механизмов в кардиомиоцитах, приводит к развитию диастолической дисфункции левого желудочка, а при прогрессировании процесса – и к систолической дисфункции [Шевченко, Ульбашев, 2022; Zhu et al., 2022]. Согласно клиническим рекомендациям по лечению и диагностике пациентов с ХСН, помимо изучения по данным ЭХОКГ диастолической функции и систолической функции ЛЖ путем расчёта ФВ ЛЖ, предлагается производить с использованием спекл-трекинг технологии оценку глобальной продольной систолической деформации ЛЖ, так как этот показатель на ранних стадиях позволяет оценить формирующееся контрактильные и гемодинамические изменения миокарда. Это обусловлено тем, что наиболее чувствительны к ишемии субэндокардиальные продольно расположенные мышечные волокна ЛЖ, следовательно, с них и начинается продольное деформационное ремоделирование ЛЖ [Гриценко и др., 2021; Базилевич и др., 2022].
Оценка показателя GLS в сравниваемых группах показала, что во 2 группе пациентов изучаемый показатель статистически значимо отличался от группы пациентов с умеренным атеросклеротическим поражением коронарных артерий (р = 0,016) (табл. 3). При этом в 1 группе пациентов Ме показателя GLS находилась в пределах референсных значений [Фозилов и др., 2021; Пономаренко и др., 2023].
Таблица 3
Table 3
Показатель GLS в сравниваемых группах
The GLS indicator in the compared groups
Показатель/ | 1 группа | 2 группа |
GLS, % | –19,2 [–16,1; –23,6] | –15,3 [–11,3; –17,7] |
Примечание: р1 – уровень статистической значимости различий с 1 группой.
Показатель ОФИК и показатель GLS в обеих группах пациентов имели прямые статистически значимые связи, при этом в группе пациентов с выраженным поражением коронарных артерий она была сильнее (r=0,63, р=0,031), чем в группе пациентов с умеренным атеросклеротическим поражением коронарных артерий (r=0,56, р=0,039). То есть, чем больше показатель ОФИК, а, следовательно, и интерстициальный фиброз миокарда левого желудочка, тем более значимо нарушается глобальная продольная систолическая деформация ЛЖ.
Заключение
У пациентов с ишемической болезнью сердца: стабильной стенокардией напряжения и сохраненной систолической функцией ЛЖ показатель степень интерстициального фиброзирования миокарда ЛЖ, оцененная по показателю ОФИК, зависит от степени стеноза коронарных артерий. При прогрессировании атеросклеротического процесса в коронарных артериях степень фиброзирования миокарда ЛЖ увеличивается, что ассоциируется с усилением нарушения глобальной продольной систолической деформации ЛЖ.


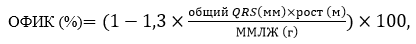



Список литературы
Абдрахманова А.И., Амиров Н.Б., Цибулькин Н.А., Кашапов Л.Р., Ослопова Ю.В., Хабибуллин И.М., Горнаева Л.И., Галимзянова Л.А. 2020. Возможности коронароангиографии в диагностике поражения коронарных артерий у пациентов с безболевой ишемией миокарда. Современные проблемы науки и образования. 4. URL: https://science-education.ru/ru/article/view?id=30058 (дата обращения: 21.01.2025).
Базилевич А.В., Неласов Н.Ю., Сидоров Р.В., Долтмурзиева Н.С., Борщев Г.Г., Поспелов Д.Ю., Оврулова М.М. 2022. Современные возможности эхокардиографии при хирургическом лечении больных ИБС. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 17: 78–81. doi: 10.25881/20728255-2022-17-2-78
Бойцов С.А. 2022. Хроническая сердечная недостаточность: эволюция этиологии, распространенности и смертности за последние 20 лет. Терапевтический архив. 94(1): 5–8. doi: 10.26442/00403660.2022.01.201317
Гордеева М.С., Пармон Е.В., Карлина В.А., Рыжкова Д.В. 2022. Фрагментация QRS-комплекса как маркер фиброза миокарда у пациентов с ишемической болезнью сердца. Наука и инновации в медицине. 2: 95–102. doi: 10.35693/2500-1388-2022-7-2-95-102
Гриценко О.В., Чумакова Г.А., Трубина Е.В. 2021. Возможности speckle-tracking эхокардиографии для диагностики дисфункции миокарда. CardioСоматика. 12(1): 5–10. doi: 10.26442/22217185.2021.1.200756
Калинкина Т.В., Ларева Н.В., Чистякова М.В., Стенькина В.К., Пунцокдашина Т.Б. 2021. Опыт применения расчета объемной фракции интерстициального коллагена у больных артериальной гипертонией. Сибирское медицинское обозрение. 1: 90–95. doi: 10.20333/2500136-2021-1-90-95
Миронова О.Ю., Исаев Г.О., Бердышева М.В., Шахнович Р.М., Фомин В.В. 2023. Современные методики оценки физиологической значимости стенозирующих поражений коронарных артерий. Терапевтический архив. 95(4): 341–346. doi: 10.26442/00403660.2023.04.202169
Мухаметгареева А.В., Кашталап В.В., Молчанов А.Н., Воробьев А.С., Урванцева И.А., Ромашкин В.В., Коваленко Л.В. 2020. Возможности использования ультразвуковой оценки деформации миокарда левого желудочка в кардиологии. Ульяновский медико-биологический журнал. 3: 28–43. doi: 10.34014/2227-1848-2020-3-28-43
Мясоедова Е.И. 2017. Фракция фиброза миокарда и структурное ремоделирование левых отделов сердца у пациентов с ишемической кардиомиопатией. Астраханский медицинский журнал. 2017. 12(2): 98–103.
Пономарева О.В., Смирнова Е.А. 2024. Современный взгляд на роль фиброза миокарда и его биохимических маркеров в диагностике хронической сердечной недостаточности. Наука молодых (Eruditio Juvenium). 12(2): 303–316. doi: 10.23888/HMJ2024122303-316
Пономаренко И.В., Сукманова И.А., Санаева А.К., Трубина Е.В., Наренкова С.О. 2023. Возможности speckle-tracking-эхокардиографии в диагностике субклинической дисфункции левого желудочка. Кардиология: новости, мнения, обучение. 11(2): 22–29. doi:10.33029/2309-1908-2023-11-2-22-29
Тарасова И.В., Вёрткин А.Л., Кожушков В.А., Кожушков И.А., Чеботарь Н.Е., Гейдарова Э.М. 2023. Обзор визуализирующих методов исследования, применяемых в диагностике стабильной ишемической болезни сердца. Лечащий Врач. 4(26): 48–55. doi: 10.51793/OS.2023.26.4.007
Усачева Е.В., Нелидова А.В., Куликова О.М., Флянку И.П. 2021. Смертность трудоспособного населения России от сердечно-сосудистых заболеваний. Гигиена и санитария. 100(2): 159–165. doi: 10.47470/0016-9900-2021-100-2-159-165
Фозилов Х.Г., Шек А.Б., Бекметова Ф.М., Алиева Р.Б., Мухамедова М.Г., Муллабаева Г.У., Дониеров Ш.Н., Илхомова Л.Т., Бекметова С.И., Хотамова М.Н. 2021. Особенности деформационных свойств левого желудочка у больных c поражением коронарных артерий. Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского. 9(3): 118–124. doi: 10.33029/2308-1198-2021-9-3-118-124
Шевченко Ю.Л., Ульбашев Д.С. 2022. Иммобилизирующий интерстициальный фиброз сердца. Часть 1. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2: 4–10. doi: 10.25881/20728255-2022-17-2-4
Fan J.L., Su B., Zhao X., Zhou B.Y., Ma C.S., Wang H.P., Hu, S.D., Zhou Y.F., Ju, Y.J., Wang M.H. 2020. Correlation of Left Atrial Strain with Left Ventricular End-Diastolic Pressure in Patients with Normal Left Ventricular Ejection Fraction. Int. J. Cardiovasc. Imaging. 36: 1659–1666. doi: 10.1007/s10554-020-01869-7
Frangogiannis N.G. 2021. Cardiac Fibrosis. Cardiovasc. Res. 117(6): 1450–1488. doi: 10.1093/cvr/cvaa324
Schimmel K., Ichimura K., Reddy S., Haddad F., Spiekerkoetter E. 2022. Cardiac Fibrosis in the Pressure Overloaded Left and Right Ventricle as a Therapeutic Target. Front. Cardiovasc. Med. 9: 886553. doi: 10.3389/fcvm.2022.886553
Shirani J., Pick R., Quo Y. 1992. Usefulness of the Electrocardiogram and Echocardiogram in Predicting the Amount of Patients with Chronic Heart Failure. Am. J. Cardiol. 69: 1502.
Zhu L., Wang Y., Zhao S., Lu M. 2022. Detection of Myocardial Fibrosis: Where We Stand. Front. Cardiovasc. Med. 9: 926378. doi: 10.3389/fcvm.2022.926378