Сравнительное изучение концентрации гидроксипролина в перипротезной капсуле после подкожной имплантации губчатых кровоостанавливающих средств в хроническом эксперименте in vivo
Aннотация
Цель исследования: оценить динамику концентрации гидроксипролина после подкожной имплантации локальных кровоостанавливающих средств в эксперименте in vivo. Исследования проводили на 210 крысах-самцах породы Wistar, разделенных на 7 групп (по 30 особей в каждой). Под ингаляционным наркозом лабораторным животным выполняли разрез кожи и подкожной жировой клетчатки по лопаточной линии, затем в рану вводили инструмент, формируя карман. В образовавшееся углубление имплантировали образцы согласно разделению на группы. Для оценки концентрации гидроксипролина в динамике животных выводили на 7-е, 14-е и 28-е сутки. После СО2-индуцированной эвтаназии выделяли область перипротезной капсулы. После пробоподготовки биоматериала определяли концентрацию гидроксипролина усовершенствованным колориметрически методом. Статистическую значимость отличий определяли путем вычисления критерия Крускала – Уоллиса. Во всех экспериментальных группах выявлена прямая корреляционная зависимость между концентрацией 4-гидрокси-L-пролина и сроками выведения. На 28-е сутки наибольшая концентрация гидроксипролина выявлена в эксперименталных группах № 5 (0,0285), 7 (0,0160), 3 (0,0110), а наименьшая – в группах № 4 (0,0058), 6 (0,0058), 2 (0,0078), 1 (0,0082). Данные показатели можно связать с высоким содержанием коллагена в имплантах, что провоцирует более выраженную местную реакцию макроорганизма. Подкожная имплантация комбинированных кровоостанавливающих губок на основе NaКМЦ и коллагена глубоководного кальмара статистически значимо (p ≤ 0,05) провоцирует менее выраженную реакцию тканей по сравнению с группами контроля и сравнения.
Ключевые слова: местные кровоостанавливающие средства, реакция тканей, коллагеногенез, перипротезная капсула, гидроксипролин, колориметрический метод
Введение
В современных реалиях исследование коллагеногенеза считается наиболее перспективной и значимой проблемой практической медицины. В особенности важным и нерешенным на настоящем этапе вопросом современной хирургии является контроль динамики образования рубцовой ткани в послеоперационном периоде. Формирование рубцов связывают с избыточным разрастанием соединительной ткани [Ахрарова, Муратходжаева, 2019]. Процесс развивается в результате разрушения соединительнотканных волокон эластического типа, которые в дальнейшем замещаются грубоволокнистыми волокнами коллагена. Продукцию компонентов внеклеточного матрикса, к числу которых также относят и коллаген, осуществляют клетки-фибробласты. Структура биологически активных веществ, продуцируемых фибробластами, зависит от микроокружения. Так, помимо непосредственного влияния клеток-фибробластов на структуру межклеточного вещества, они находятся в непосредственной зависимости от окружающих их клеток, в том числе и клеток, участвующих в воспалительном процессе. Таким образом, численность фибробластов, непосредственно находящихся в очаге воспаления, непрерывно возрастает. В области этого очага происходит и активация клеток [Симрок, Попова, 2020]. Помимо вышеназванной взаимосвязи клеток фибробластического ряда с микроокружением, сами по себе данные клетки способны влиять на синтез белка благодаря имеющимся у них факторам роста. Фактор роста соединительной ткани (CTGF) и трансформирующий фактор роста бета (TGF-β) являются стимулирующими субстанциями, оказывающими прямое влияние на пролиферацию фибробластов, а также обеспечивающими синтез фибробластами компонентов внеклеточного матрикса. Выделяют следующие виды патологических рубцов: гипертрофические и келоидные. Формирования гипертрофических рубцов происходит в результате избыточной продукции коллагена [Song et al., 2022]. Данный вид патологического рубца характеризуется плотной консистенцией, также несколько возвышается над уровнем нормальной ткани, при этом имеет четко очерченные границы и не сливается с окружающими здоровыми тканями. Гипертрофия рубцовой ткани объясняется рядом причин: наличие малодифференцированных фибробластов непосредственно в ткани рубца, высокая биосинтетическая активность зрелых фибробластов, которая может длительно поддерживаться на высоком уровне за счёт процессов неоангиогенеза. Келоидным рубцом принято считать опухолеподобное разрастание незрелой соединительной ткани, ключевым фактором в развитии которого является неконтролируемая пролиферация клеток фибробластического ряда. Келоидные рубцы отличаются от описанных ранее гипертрофических относительно быстрыми темпами роста, при котором часто наблюдаются парестезии, зуд в области формирующегося келоида, сопровождаемые субъективными болевыми ощущениями. Рубцы не имеют четко очерченных границ, распространяются на окружающие интактные ткани, в результате чего сформировавшийся рубец принимает каплевидную форму. Келоидный рубец не обладает способностью к инволюции [Шалагина и др., 2022]. Патологические келоидные рубцы формируются реже гипертрофических. Так, частота их возникновения варьирует в пределах 4,5–16 %. Келоиды формируются в основном у лиц, находящихся в возрастной группе от 10 до 30 лет, в наиболее подверженных действию травматического фактора областях, а именно: верхние части грудной клетки, спины и предплечий, мочки ушных раковин. Также отмечается зависимость между частотой формирования келоида и расой, так, наибольшая отмечается у темнокожих и азиатов. Избыточное рубцевание приводит к целому ряду тяжелых осложнений: контрактуры, ограничение подвижности конечностей, морфофункциональные изменения органов и тканей, спайкообразование (как результат, развитие спаечной кишечной непроходимости, трубно-перитонеального бесплодия, синдрома острой задержки мочи и т. д.) [Adugani et al., 2021]. Помимо прочего, является актуальной проблема разрастания соединительной ткани в области имплантации медицинских изделий в результате хирургического лечения (сетчатых эндопротезов, локальных кровоостанавливающих средств, полимерных матриц и др.).
Выраженность формирования рубцовой ткани зависит от множества причин: доказана возможность генетической связи через антигены лейкоцитов человека (HLA) В 14, В 21, Вw 16, Вw 35, DR 5 и DQw; эндокринопатии с характерным гормональным дисбалансом [Прохоров и др., 2021]. Избыточное рубцевание является результатом глубоких и обширных травм, длительных и вялотекущих воспалительных процессов в послеоперационном периоде. Среди местных факторов, предрасполагающих к данному процессу, являются тканевая гипоксия, нарушение межклеточных взаимодействий, что также характерно после оперативного вмешательства [Райляну, Подолинный, 2019]. В настоящее время, несмотря на достижения в вопросах изучения механизмов заживления ран и формирования рубцовой ткани на гистохимическом и молекулярном уровнях, остается актуальной проблема прогнозирования исхода патологических рубцов [Кулаков, Коган, 2019; Hernandez et al., 2021].
Основным маркером выраженности коллагеногенеза является содержание коллагена в тканях. Для исследования динамики реакции тканей макроорганизма на имплантацию того или иного средства (интенсивность течения формирования рубцовой ткани, темпы неоколлагеногенеза, выраженность воспалительного процесса) применяют методы определения концентрации 4-гидрокси-L-пролина в периимплантационной капсуле [Tanneberger et al., 2021; Hernandez et al., 2022]. Транс-4-гидрокси-L-пролин рассматривается как наиболее специфическая для коллагена, также обеспечивает синтез эластина. На основании вышеописанных фактов следует, что гидроксипролин может использоваться в качестве диагностического маркера в определении метаболизма костной ткани, а также развивающегося фиброза, так как гидроксипролин – главная аминокислота, обеспечивающая синтез компонентов соединительной ткани организма в ходе процесса ремоделирования [Животенко и др., 2019; Antmen et al., 2021]. Несмотря на тот факт, что доля данной аминокислоты в молекуле коллагена составляет менее 14 %, именно 4-гидрокси-L-пролин является маркером выраженности коллагеногенеза, с помощью которого можно оценить темпы формирования рубцовой ткани после оперативного вмешательства, верифицировать дисплазию соединительной ткани, что также является актуальным вопросом современной медицины [Zhuang et al., 2020].
Среди известных методов количественного определения содержания коллагена в биологических тканях и жидкостях используют различные методики аналитической химии, такие как слектрофотометрия, газовая хроматография, спектрофотометрические колориметрические методы измерения, обращенно-фазовая хроматография с предколоночной и постколоночной дериватизацией фенилизотиоцианатом, 2-меркаптоэтанолом, дансилхлоридом и другими дериватизирующими агентами [Zhang et al., 2020]. Однако недостатком спектрофотометрических методов является сложность высокоточного определения содержания гидроксипролина в тканях [Бежин и др., 2019; Савинова и др., 2021]. Известные на сегодняшний день колориметрические методы являются недостаточно показательными, так как ввиду сложности выполнения пробоподготовки дают нестабильные результаты с большим разбросом чисел внутри группы одного исследуемого образца, что напрямую связано с большим содержанием примесей в аналитических пробах [Ерзунов и др., 2021; Липатов и др., 2021]. Для проведения анализа с помощью высокоэффективной жидкостной хроматографии необходимо использование дополнительного оборудования, а именно: защитные предколонки и дорогостоящие дериватизирующие агенты, например, дансилхлорид.
Цель исследования. Оценить динамику концентрации гидроксипролина после подкожной имплантации локальных кровоостанавливающих средств в хроническом эксперименте in vivo.
Объекты и методы исследования
В стерильных условиях операционного блока лаборатории экспериментальной хирургии и онкологии НИИ ЭМ КГМУ Минздрава России выполняли оперативное вмешательство 210 крысам-самцам породы Wistar с массой 250 г. под контролем регионального этического комитета при ФГБОУ ВО КГМУ Минздрава России. Сформировали 7 групп по 30 животных в каждой (таблица 1). В опытных группах в состав губки к раствору натриевой соли карбоксиметилцеллюлозы добавлен раствор коллагена, полученный из глубоководного кальмара вида Dosidicus Gigas, семейства Ommasrephinae и предоставленный ООО «АС РС». Состав, а также процентное соотношение компонентов губки разработаны на кафедре химии Курского государственного университета («Губка кровоостанавливающая комбинированная», заявка на патент РФ № 2023123284 от 07.09.2023 г.).
Для обеспечения анестезиологического пособия использовался ингаляционный масочный наркоз: концентрация изофлурана во вдыхаемой газовой смеси – 2,5 %, поток воздуха – 0,8 л/мин. Применяли наркозный аппарат RWD Life Science R340 Isoflurane (RWD Life Science, Китай).
Таблица 1
Table 1
Распределение лабораторных животных на группы исследования
Distribution of laboratory animals into study groups
Группа экспериментов | Характеристика средства | Производитель |
1 группа (опыт) | Губка кровоостанавливающая комбинированная (85 % NaКМЦ, 15 % коллаген) | Совместная разработка Курского государственного университета и Курского государственного медицинского университета, Курск, Российская Федерация |
2 группа (опыт) | Губка кровоостанавливающая комбинированная (75 % NaКМЦ, 25 % коллаген) | |
3 группа (опыт) | Губка кровоостанавливающая комбинированная (50 % NaКМЦ, 50 % коллаген) | |
4 группа (контроль) | Губка кровоостанавливающая на основе NaКМЦ | Курский государственный медицинский университет, Курск, Российская Федерация |
5 группа (контроль) | Губка коллагеновая гемостатическая | ООО «Зеленая Дубрава», Российская Федерация |
6 группа (сравнение) | Surgicel Fibrillar, 7-слойный гемостатический материал на нетканой основе» | Johnson & Johnson (США)
|
7 группа (сравнение) | Пластина гемостатическая «Тахокомб» | Takeda (Австрия) |
На всех этапах экспериментального исследования были соблюдены международные, а также отечественные нормы гуманного обращения с лабораторными животными, регламентированные следующими документами: ГОСТ 33215-2014 Руководство по содержанию и уходу за лабораторными животными; Многосторонние консультации сторон, присоединившихся к Европейской конвенции по защите позвоночных животных, используемых в научных целях (ETS 123); Резолюция об образовании и обучении персонала, задействованного в работе с лабораторными животными, 3 декабря 1993.; Рекомендации по эвтаназии экспериментальных животных. Документ экспертной группы Европейской комиссии, 1997; Конвенция Совета Европы о защите животных во время международных перевозок (переработанная), ETS N 193.
Во время проведения оперативного вмешательства животное располагалось лежа на животе, с фиксацией конечностей непосредственно к операционному столу. Операционное поле обрабатывалось стандартно трехкратно, после чего производился продольный разрез кожи и подкожной клетчатки вдоль лопаточных линий справа и слева длиной 2 см. В сформированный раневой канал вводили зажим кровоостанавливающий типа «Москит», после чего формировали полость тупым методом и имплантировали в неё один из упомянутых ранее изучаемых образцов (рис. 1).
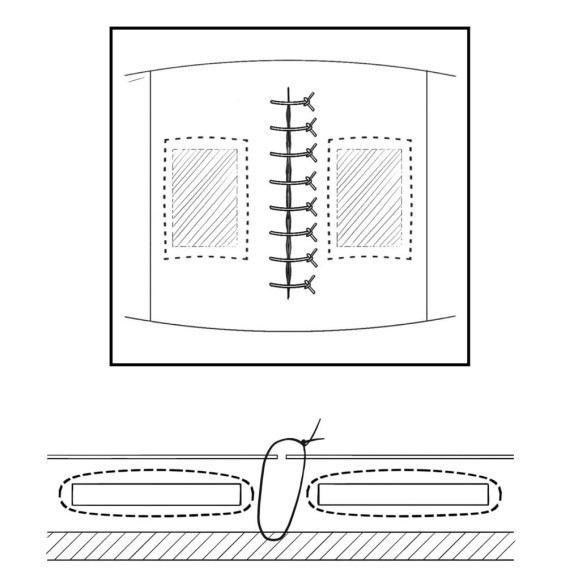
Рис. 1. Схема размещения имплантов в сформированном кармане
Fig. 1. Scheme of implant placement in the formed pocket
Выведение животных из эксперимента производили на 7, 14 и 28 сутки после осуществления хирургического вмешательства, после чего производили аутопсию участка ткани в области имплантации исследуемых образцов.
Первая стадия определения гидроксипролина в тканях заключается в подготовке образцов к проведению колориметрического анализа. Под пробоподготовкой понимается обезжиривание перипротезной капсулы с последующим высушиванием сублимационным способом. Перипротезную капсулу сублимировали с помощью сушилки SCIENTZ 30-F FREEZE DRYER (КНР) в течение 64 часов. Режим лиофилизации делится на 11 рабочих циклов. Каждый цикл в интервале с 1 по 10 имеет продолжительность в 5 часов. Лиофилизация начинается при температуре –50 °С и рабочем давлении 5Па. Каждый цикл (с 1 по 9) температура поднимается на 10 °С, давление не меняется. 10 цикл растянут во времени на 9 часов. На данном этапе проводится досушка материала при давлении 5Па.
После сушки аналитические образцы измельчались. Перипротезные капсулы обрабатывались жидким азотом повышенной чистоты (ГОСТ 9293-74, 1 сорт) и измельчались с помощью ножевой мельницы до однородной структуры. Далее аналитические образцы обезжиривались.
Процесс обезжиривания проводили хлорпроизводными метана, такими как хлороформ, хлористый метилен, и углеводородами, такими как гексан, циклогексан, октан. Для этого предварительно измельченные перипротезные капсулы помещались в стеклянные пробирки, добавляли обезжириватели из списка и ставили в термостат на 60 минут при нагреве. Температуру подбирали исходя из температур кипения соответствующего реагента, не доводя его до кипения. Наиболее оптимальным обезжиривающим реагентом был выбран гексан чистотой analytical reagent производства VWR Chemicalis (Франция). Затем аналитические образцы центрифугировали, жидкую фазу сливали, а образцы высушивали в вакуумном сушильном шкафу.
На втором этапе проводили щелочной гидролиз перипротезной касулы. Щелочной гидролиз проводится растворами щелочи при длительном нагреве и температуре в интервале 90–95°С.
Точную навеску подготовленных проб взвешивали с помощью аналитических весов «AND» (Япония), непосредственно в пробирки Eppendorf приливали 10М раствор гидроксида натрия чистоты for analysis производства Thermo Fisher scientific (США). Пробирки помещали в термостат TBD-120 «Biosan» при температуре 90°С и выдерживали в течение 15 часов. Далее после гидролиза пробы постепенно охлаждали до комнатной температуры и прибавляли 10М раствор соляной кислоты чистотой acipur производства компании CDH (Индия). Раствор соляной кислоты прибавляли с помощью стеклянной пипетки по каплям, не допуская вскипания раствора из-за выделяющегося тепла в процессе протекания реакции нейтрализации.
На третьем этапе анализа проводили очистку аналитических образцов от примесей.
Для удаления побочных продуктов реакции, которые могут оказать негативное влияние на оптическую плотность растворов, образцы подвергали высушиванию до постоянной массы.
После этого вносили в пробирки различные растворители: дихлорметан, производства компании CDH чистотой for HPLC, ацетон производства компании PanReac AppliChem чистотой for HPLC, ацетонитрил и тетрагидрофуран чистоты extra pure производства Neofoxx (Германия) метанол (осч, Компонент-Реактив), пиридин производства компании ALDOSA чистотой ХЧ, изопропанол в объеме 1 мл чистоты for HPLC, производства компании PanReac AppliChem (Испания) и ставили в термостат на 60 минут. Температуру подбирали исходя из температур кипения соответствующего реагента, не доводя его до кипения. Во всех пробах с различными растворителями наблюдали нерастворимый осадок органических примесей и неорганических солей.
Для полноценного разделения твердой и жидкой фаз твёрдую фазу осаждали центрифугированием в микроцентрифуге «Eppendorf 5452 Minispin» (Германия) в течение 0,5 часа и скорости 13 400 g. Если наблюдались взвешенные частицы в пробе или не до конца осевшая твердая фаза, этап повторяли, затем верхний слой-натант переносили в другую пробирку Eppendorf и упаривали досуха. После высушивания образцов до постоянной массы стеклянной пипеткой на 1мл 1 класса добавляли 600 мкл соответствующего растворителя, нагревали в течение 60 минут и снова центрифугировали в уже описанном ранее режиме. На этом этапе пробоподготовку образцов считали завершённой.
Четвертый этап включает в себя приготовление растворов для проведения анализа и проведение самого анализа.
Раствор реагента Эрлиха был приготовлен из точной навески диметиламинобензальдегид-пара, чистотой 99,2 % в растворе изопропанол: 37 % соляная кислота в соотношении 70:30.
Раствор Хлорамина Т был приготовлен из точной навески Хлорамина Т производства компании Neofoxx (Германия) и буферного раствора, состоящего из ацетата натрия производства компании Merck (Австрия) и чистотой for analysis, водного раствора уксусной кислоты, гидроксида натрия производства компании Thermo Fisher scientific (США) и чистотой for analysis и лимонной кислоты моногидрата производства компании Merck (Австрия) и чистотой for analysis. рН буферного раствора до значения 6,0 доводили с помощью раствора 10М соляной кислоты.
Далее приступали к проведению анализа.
Жидкую фазу-натант в верхнем слое отбирали дозатором и вносили её в ячейки планшета для иммунологических исследований в объеме 4, 6, 8 мкл. Для построения корреляционного графика отдельно в ячейки вносили стандартный образец транс-4-гидрокси-L-пролина Sigma Aldrich (США) в объеме 0, 2, 4, 6, 8 и 10 мкл и упаривали досуха при температуре 65 °С.
После высушивания наблюдали дефекты ячеек планшета, в которые вносились образцы с применением следующих растворителей: тетрагидрофуран, дихлорметан. Результаты анализа данных ячеек далее не учитывались.
После упаривания в ячейки с анализируемыми образцами вносили по 100 мкл раствора Хлорамина Т и оставляли на 20 минут при комнатной температуре.
Для дериватизации гидроксипролина к образцам добавляли по 100 мкл раствора реактива Эрлиха, накрывали крышкой от планшета, помещали в термостат и проводили реакцию при 65 °С в течение 45 минут при постоянном перемешивании на лабораторном шейкере. Цвет окраски анализируемых образцов изменялся в цветовой гамме от желтого до фиолетового цвета.
Оптическую плотность деравитизировнных образцов измеряли при длине волны 540 нм на микропланшетном ридере «AMR-100» («Методика определения содержания гидроксипролина в различных тканях», заявка на патент РФ № 2024103617 от 13.02.2024 г.).
Наибольшую интенсивность окраски анализируемых растворов показали образцы с добавлением изопропилового спирта в качестве растворителя, что свидетельствует о большей экстракции 4-гидроки-L-пролина, а значит, более корректных результатах.
Полученные результаты подвергались статистической обработке с применением методик описательной и вариационной статистики при помощи программного продукта «Statictica 13.3 Pro» (Dell Software Company, Round Rock, Texas, США). Вычисляли медианные значения и 25, 75 процентили. Учитывая большое количество групп исследования, было принято решение в качестве критерия определения уровня статистической значимости выбрать тест Крускала – Уоллиса. Критический уровень значимости (p) при проверке статистических гипотез принимали меньшим или равным 0,05 – допустимое для медико-биологических исследований значение.
Результаты и их обсуждение
В ходе анализа полученных данных было установлено, что на 7-е сутки после выполнения вмешательства наибольшая концентрация гидроксипролина содержится в перипротезных капсулах животных в группе № 7, тогда как наименьшее содержание данной аминокислоты определено в контрольной группе № 4 и опытной группе № 1. На 14-е сутки определяется тенденция к увеличению концентрации 4-гидрокси-L-пролина во всех группах исследования. На данном сроке наибольшая концентрация выявлена в группе № 6 (сравнение), а наименьшая отмечается в группе № 2 (опыт). На 28-е сутки в трех группах исследования (№ 1, № 4 и № 6) отмечается снижение концентрации данной аминокислоты. В остальных группах (№ 2, № 3, № 5 и № 7) наблюдается увеличение концентрации 4-гидрокси-L-пролина. На указанном сроке наибольшее содержание определяется в группе № 5 (контроль), наименьшее – в группе № 4 (контроль) (таблица 2).
Таблица 2
Table 2
Динамика уровня гидроксипролина в тканях перипротезной капсулы, Me [25; 75]
Dynamics of hydroxyproline level in the tissues of the periprosthetic capsule, Me [25; 75]
Группа | Концентрация 4-гидрокси-L-пролина, мкг / мл | ||
7 сутки | 14 сутки | 28 сутки | |
Группа № 1 (опыт) | 0,0044 [0,0027; 0,006] | 0,0090 [0,0089; 0,0092] | 0,0082 [0,0079; 0,0083] |
Группа № 2 (опыт) | 0,0051 [0,0049; 0,0053] | 0,0058 [0,0052; 0,0059] | 0,0078 [0,0071; 0,0082] |
Группа № 3 (опыт) | 0,0071 [0,0070; 0,0075] | 0,0082 [0,0070; 0,0090] | 0,0110 [0,0103; 0,0110] |
Группа № 4 (контроль) | 0,0051 [0,0040; 0,0068] | 0,0110 [0,0104; 0,0114] | 0,0058 [0,0055; 0,0064] |
Группа № 5 (контроль) | 0,0092 [0,0081; 0,0096] | 0,0147 [0,0136; 0,0151] | 0,0285 [0,0273; 0,0301] |
Группа № 6 (сравнение) | 0,0086 [0,0084; 0,0091] | 0,0151 [0,0134; 0,0163] | 0,0058 [0,0038; 0,0064] |
Группа № 7 (сравнение) | 0,0109 [0,0096; 0,0114] | 0,0142 [0,0141; 0,0146] | 0,0160 [0,0153; 0,0180] |
При анализе концентрации гидроксипролина в тканях периимплантационных капсул на всех сроках эксперимента выявлены статистически значимые отличия между группами исследования, что говорит о различной степени реакции макроорганизма в ответ на внедрение инородных объектов. На 7-е сутки выведения лабораторных животных из эксперимента были обнаружены следующие статистически значимые отличия (таблица 3): между опытными группами № 1 и № 3 (р = 0,0182), № 1 и № 5 (р < 0,0001), № 1 и № 6 (p = 0,0002), № 1 и № 7, р < 0,0001. При сравнении на 7-е сутки опытной группы № 2 выявлены статистически значимые отличия с группами № 5 (р < 0,0001), № 6 (р = 0,0009) и № 7 (р < 0,0001). В группе № 3 на 7-е сутки выявлены отличия с группами № 5 (р = 0,0105), № 7 (р = 0,0022). При сравнении на аналогичном сроке выведения контрольной группы № 4 статистически значимые отличия выявлены с группой № 5 (р < 0,0001) и № 7 (р < 0,0001).

Рис. 2. Уровень статистической значимости концентрации гидроксипролина в исследуемых группах на 7-е сутки
Fig. 2. Level of statistical significance of hydroxyproline concentration in the study groups on day 7
На 14-е сутки после вмешательства также были выявлены статистически значимые отличия между группами исследования. Таким образом, значимость различий отмечается между группами № 1 и № 5 (р < 0,0001), № 1 и № 6 (р = 0,0005), № 1 и № 7 (р = 0,003), № 2 и № 4 (р = 0,0016), № 2 и № 5 (р < 0,0001), № 2 и № 6 (р < 0,0001), № 2 и № 7 (р < 0,0001). Также отличия были выявлены в группах № 3 и № 4 (р = 0,0358), № 3 и № 5 (р < 0,0001), № 3 и № 6 (р < 0,0001), № 3 и № 7 (р = 0,0001), а также между группами № 4 и № 5 (р = 0,0076), № 4 и № 6 (р = 0,0236).
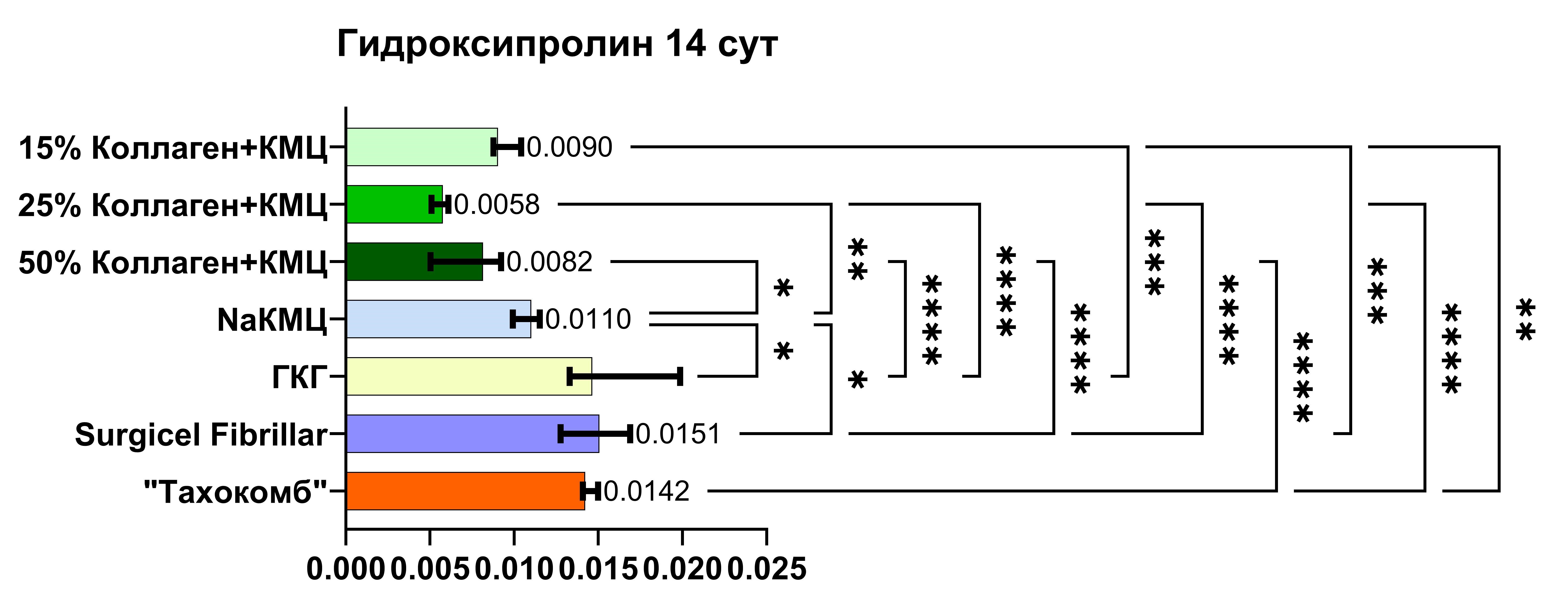
Рис. 3. Уровень статистической значимости концентрации гидроксипролина в исследуемых группах на 14-е сутки
Fig. 3. Level of statistical significance of hydroxyproline concentration in the study groups on day 14
На 28-е сутки после имплантации объектов исследования также прослеживались статистически значимые отличия между группами № 1 и № 4 (р = 0,021), № 1 и № 5 (р = 0,0005), № 1 и № 6 (р = 0,0092), № 1 и № 7 (р = 0,0176), № 2 и № 2 и № 5 (р < 0,0001), № 2 и № 6 (р = 0,041), № 2 и № 7 (р = 0,0033), № 3 и № 4 (р = 0,0016), № 3 и № 5 (р = 0,0089), № 3 и № 6 (р = 0,0005). При сравнении контрольных групп и групп сравнения выяснено, что значимые отличия определяются между группами № 4 и № 5 (р < 0,0001), № 4 и № 7 (р < 0,0001), № 5 и № 6 (р < 0,0001), а также между группами № 6 и № 7 (р < 0,0001).
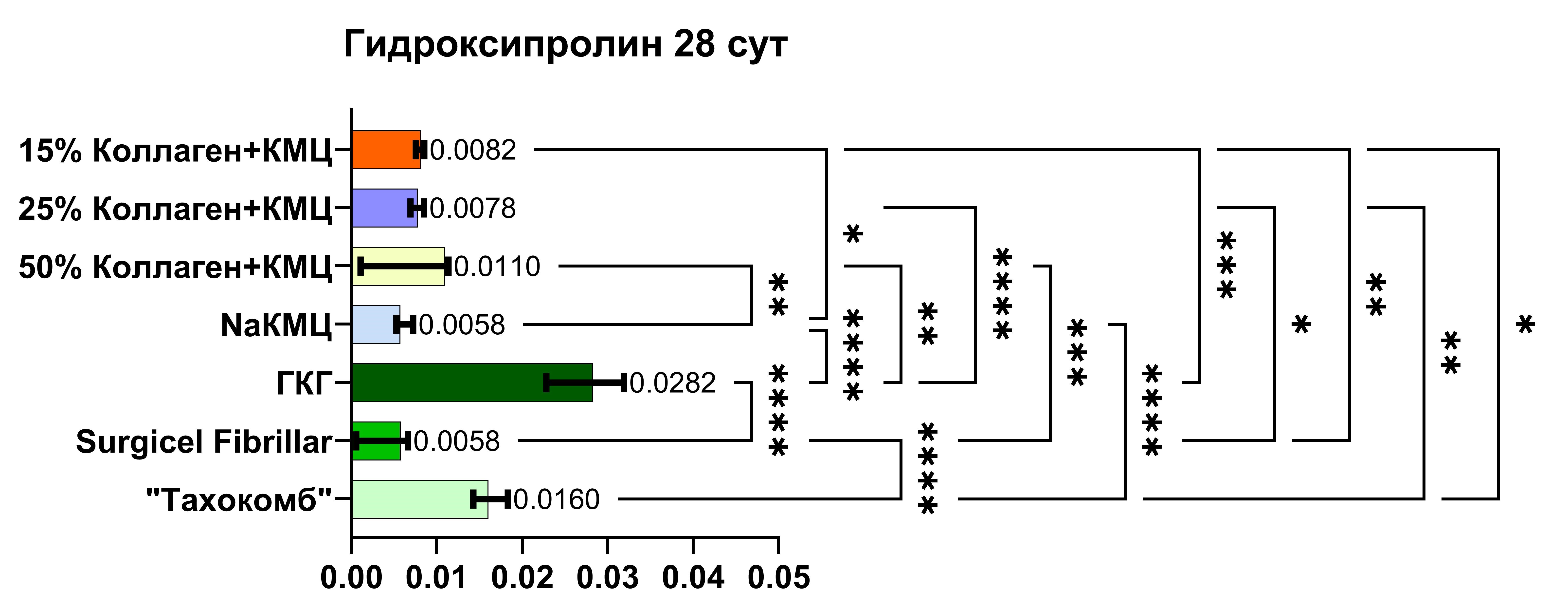
Рис. 4. Уровень статистической значимости концентрации гидроксипролина в исследуемых группах на 28-е сутки
Fig. 4. Level of statistical significance of hydroxyproline concentration in the study groups on day 28
Обсуждение
Во всех группах на различных сроках выявлен рост концентрации данной аминокислоты, что является закономерным, поскольку макроорганизм реагирует на внедрение имплантов выбросом иммунокомпетентных клеток, макрофагов, клеток инородных тел. Выраженность реакции может быть вариабельной в зависимости от состава изделия, подлежащего имплантации. На 7-е сутки концентрация гидроксипролина возрастает в ряду 1 → 2 → 4 → 3 → 5 → 6 → 7. Среди исследуемых образцов на данном сроке наименьшую выраженность реакции тканей вызывает губка кровоостанавливающая комбинированная (85 % NaКМЦ, 15 % коллаген), противоположный эффект наблюдается при имплантации пластины кровоостанавливающей «Тахокомб». По мере увеличения срока выведения животных из эксперимента наблюдается следующая динамика: на 14-е сутки содержание гидроксипролина в перипротезной капсуле увеличивается в ряду 2 → 3 → 1 → 4 → 7 → 5 → 6. На основании полученных данных можно судить о возрастании концентрации аминокислоты на данном сроке, что говорит о продолжающейся реакции тканей макроорганизма на изучаемые импланты, что также является закономерным. Среди опытных групп наиболее хороший результат демонстрирует группа № 2, худший – опытная № 6. На 28-е сутки концентрация гидроксипролина возрастает в ряду 4 → 6 → 2 → 1 → 3 → 7 → 5. Данный результат связан с темпами биодеградации имплантов. Известно, что производные окисленных форм целлюлозы обладают относительно высокими темпами элиминации из организма, поэтому на крайних сроках эксперимента (28 суток) концентрация гидроксипролина невелика как по отношению к другим группам, так и относительно сроков. С другой стороны, наличие коллагена в небольшом процентном соотношении может играть позитивную роль в стабилизации средства относительно его физических и биологических свойств, а также позволить пролонгировать эффект, обеспечить профилактику спаечного процесса, выступая в качестве барьера между травмированными поверхностями органов серозных полостей организма.
Выводы
В завершение изложения материала можно сделать следующие выводы.
- При подкожной имплантации опытных образцов комбинированных кровоостанавливающих губок на основе натриевой соли карбоксиметилцеллюлозы из коллагена, полученного из глубоководного кальмара вида Dosidicus Gigas, семейства Ommasrephinae, статистически значимо (p ≤ 0,05) провоцируют менее выраженную реакцию тканей макроорганизма в ответ на имплантацию по сравнению с группами контроля и сравнения.
- На 28-е сутки эксперимента концентрация гидроксипролина в перипротезных капсулах группы, где применялась губка кровоостанавливающая комбинированная (75 % NaКМЦ, 25 % коллаген) в 2,3 раза ниже, чем в группе «губка кровоостанавливающая коллагеновая», и в 2 раза ниже, чем в результате использования пластины кровоостанавливающей «Тахокомб». При этом с другими группами исследования статистически значимые отличия не выявлены.
- Полученные данные позволяют судить о безопасности применения разработанных опытных образцов кровоостанавливающих губок ввиду относительно невыраженной реакции тканей на его имплантацию в организм.





Список литературы
Ахрарова Ф.М., Муратходжаева А.В. 2019. Определение маркеров метаболизма соединительной ткани методом иммуноферментного анализа (ELISA Kit) у детей с кардиальными проявлениями дисплазии соединительной ткани. Журнал Университетская медицина Урала. 2(17): 49–51.
Бежин А.И., Липатов В.А., Григорьян А.Ю. 2019. Лечение инфицированных ран хитозан-коллагеновым комплексом с диоксидином и лидокаином в условиях эксперимента. Медицинский вестник Северного Кавказа.14(1–2): 159–164. doi:10.14300/mnnc.2019.14005.
Ерзунов К.А., Румянцев Е.В., Алексахина Е.Л. 2021. Разработка функционального покрытия для определения оксипролина в биологическом. Известия высших учебных заведений. Технология текстильной промышленности. 4(394): 133–138. doi: 10.47367/0021-3497_2021_4_133.
Животенко А.П., Кошкарева З.В., Сороковиков В.А. 2019 Профилактика послеоперационного рубцово-спаечного эпидурита: современное состояние вопроса. Журнал Хирургия позвоночника. 16(3): 74–81. doi: 10.14531/ss2019.3.74-81.
Кулаков А.А., Коган Е.А., Николенко В.Н. 2019. Клинико-морфологическое и иммуногистохимическое исследование тканей при периимплантите и пародонтите. Медицинский вестник Северного Кавказа. 14(4): 653–659. doi: 10.14300/mnnc.2019.14162.
Липатов В.А., Северинов Д.А., Пучкова Е.Л. 2021. Опыт исследования различных свойств местных кровоостанавливающих средств. Innova. 1: 20–24. doi: 10.21626/innova/2021.1/03.
Прохоров Д.В., Щербенёва А.А., Нгема М.В. 2021. Рубцы кожи: современные представления об этиопатогенезе, клинике и диагностике. Крымский терапевтический журнал. 2: 18–24.
Райляну Р.И., Подолинный Г.И. 2019. Концепция наружных брюшных грыж как формы соединительнотканной дисплазии для поиска эффективных способов хирургического лечения. Research'n Practical Medicine Journal. 6(4): 138–150. doi: 10.17709/2409-2231-2019-6-4-14.
Савинова Н.В., Данилова О.В., Переведенцева С.Е. 2021. Динамика метаболизма коллагена в тканях крыс с экспериментальным диабетом, протекающим на фоне хронического эмоционального стресса. Молекулярная медицина. 19(4): 52–58. doi: 10.29296/24999490-2021-04-09.
Симрок В.В., Попова И.А. 2020. Клинико-патогенетическое обоснование противоспаечной терапии при аппендикулярно-генитальном синдроме у женщин репродуктивного возраста. РМЖ. Мать и дитя. 3(4): 228–232. doi: 10.32364/2618-8430-2020-3-4-228-232.
Шалагина Т.А., Корчашкина А.М., Емельянова Н.Ю. 2022. Особенности диагностики и лечения дисплазии соединительной ткани в клинической практике у больных хирургического и гинекологического профилей. Modern Science. 4(3): 146–149.
Adugani S., Bannimath G., Sastry P. 2021. A Review on Biomarkers in Clinical Osteoporosis-Significance of Hydroxyproline. Biomedical and Biotechnology Research Journal. 5(3): 245–247.
Antmen E., Vrana N.E., Hasirci V. 2021 The Role of Biomaterials and Scaffolds in Immune Responses in Regenerative Medicine: Macrophage Phenotype Modulation by Biomaterial Properties and Scaffold Architectures. Biomater Sci. 9(24): 8090–8110. doi: 10.1039/d1bm00840d.
Hernandez J.L., Park J., Yao S., Blakney A.K., Nguyen H.V., Katz B.H., Jensen J.T., Woodrow K.A. 2021. Effect of Tissue Microenvironment on Fibrous Capsule Formation to Biomaterial-Coated Implants. Biomaterials. 273: 120806. doi: 10.1016/j.biomaterials.2021.120806.
Hernandez J.L., Woodrow K.A. 2022. Medical Applications of Porous Biomaterials: Features of Porosity and Tissue-Specific Implications for Biocompatibility. Adv Healthc Mater. 11(9): .e2102087. doi: 10.1002/adhm.202102087.
Song S., Fu.Z., Guan R., Zhao J., Yang P., Li Y., Yin H., Lai Y., Gong G., Zhao S., Yu J., Peng X., He Y., Luo Y., Zhong N., Su J. 2022. Intracellular Hydroxyproline Imprinting Following Resolution of Bleomycin-Induced Pulmonary Fibrosis. Eur. Respir J. 59(5): 2100864. doi: 10.1183/13993003.00864-2021.
Tanneberger A.M., Al-Maawi S., Herrera-Vizcaíno C., Orlowska A., Kubesch A., Sader R., Kirkpatrick C.J., Ghanaati S. 2021. Multinucleated Giant Cells within the in vivo Implantation Bed of a Collagen-Based Biomaterial Determine its Degradation Pattern. Clin. Oral. Investig. 25(3): 859–873. doi: 10.1007/s00784-020-03373-7.
Zhang Y., Chen Y., Zhao B., Gao J., Xia L., Xing F., Kong Y., Li Y., Zhang G. 2020. Detection of Type I and III Collagen in Porcine Acellular Matrix Using HPLC-MS. Regen Biomater. 7(6): 577–582. doi: 10.1093/rb/rbaa032.
Zhuang Z., Zhang Y., Sun S., Li Q., Chen K., An C., Wang L., van den Beucken J.J.J.P., Wang H. 2020. Control of Matrix Stiffness Using Methacrylate-Gelatin Hydrogels for a Macrophage-Mediated Inflammatory Response. ACS Biomater Sci Eng. 6(5): 3091–3102. doi: 10.1021/acsbiomaterials.0c00295.