Механизмы развития аритмии при новой коронавирусной инфекции COVID-19
Aннотация
Аритмия является частым сердечно-сосудистым осложнением у пациентов с новой коронавирусной инфекцией – 2019 (COVID-19). Согласно проведенным исследованиям, частота аритмий колеблется от 16,7 % до 19,6 % среди госпитализированных пациентов с COVID-19. Целью данного обзора является изучение механизмов возникновения аритмии при COVID-19, для предоставления врачам комплексной основы для профилактики и лечения данных аритмий. Материалы и методы. Был проведен поиск статей за последние 5 лет в базах PubMed, Google Scholar и eLIBRARY по ключевым словам на русском и английском языках, статьи отбирались в соответствии с целью исследования. Результаты. Возникновение аритмий у пациентов с COVID-19 может быть связано с местными и системными воспалительными реакциями, вызванными вирусной инфекцией, приводящими к повреждению кардиомиоцитов, перикардиту, нарушению иммунного ответа, цитокиновым штормам, структурным изменениям в сердце и нарушениям сердечной проводимости, что в конечном итоге приводит к развитию аритмий. Но есть и другие факторы: нарушение электролитного баланса, ишемия/гипоксия миокарда, проаритмические побочные эффекты лекарств, используемых для лечения COVID-19, дисфункции вегетативной нервной системы. Заключение. Каждый из описанных механизмов развития аритмии влияет на другие механизмы, наибольшее число влияний имеют миокардит и нарушение регуляции иммунного ответа. Для профилактики аритмий, связанных с COVID-19, необходим контроль состояния основного заболевания, раннее выявление и лечение повреждения миокарда и других дисфункций органов, предотвращение гипоксии, предотвращение системного воспаления и уменьшение использования препаратов, удлиняющих интервал QT.
Введение
Ранее было описано, что коронавирусная инфекция – 2019 (COVID-19) может давать различные сердечно-сосудистые осложнения, такие как миокардит, острый коронарный синдром, сердечная недостаточность, аритмия и кардиогенный шок. При этом аритмии являются наиболее частым сердечно-сосудистым осложнением у пациентов с COVID-19 и могут представлять потенциальную угрозу для их жизни [Осипова и др., 2023; Lazzerini et al., 2020; Boulos et al., 2023]. Исследования показали, что COVID-19 может приводить к повреждению миокарда и аритмии, усугубляя состояние пациентов с уже имеющимися сердечно-сосудистыми заболеваниями, приводя к плохому прогнозу и повышению показателей смертности [Gupta et al., 2020; Nishiga et al., 2020; Zheng et al., 2020]. Исследование по госпитализированным пациентам с COVID-19 показало, что у 19,6 % пациентов с COVID-19 наблюдались аритмии [Driggin et al., 2020]. Распространенность аритмий у пациентов, поступивших в отделения интенсивной терапии, была еще выше и достигала 44,4 % [Driggin et al., 2020]. Согласно исследованию, проведенному в Америке, частота аритмий среди госпитализированных пациентов с COVID-19 составляет около 16,7 % [Chen et al., 2020].
Аритмии, наблюдаемые у пациентов с COVID-19, включают различные типы, такие как тахиаритмии, брадиаритмии, блокады и остановку сердца [Manolis et al., 2020; Donniacuo et al., 2023]. Мерцательная аритмия является наиболее распространенной тахиаритмией, она наблюдается у 21 % пациентов с COVID-19, тяжелая синусовая брадикардия (8 %) и блокады сердца (8%) также частые аритмии, наблюдаемые у госпитализированных пациентов с COVID-19 [Manolis et al., 2020]. Среди других аритмий, связанных с COVID-19, встречаются трепетание предсердий (5,4 %), пароксизмальная наджелудочковая тахикардия (5,7 %), частые мономорфные желудочковые экстрасистолы (5,3 %), полиморфные желудочковые экстрасистолы (3,5 %), неустойчивая желудочковая тахикардия (6,3 %), устойчивая желудочковая тахикардия (3,8 %), полиморфная желудочковая тахикардия (3,5 %), AV-блокада первой или второй степени (5,9 %), блокада ножек пучка Гиса (3,9 %), фибрилляция желудочков или остановка сердца (4,8 %) [Manolis et al., 2020]. Высокая распространенность аритмий, связанных с COVID-19, и потенциальная угроза для жизни диктуют необходимость изучения механизмов аритмических осложнений у пациентов с COVID-19. На сегодняшний день эти механизмы недостаточно изучены и сложны для понимания целостной картины аритмии.
Цель исследования – изучение механизмов возникновения аритмии при COVID-19 для предоставления врачам комплексной основы для профилактики и лечения данных аритмий.
Материалы и методы
Был проведен поиск статей с 2019 по 2024 г в базах PubMed, Google Scholar и eLIBRARY по ключевым словам на английском и русском языках: «аритмия», «SARS-CoV-2», «COVID-19», «патогенез». Отбирались статьи в соответствии с целью исследования.
Прямое повреждение миокарда, вызванное проникновением вирусов
Поскольку ACE2 экспрессируется на высоком уровне как в легочной, так и сердечной ткани, новый коронавирус-2019 (SARS-CoV-2) может напрямую инфицировать и повреждать миокардиальную ткань [Камышникова и др., 2024; Chung et al., 2021]. При анализе случаев аутопсии было обнаружено присутствие SARS-CoV-2 в сердечной ткани пациентов с COVID-19 [Bojkova et al., 2020]. Повреждение миокарда, вызванное прямым проникновением вируса, в основном обусловлено прямой токсичностью вируса и дисбалансом экспрессии ACE2 [Babapoor-Farrokhran et al., 2020; Guzik et al., 2020].
Вирус проникает в клетку, связываясь с ACE2, что приводит к дисбалансу экспрессии ACE2, накоплению ангиотензина II и снижению ангиотензина 1-7 и 1-9, что приводит к нарушениям ренин-ангиотензин-альдостероновая системы (РААС) и вызывает повреждение миокарда [Bojkova et al., 2020]. После того как вирус проникает в клетки миокарда, спайковые белки SARS-CоV-2, вызывают провоспалительную реакцию и ведут к дегенерации и некрозу клеток миокарда [Bojkova et al., 2020]. Данные исследований [Lazzerini et al., 2020; Chung et al., 2021] показывают, что распространенность аритмии у пациентов с COVID-19 с повреждением миокарда намного выше, чем у пациентов без повреждения миокарда.
Повреждение миокарда, вызванное прямым вторжением SARS-CoV-2, может привести к аритмии несколькими путями. Доказано, что SARS-CoV-2 может напрямую повреждать как клетки проводящих путей, так и кардиомиоциты [Bhatla et al., 2020; Dherange et al., 2020]. Также SARS-CoV-2 может проникать в пейсмекерные клетки синоатриального узла, вызывая апоптоз клеток, и приводить к дисфункции синоатриального узла и различным аритмиям [Han et al., 2022]. Повреждение миокарда также может быть вследствие нарушения нормального поступления циркулирующего Ca2+ в кардиомиоциты, вызывая дисбаланс гомеостаза кальция в клетках миокарда и таким образом повышая восприимчивость к аритмии [Donniacuo et al., 2023]. Воспаление, вызванное нарушениями системы РААС и токсическим воздействием коронавируса, также может вызывать фиброз сердечной ткани, увеличение предсердий и ремоделирование миокарда. В конечном итоге это приводит к аномальному проведению электрической активности кардиомиоцитов и будет способствовать аритмии [Babapoor-Farrokhran et al., 2020; Zhan et al., 2022; Donniacuo et al., 2023]. Таким образом, механизм аритмии, вызванный прямым повреждением миокарда, из-за проникновения вируса может быть множественным и требует дополнительных исследований.
Нарушение регуляции иммунного ответа и цитокиновый шторм
После того как SARS-CoV-2 проникает в организм, он сначала активирует врожденный иммунный ответ, индуцирует интерфероны и выработку провоспалительных цитокинов и хемокинов, привлекает иммунные клетки для уничтожения вируса и инициирует адаптивный иммунный ответ для устранения вируса [Ning et al., 2022]. Если вирус не устранен вовремя, иммунный ответ дополнительно активируется, что приводит к лимфоцитопении, в основном включая CD4 + и CD8 + Т-лимфоциты, естественные клетки-киллеры (NK), В-лимфоциты, дисфункцию Т-лимфоцитов и NK-клеток, аномалии гранулоцитов и моноцитов, включая увеличение нейтрофилов и уменьшение эозинофилов, базофилов и моноцитов, развитие цитокинового шторма и зависимое усиление антител; в конечном итоге это приводит к дисфункции иммунной системы [Yang et al., 2020; Ning et al., 2022; Wong, Perlman, 2022]. При этом цитокиновый шторм является центральным звеном иммунной дисрегуляции и причиной полиорганной недостаточности, осложненной COVID-19 [Lazzerini et al., 2020]. После того как SARS-CoV-2 заражает организм, активированные лимфоциты, макрофаги, нейтрофилы и дендритные клетки секретируют большое количество цитокинов, таких как интерлейкин (ИЛ) 1, 2, 6, 7, 8, 10, 17, гранулоцитарный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор, интерферон-индуцированный белок-10, моноцитарный хемотаксический белок 1, макрофагальный воспалительный белок-1α, интерферон-γ (ИФН-γ) и фактор некроза опухоли-α (ФНО-α), что приводит к цитокиновому шторму [Lazzerini et al., 2020; Yang et al., 2020; Ning et al., 2022; Wong, Perlman, 2022].
Чрезмерная продукция воспалительных цитокинов создает состояние сильного воспаления в организме, которое может способствовать возникновению различных аритмий, таких как мерцательная аритмия, синдром удлиненного интервала QT, атриовентрикулярная блокада [Lazzerini et al., 2022]. Предыдущие исследования продемонстрировали тесную связь между повышенными уровнями воспалительных цитокинов, в частности ИЛ-6 и ИЛ-10, в кровотоке госпитализированных пациентов с COVID-19 и возникновением предсердных и желудочковых аритмий [Lazzerini et al., 2019; Lazzerini et al., 2022].
Было показано, что воспалительные цитокины участвуют в развитии аритмий, связанных с COVID-19, посредством различных механизмов [Lazzerini et al., 2022].
Во-первых, они могут напрямую влиять на функцию ионных каналов в кардиомиоцитах, что приводит к их дисфункции и будет способствовать развитию аритмии [Lazzerini et al., 2022]. Ряд исследований [Lazzerini et al., 2019; Lazzerini et al., 2020; Li et al., 2024] продемонстрировал, что воспалительные цитокины, такие как ИЛ-1, ИЛ-6 и ФНО-α, могут регулировать функцию ионных K+ и Ca2+ каналов на мембране миокарда, приводя к дисфункции и вызывая изменения продолжительности потенциала действия, что приводит к электрическому ремоделированию миокарда и аритмии [Li et al., 2024].
Во-вторых, воспалительные цитокины, особенно ИЛ-1, ИЛ-6 и ФНО-α, могут приводить к дисфункции внутриклеточного кальмодулина, например, рианодинового рецептора второго типа и саркоплазматической ретикулумной Ca2+-АТФазы, что приводит к увеличению спонтанной утечки кальция, перегрузке внутриклеточного кальция и аномальной внутриклеточной обработке кальция во время диастолы, вызывая задержку постдеполяризации и аритмию [Kole et al., 2024]. Было показано, что воспалительные цитокины, особенно ФНО -α, вызывают аномальную экспрессию и/или распределение белков щелевых контактов коннексина 40 и 43 в кардиомиоцитах. Это нарушение белков щелевых контактов может привести к дисфункции в межклеточной коммуникации, влияя на проведение электрической активности сердца [Lazzerini et al., 2019; Lazzerini et al., 2020]. В результате это приведет к замедлению проводимости и повышению ее неоднородности, тем самым способствуя эктопическому возбуждению или повторному входу (re-entry), которые являются распространенными механизмами, лежащими в основе аритмий [Lazzerini et al., 2019].
В-третьих, цитокиновые штормы могут приводить к дисфункции коагуляции и дисбалансу фибринолитической системы, вызывая тромбоэмболию легочной артерии, перегрузку правых отделов сердца и увеличение правого предсердия, повреждению эндотелия, разрыву атеросклеротической бляшки, образованию микротромбов, ишемии миокарда, инфаркту; в то же время воспалительные цитокины могут активировать миофибробласты, чтобы вызвать синтез внеклеточного матрикса, что приводит к фиброзу миокарда; все это приводит к ремоделированию сердца и повышенной восприимчивости к аритмии [Lazzerini et al., 2022].
В-четвертых, цитокины также могут влиять на парасимпатическую и симпатическую нервную систему, разрушая электрическую проводимость в сердце и приводя к развитию аритмии [Lazzerini et al., 2020; Kole et al., 2024].
В-пятых, воспалительные цитокины, такие как ИЛ-1, ИЛ-6 и ИФН-γ, также могут вызывать нарушения метаболизма цитохрома P450 печени, влиять на скорость клиренса из организма, продлевать время действия некоторых противовирусных препаратов, удлиняющих интервал QT, что приводит к выраженному удлинению интервала QT у пациентов с COVID-19 и повышению восприимчивости к аритмии [Осипова и др., 2023; El-Ghiaty et al., 2020; Lazzerini et al., 2020].
В целом нарушение регуляции иммунного ответа и цитокиновый шторм способствуют аритмии, вызывая электрическое и структурное ремоделирование сердца. Электрическое ремоделирование сердца вызвано дисфункцией ионных каналов миокарда, нарушением щелевых связей между кардиомиоцитами, аномальной регуляцией внутриклеточного кальция, автономной дисфункцией и нарушением скорости метаболизма лекарств [Lazzerini et al., 2019; El-Ghiaty et al., 2020; Lazzerini et al., 2020]. Подавление нарушений иммунного ответа и цитокинового шторма имеет решающее значение для лечения полиорганной дисфункции и снижения частоты аритмии у пациентов с COVID-19 [Lazzerini et al., 2020].
Миокардит
Существует множество исследований, показывающих, что SARS-CoV-2 может вызывать миокардит [Patone et al., 2022; Fairweather et al., 2023], однако конкретный механизм остается неясным. Предполагается, что миокардит может возникать как из-за прямого вирусного разрушения сердечных клеток, так и из-за нарушения воспалительной иммунной системы человека [Peretto et al., 2019; Bojkova et al., 2020; Dherange et al., 2020; Siripanthong et al., 2020; Fairweather et al., 2023]. Частота миокардита, связанного с COVID-19, неточна, поскольку окончательный диагноз миокардита основывается на биопсии миокарда и МРТ сердца, которые редко используются в клинической диагностике [Castiello et al., 2022]. Центры по контролю и профилактике заболеваний сообщали, что распространенность миокардита у пациентов с COVID-19 составляет менее 0,2 % от всех случаев [Boehmer et al., 2021], при этом около 7 % смертей, связанных с COVID-19, вызваны миокардитом [Ruan et al., 2020].
Аритмия является одним из клинических проявлений вирусного миокардита, и риск аритмии при миокардите, связанном с COVID-19, высок. В литературе сообщалось, что у 78,7 % пациентов с миокардитом была аритмия [DePace, Colombo, 2022; Zhan et al., 2022; Fairweather et al., 2023].
Миокардит, связанный с COVID-19, может вызывать аритмию посредством различных механизмов. Во-первых, нарушение плазматической мембраны может привести к электрической нестабильности миокарда из-за прямого повреждения кардиомиоцитов. Во-вторых, микрососудистая дисфункция может вызвать повреждение эндотелиальных клеток, что приводит к ишемии миокарда. В-третьих, может возникнуть дисфункция межклеточных щелевых соединений и аномальная экспрессия коннексина из-за повреждения клеток миокарда. Примечательно, что воспаление может способствовать формированию фиброза миокарда или рубцовой ткани, тем самым перестраивая миокард. В-четвертых, цитокины могут нарушать гомеостаз кальция и функцию ионных каналов, что приводит к длительной реполяризации потенциала действия, аномальной проводимости и развитию триггерной активности или образованию повторного входа волны возбуждения (re-entry) [Peretto et al., 2019; Zhan et al., 2022]. Эти механизмы являются предполагаемыми возможностями, и необходимы дальнейшие исследования, чтобы полностью понять сложную связь между миокардитом, связанным с COVID-19, и развитием аритмии.
Ишемия миокарда и гипоксия
SARS-CoV-2 инфицирует легочную ткань, связываясь с рецепторами ACE2 в альвеолярных эпителиальных клетках II типа, что приводит к повреждению легких, гипоксемии и острой дыхательной недостаточности [Gupta et al., 2020]. Сообщалось, что у 32 % пациентов с COVID-19 развивается гипоксемия, а 76 % требуется кислородная поддержка [Dherange et al., 2020; Zhan et al., 2020]. Низкое насыщение пациента кислородом приводит к гипоксии миокарда и ишемии [Gupta et al., 2020]. В то же время воспалительная реакция организма и иммунная система активируются из-за инфекции SARS-CoV-2, что приводит к повреждению эндотелиальных клеток сосудов и приводит к аномальной активации тромбоцитов и факторов свертывания, что ведет к гиперкоагуляции и способствует тромбозу. Тромбоз может потенциально привести к ишемии миокарда или даже инфаркту миокарда [Gupta et al., 2020; Shang et al., 2020; Donniacuo et al., 2023].
Ишемия миокарда и гипоксия могут нарушать функцию различных сердечных ионных каналов, транспортеров и ионных насосов (натриевые, калиевые и кальциевые ионные каналы, натрий-кальциевые обменники и натрий-калиевую АТФаза). Дисфункция этих каналов может привести к нарушениям концентрации ионов внутри и снаружи кардиомиоцитов, и, соответственно, к изменениям трансмембранного потенциала, что приведет к нарушению возбудимости и проводимости кардиомиоцитов, в конечном итоге к аритмии [Li et al., 2024]. Гипоксемия может вызвать вазоконстрикцию легочных артерий, что приводит к повышению давления в легочной артерии. Повышенное давление в легочной артерии еще больше нагружает правые отделы сердца, приводя к их дисфункции [Камышникова, Ефремова, 2017; Naeije et al., 2022]. Длительная ишемия миокарда и гипоксия могут привести к образованию рубцовой ткани и фиброзу в ткани миокарда, что вызовет ремоделирование структуры сердца и приведет к нарушению сердечной проводимости, способствуя триггерной активности и re-entry [Babapoor-Farrokhran et al., 2020; Zhan et al., 2022].
Электролитные нарушения и дисбаланс внутрисосудистого объема
Электролитные нарушения могут нарушать динамику ионных потоков в сердце, что приводит к изменениям концентрации ионов внутри и снаружи кардиомиоцитов. Эти изменения влияют на электрофизиологическую функцию кардиомиоцитов, потенциально приводя к аритмиям различной степени тяжести [Вишневский и др., 2022]. Экспрессия АПФ2 и чрезмерная активация РААС, вызванные вторжением SARS-CoV-2, наряду с вторичной дисфункцией почечных канальцев, из-за вирусного вторжения и гиперпродукции воспалительных факторов потенциально могут приводить к нарушениям электролитного баланса [Wang, Loscalzo, 2023]. Исследование Zhan et al. пациентов с COVID-19 показало, что у 7,2 % из них наблюдались нарушения электролитного баланса [Zhan et al., 2022]. Электролитные нарушения, включающие гипокалиемию, гипонатриемию и гипокальциемию, часто наблюдаются у пациентов с COVID-19 [Вишневский и др., 2022; Zhan et al., 2022]. У пациентов с тяжелой формой COVID-19 бывает дисбаланс внутрисосудистого объема, что может быть связано с такими состояниями, как острый респираторный дистресс-синдром или сердечная недостаточность, вызванная сепсисом [Zhan et al., 2022]. Фибрилляция предсердий является наиболее часто наблюдаемым типом аритмии у тяжелых пациентов с COVID-19, и ее возникновение может быть связано с дисбалансом внутрисосудистого объема. Избыточная нагрузка объемом может привести к растяжению предсердий и структурному ремоделированию предсердий [Вишневский и др., 2022; Li et al., 2024]. Кроме того, дисбаланс внутрисосудистого объема может вызывать изменения осмотического давления плазмы, что, в свою очередь, приводит к активации симпатической нервной системы и повышает вероятность аритмии [Zhan et al., 2022].
Проаритмические побочные эффекты лекарств
Лечение COVID-19 включает различные препараты: лопинавир/ритонавир, молнупиравир, фавипиравир, паксовид, барицитиниб, хлорохин, моноклональные антитела, глюкокортикоиды, ингибиторы ИЛ-6 и антибактериальные препараты [Zhan et al., 2022; Wang, Loscalzo, 2023]. Лопинавир/ритонавир, хлорохин, гидроксихлорохин, азитромицин могут приводить к реполяризации желудочков, удлинению интервала QT и вызывать желудочковые аритмии и даже фибрилляцию желудочков [Zequn et al., 2021; Husayn et al., 2022]. Аналогичным образом, гидроксихлорохин может вызывать полиморфную желудочковую тахикардию [Manolis et al., 2020]. Хлорохин и гидроксихлорохин могут ингибировать метаболический путь цитохрома P450, вызывать снижение клиренса лекарств, усиливать время действия препаратов, удлиняющих интервал QT, и повышать риск аритмии [Lazzerini et al., 2020; Zhan et al., 2022]. Азитромицин относится к классу макролидов и, как известно, связан с повышенным риском аритмии и сердечной смерти при использовании отдельно или в сочетании с лопинавиром/ритонавиром и хлорохином [Varney et al., 2022]. Было показано, что длительное применение азитромицина повышает концентрацию ионов натрия в кардиомиоцитах, что активирует натрий-кальциевый обменник на клеточной мембране, одновременно обеспечивая приток ионов кальция в клетку. Это увеличение внутриклеточного кальция может привести к перегрузке кальцием, что в конечном итоге вызывает удлинение интервала QT [Manolis et al., 2020].
Дисфункция вегетативной нервной системы
После заражения SARS-CoV-2 пациенты могут испытывать стресс, связанный с карантином и болезнью [DePace, Colombo, 2022]. Стресс в сочетании с эффектами лекарств может привести к дисфункции вегетативной нервной системы, которая, наряду с активацией симпато-адреналовой системы, приводит к высвобождению большого количества катехоламинов; следовательно, может возникнуть вазоконстрикция и кардиотоксичность, потенциально приводящие к повреждению миокарда или аритмии [DePace, Colombo, 2022; Zhan et al., 2022]. Кроме того, чрезмерная активация воспалительных факторов и увеличение ИЛ-6 могут стимулировать центральный гипоталамус, что приводит к чрезмерной активации сердечной симпатической системы и повышению риска развития аритмий [Manolis et al., 2021].
Механизмы аритмии у пациентов с COVID-19
В настоящее время точный механизм возникновения аритмии у пациентов с COVID-19 еще продолжает изучаться. Исходя из изученных и описанных на сегодняшний день исследований, мы представили предполагаемые механизмы аритмии у пациентов с COVID-19 на рисунке.
Потенциальные механизмы аритмии у пациентов с COVID-19 включают повреждение миокарда, вызванное прямым вторжением вирусов, миокардит, нарушение регуляции иммунного ответа и цитокиновый шторм, ишемию/гипоксию миокарда, нарушения электролитного баланса, дисбаланс внутрисосудистого объема, ремоделирование сердца, лекарственные взаимодействия, дисфункцию вегетативной нервной системы.
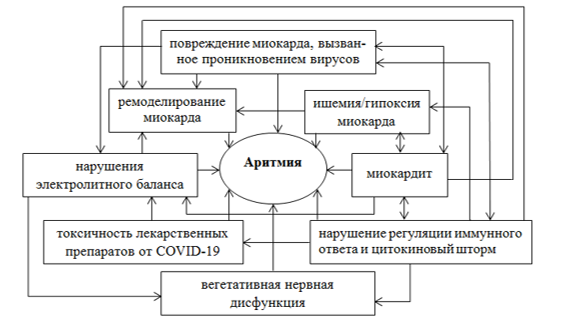
Предполагаемые механизмы аритмии и их взаимосвязь у пациентов с COVID-19
Proposed mechanisms of arrhythmia and their relationships in patients with COVID-19
Каждый из описанных выше механизмов развития аритмии влияет на другие механизмы, наибольшее число влияний имеют миокардит и нарушение регуляции иммунного ответа.
Заключение
Проведенный обзор патофизиологических механизмов аритмий, связанных с COVID-19, таких как повреждение миокарда, вызванное прямым вторжением вирусов, миокардит, нарушение регуляции иммунного ответа и цитокиновый шторм, ишемия/гипоксия миокарда, нарушение электролитного баланса, дисбаланс внутрисосудистого объема, ремоделирование сердца, лекарственные взаимодействия, дисфункция вегетативной нервной системы, может предоставить ценную информацию для осведомленности врачей и разработки профилактических мер, более эффективного мониторинга аритмий, оптимизации стратегий лечения и улучшения общего прогноза и показателей выживаемости пациентов с COVID-19.
По нашему мнению, для профилактики аритмий, связанных с COVID-19, необходим контроль состояния основного заболевания, раннее выявление и лечение повреждения миокарда и других дисфункций органов, предотвращение гипоксии, предотвращение системного воспаления и уменьшение использования препаратов, удлиняющих интервал QT.





Список литературы
Вишневский В.И., Панина Ю.Н., Вишневский М.В. 2022. Влияние дефицита электролитов на нарушения ритма сердца на фоне новой коронавирусной инфекции. Актуальные проблемы медицины. 45(1): 55–64. doi: 10.52575/2687-0940-2022-45-1-55-64
Камышникова Л.А., Ефремова О.А. 2017. Влияние сопутствующих заболеваний на ремоделирование и дисфункцию сердца при хронической сердечной недостаточности с сохранной фракцией выброса. Клиническая медицина. 95(12): 1070–1076.
Камышникова Л.А., Ефремова О.А., Фентисов В.В., Болховитина О.А., Чурносов М.И. 2024. Генетические детерминанты уровня ангиотензинпревращающего фермента (данные полногеномных исследований). Артериальная гипертензия. 30(6): 537–552. doi:10.18705/1607-419X-2024-2446
Осипова О.А., Шепель Р.Н., Каруцкая О.А., Комисов А.А., Демко В.В., Белоусова О.Н., Чупаха М.В. 2023. Роль циркулирующих биомаркеров у пациентов, перенесших COVID-19. Актуальные проблемы медицины. 46(3): 231–244. doi: 10.52575/2687-0940-2023-46-3-231-244
Babapoor-Farrokhran S., Gill D., Walker J., Rasekhi R.T., Bozorgnia B., Amanullah A. 2020. Myocardial Injury and COVID-19: Possible Mechanisms. Life Sci. 253: 117723. doi: 10.1016/j.lfs.2020.117723
Bhatla A., Mayer M.M., Adusumalli S., Hyman M.C., Oh E., Tierney A., Moss J., Chahal A.A., Anesi G., Denduluri S., Domenico C.M., Arkles J., Abella B.S., Bullinga J.R., Callans D.J., Dixit S., Epstein A.E., Frankel D.S., Garcia F.C., Kumareswaram R., Nazarian S., Riley M.P., Santangeli P., Schaller R.D., Supple G.E., Lin D., Marchlinski F., Deo R. 2020. COVID-19 and Cardiac Arrhythmias. Heart Rhythm. 17:1439–1444. doi: 10.1016/j.hrthm.2020.06.016
Boehmer T.K., Kompaniyets L., Lavery A.M., Hsu J., Ko J.Y., Yusuf H., Romano S.D., Gundlapalli A.V., Oster M.E., Harris A.M. 2021. Association Between COVID-19 and Myocarditis Using Hospital-Based Administrative Data – United States, March 2020 – January 2021. MMWR Morb Mortal Wkly Rep. 70: 1228–1232. doi: 10.15585/mmwr.mm7035e5
Bojkova D., Wagner J.U.G., Shumliakivska M., Aslan G.S., Saleem U., Hansen A., Luxán G., Günther S., Pham M.D., Krishnan J., Harter P.N., Ermel U.H., Frangakis A.S., Milting H., Zeiher A.M., Klingel K., Cinatl J., Dendorfer A., Eschenhagen T., Tschöpe C., Ciesek S., Dimmeler S. SARS-CoV-2 Infects and Induces Cytotoxic Effects in Human Cardiomyocytes. Cardiovasc Res. 2020; 116: 2207–2215. doi: 10.1093/cvr/cvaa267
Boulos P.K., Freeman S.V., Henry T.D., Mahmud E., Messenger J.C. 2023. Interaction of COVID-19 with Common Cardiovascular Disorders. Circ Res. 132: 1259–1271. doi: 10.1161/CIRCRESAHA.122.321952
Castiello T., Georgiopoulos G., Finocchiaro G., Claudia M., Gianatti A., Delialis D., Aimo A., Prasad S. 2022. COVID-19 and Myocarditis: A Systematic Review and Overview of Current Challenges. Heart Fail Rev. 27: 251–261. doi: 10.1007/s10741-021-10087-9
Chen N., Zhou M., Dong X., Qu J., Gong F., Han Y., Qiu Y., Wang J., Liu Y., Wei Y., Xia J., Yu T., Zhang X., Zhang L. 2020. Epidemiological and Clinical Characteristics of 99 Cases of 2019 Novel Coronavirus Pneumonia in Wuhan, China: A Descriptive Study. Lancet. 395: 507–513. doi: 10.1016/S0140-6736(20)30211-7
Chung M.K., Zidar D.A., Bristow M.R., Cameron S.J., Chan T., Harding C.V. 3rd, Kwon D.H., Singh T., Tilton J.C., Tsai E.J., Tucker N.R., Barnard J., Loscalzo J. 2021. COVID-19 and Cardiovascular Disease: From Bench to Bedside. Circ Res. 128: 1214–1236. doi: 10.1161/CIRCRESAHA.121.317997
DePace N.L., Colombo J. 2022. Long-COVID Syndrome and the Cardiovascular System: A Review of Neurocardiologic Effects on Multiple Systems. Curr Cardiol Rep. 24:1711–1726. doi: 10.1007/s11886-022-01786-2
Dherange P., Lang J., Qian P., Oberfeld B., Sauer W.H., Koplan B., Tedrow U. 2020. Arrhythmias and COVID-19: A Review. JACC Clin Electrophysiol. 6: 1193–1204. doi: 10.1016/j.jacep.2020.08.002
Donniacuo M., De Angelis A., Rafaniello C., Cianflone E., Paolisso P., Torella D., Sibilio G., Paolisso G., Castaldo G., Urbanek K., Rossi F., Berrino L., Cappetta D. 2023. COVID-19 and Atrial Fibrillation: Intercepting Lines. Front Cardiovasc Med. 10: 1093053. doi: 10.3389/fcvm.2023.1093053
Driggin E., Madhavan M.V., Bikdeli B., Chuich T., Laracy J., Biondi-Zoccai G., Brown T.S., Der Nigoghossian C., Zidar D.A., Haythe J., Brodie D., Beckman J.A., Kirtane A.J., Stone G.W., Krumholz H.M., Parikh S.A. 2020. Cardiovascular Considerations for Patients, Health Care Workers, and Health Systems During the COVID-19 Pandemic. J. Am. Coll. Cardiol. 75: 2352–2371. doi: 10.1016/j.jacc.2020.03.031
El-Ghiaty M.A., Shoieb S.M., El-Kadi A.O.S. 2020. Cytochrome P450-mediated drug interactions in COVID-19 Patients: Current Findings and Possible Mechanisms. Med Hypotheses. 144: 110033. doi: 10.1016/j.mehy.2020.110033
Fairweather D., Beetler D.J., Di Florio D.N., Musigk N., Heidecker B., Cooper L.T. Jr. 2023. COVID-19, Myocarditis and Pericarditis. Circ Res. 132: 1302–1319. doi: 10.1161/CIRCRESAHA.123.321878
Gupta A., Madhavan M.V., Sehgal K., Nair N., Mahajan S., Sehrawat T.S., Bikdeli B., Ahluwalia N., Ausiello J.C., Wan E.Y., Freedberg D.E., Kirtane A.J., Parikh S.A., Maurer M.S., Nordvig A.S., Accili D., Bathon J.M., Mohan S., Bauer K.A., Leon M.B., Krumholz H.M., Uriel N., Mehra M.R., Elkind M.S.V., Stone G.W., Schwartz A., Ho D.D., Bilezikian J.P., Landry D.W. 2020. Extrapulmonary Manifestations of COVID-19. Nat Med. 26: 1017–1032. doi: 10.1038/s41591-020-0968-3
Guzik T.J., Mohiddin S.A., Dimarco A., Patel V., Savvatis K., Marelli-Berg F.M., Madhur M.S., Tomaszewski M., Maffia P., D'Acquisto F., Nicklin S.A., Marian A.J., Nosalski R., Murray E.C., Guzik B., Berry C., Touyz R.M., Kreutz R., Wang D.W., Bhella D., Sagliocco O., Crea F., Thomson E.C., McInnes I.B. 2020. COVID-19 and the Cardiovascular System: Implications for Risk Assessment, Diagnosis, and Treatment Options. Cardiovasc Res. 116: 1666–1687. doi: 10.1093/cvr/cvaa106
Han Y., Zhu J., Yang L., Nilsson-Payant B.E., Hurtado R., Lacko L.A., Sun X., Gade A.R., Higgins C.A., Sisso W.J., Dong X., Wang M., Chen Z., Ho D.D., Pitt G.S., Schwartz R.E., tenOever B.R., Evans T., Chen S. 2022. SARS-CoV-2 Infection Induces Ferroptosis of Sinoatrial Node Pacemaker Cells. Circ Res. 130:963–977. doi: 10.1161/CIRCRESAHA.121.320518
Husayn S.S., Brown J.D., Presley C.L., Boghean K., Waller J.D. 2022. Hydroxychloroquine Alternatives for Chronic Disease: Response to a Growing Shortage Amid the Global COVID-19 Pandemic. J. Pharm. Pract. 35: 120–125. doi: 10.1177/0897190020942658
Kole C., Stefanou Ε., Karvelas N., Schizas D., Toutouzas K.P. 2024. Acute and Post-Acute COVID-19 Cardiovascular Complications: A Comprehensive Review. Cardiovasc Drugs Ther. 38, 1017–1032. https://doi.org/10.1007/s10557-023-07465-w
Lazzerini P.E., Boutjdir M., Capecchi P.L. 2020. COVID-19, Arrhythmic Risk, and Inflammation: Mind the Gap! Circulation. 142: 7–9. doi: 10.1161/CIRCULATIONAHA.120.047293
Lazzerini P.E., Laghi-Pasini F., Boutjdir M., Capecchi P.L. 2019. Cardioimmunology of Arrhythmias: The Role of Autoimmune and Inflammatory Cardiac Channelopathies. Nat Rev Immunol. 19: 63–64. doi: 10.1038/s41577-018-0098-z
Lazzerini P.E., Laghi-Pasini F., Boutjdir M., Capecchi P.L. 2022. Inflammatory Cytokines and Cardiac Arrhythmias: The Lesson from COVID-19. Nat Rev Immunol. 22: 270–272. doi: 10.1038/s41577-022-00714-3
Li J., Huang Q., Liang Y., Jiang J., Yang Y., Feng J., Tan X., Li T. 2024 The Potential Mechanisms of Arrhythmia in Coronavirus Disease – 2019. Int. J. Med. Sci. 19; 21(7): 1366–1377. doi: 10.7150/ijms.94578
Manolis A.A., Manolis T.A., Apostolopoulos E.J., Apostolaki N.E., Melita H., Manolis A.S. 2021. The Role of the Autonomic Nervous System in Cardiac Arrhythmias: The Neuro-Cardiac Axis, More Foe than Friend? Trends Cardiovasc Med. 31: 290–302. doi: 10.1016/j.tcm.2020.04.011
Manolis A.S., Manolis A.A., Manolis T.A. Apostolopoulos E.J., Papatheou D., Melita H. 2020. COVID-19 Infection and Cardiac Arrhythmias. Trends Cardiovasc Med. 30: 451–460. doi: 10.1016/j.tcm.2020.08.002
Naeije R., Richter M.J., Rubin L.J. 2022. The Physiological Basis of Pulmonary Arterial Hypertension. Eur Respir J. 59(6): 2102334. doi: 10.1183/13993003.02334-2021
Ning Q., Wu D., Wang X., Xi D., Chen T., Chen G., Wang H., Lu H., Wang M., Zhu L., Hu J., Liu T., Ma K., Han M., Luo X. 2022. The Mechanism Underlying Extrapulmonary Complications of the Coronavirus Disease 2019 and its Therapeutic Implication. Signal Transduct Target Ther. 7: 57. doi: 10.1038/s41392-022-00907-1
Nishiga M., Wang D.W., Han Y., Lewis D.B., Wu J.C. 2020. COVID-19 and Cardiovascular Disease: From Basic Mechanisms to Clinical Perspectives. Nat Rev Cardiol. 17: 543–558. doi: 10.1038/s41569-020-0413-9
Patone M., Mei X.W., Handunnetthi L., Dixon S., Zaccardi F., Shankar-Hari M., Watkinson P., Khunti K., Harnden A., Coupland C.A.C., Channon K.M., Mills N.L., Sheikh A., Hippisley-Cox J. 2022. Risks of Myocarditis, Pericarditis, and Cardiac Arrhythmias Associated with COVID-19 Vaccination or SARS-CoV-2 Infection. Nat Med. 28: 410–422. doi: 10.1038/s41591-021-01630-0
Peretto G., Sala S., Rizzo S., De Luca G., Campochiaro C., Sartorelli S., Benedetti G., Palmisano A., Esposito A., Tresoldi M., Thiene G., Basso C., Della Bella P. 2019. Arrhythmias in Myocarditis: State of the Art. Heart Rhythm. 16: 793–801. doi: 10.1016/j.hrthm.2018.11.024
Ruan Q., Yang K., Wang W., Jiang L., Song J. 2020. Clinical Predictors of Mortality Due to COVID-19 Based on an Analysis of Data of 150 Patients from Wuhan, China. Intensive Care Med. 46: 846–848. doi: 10.1007/s00134-020-05991-x
Shang J., Ye G., Shi K., Yu. Wan, Luo C., Aihara H., Geng Q., Auerbach A., Li F. 2020. Structural Basis of Receptor Recognition by SARS-CoV-2. Nature. 581: 221–4. doi: 10.1038/s41586-020-2179-y
Siripanthong B., Nazarian S., Muser D., Deo R., Santangeli P., Khanji M.Y., Cooper L.T. Jr, Chahal C.A.A. 2020. Recognizing COVID-19-Related Myocarditis: The Possible Pathophysiology and Proposed Guideline for Diagnosis and Management. Heart Rhythm. 17: 1463–1471. doi: 10.1016/j.hrthm.2020.05.001
Varney J.A., Dong V.S., Tsao T., Sabir M.S., Rivera A.T., Ghula S., Moriles K.E., Cherukuri M.L., Fazal R., Azevedo C.B., Mohamed R.M., Jackson G.R., Fleming S.E., Rochez D.E., Abbas K.S., Shah J.H., Minh L.H.N., Osman F., Rafla S.M., Huy N.T. 2022. COVID-19 and Arrhythmia: An Overview. J Cardiol. 79: 468–475. doi: 10.1016/j.jjcc.2021.11.019
Wang R.S., Loscalzo J. 2023. Repurposing Drugs for the Treatment of COVID-19 and Its Cardiovascular Manifestations. Circ Res. 132: 1374–1386. doi: 10.1161/CIRCRESAHA.122.321879
Wong L.R., Perlman S. 2022. Immune Dysregulation and Immunopathology Induced by SARS-CoV-2 and Related Coronaviruses - Are We Our Own Worst Enemy? Nat Rev Immunol. 22: 47–56. doi: 10.1038/s41577-021-00656-2
Yang L., Liu S., Liu J., Zhang Z., Wan X., Huang B., Chen Y., Zhang Y. 2020. COVID-19: Immunopathogenesis and Immunotherapeutics. Signal Transduct Target Ther. 5:128. doi: 10.1038/s41392-020-00243-2
Zequn Z., Yujia W., Dingding Q., Jiangfang L. 2021. Off-label Use of Chloroquine, Hydroxychloroquine, Azithromycin and Lopinavir/Ritonavir in COVID-19 Risks Prolonging the QT Interval by Targeting the hERG Channel. Eur J Pharmacol. 893:173813. doi: 10.1016/j.ejphar.2020.173813
Zhan Y., Yue H., Liang W., Wu Z. 2022. Effects of COVID-19 on Arrhythmia. J Cardiovasc Dev Dis. 9: 292. doi: 10.3390/jcdd9090292
Zheng Y.Y., Ma Y.T., Zhang J.Y., Xie X. 2020. COVID-19 and the Cardiovascular System. Nat Rev Cardiol. 17:259–260. doi: 10.1038/s41569-020-0360-5