Опыт проведения хирургической санации полости рта у пациента с прогрессирующей формой оссифицирующей фибродисплазии
Aннотация
Представлено ретроспективное описание клинического случая проведения хирургической санации полости рта у пациента с орфанным заболеванием – фибродисплазией оссифицирующей прогрессирующей (ФОП). Особенность заболевания состоит в том, что из-за генетической мутации в организме костная ткань (оссификаты) образуется там, где её не должно быть, а именно внутри мышц, сухожилий, связок, фасций, апоневрозов, в результате чего происходит формирование качественно нормальной кости во внескелетных участках. Дебют заболевания у пациента произошел в 10-летнем возрасте. После неоднократных травм появлялись костные конгломераты в области лопаток, позвоночника, нижних конечностях. Проводились попытки удаления оссификатов, но после оперативных вмешательств они появлялись вновь. Впервые диагноз ФОП был установлен пациенту в возрасте 15 лет в Свердловском научно-исследовательском институте ортопедии и травматологии. Примерно с 35-летнего возраста пациент начал отмечать ограничение открывания рта до полного его закрытия. Обратился с жалобами на боль в области отдельных групп зубов верхней и нижней челюсти в стоматологическую больницу Клинического многопрофильного медицинского центра Пермского государственного медицинского университета имени академика Е.А. Вагнера Минздрава России в 2017 году. Представлена тактика хирургической санации полости рта и особенности проведения общего обезболивания у пациента с ФОП. Данный клинический опыт может быть полезен специалистам хирургического профиля и анестезиологам.
Ключевые слова: орфанное заболевание, фибродисплазия оссифицирующая прогрессирующая, хирургическая санация полости рта, назотрахеальная интубация с помощью фибробронхоскопа
Введение
Фибродисплазия оссифицирующая прогрессирующая (ФОП) относится к орфанным заболеваниям, особенностью которой является образование оссификатов в различных тканях организма из-за генетической мутации [Севбитов и др., 2019].
Костная ткань образуется там, где ее не должно быть, а именно внутри мышц, сухожилий, связок, фасций, апоневрозов, в результате чего происходит формирование качественно нормальной кости во внескелетных участках [Кораблева и др., 2022; Bastepe, Jüppner, 2018], за исключением диафрагмы, языка, глазодвигательных мышц, миокарда и гладкой мускулатуры [Grunwald et al., 2022].
Постепенно суставы и позвоночник становятся малоподвижными, иногда до полной утраты своей функции c развитием костного анкилоза; мышечная ткань также оссифицируется [Даньшина, 2019; Kaplan et al., 2019]. Любая, даже малозначительная травма, воспалительная реакция, хирургическое вмешательство или инъекции могут спровоцировать обострение болезни и привести к кальцификации и окостенению мягких тканей [Севбитов и др., 2021; Eekhoff et al., 2017; Hsiao et al., 2019].
По данным литературы, распространенность данного заболевания примерно 1 случай – 1,65 млн населения [Козлова, Демикова, 2007]. В России зарегистрировано около 80 пациентов с диагнозом «фибродисплазия оссифицирующая прогрессирующая», а в мире всего около 900 человек.
Впервые российскими врачами в 2014 году проанализированы и описаны пять клинических случаев ФОП у детей с началом заболевания в различные возрастные периоды от 10 месяцев до 16 лет [Коваленко-Клычкова и др., 2014; Saeed et al., 2023]. Спустя год выявлен случай заболевания ФОП у пациента 47 лет, первичные признаки которого проявлялись с раннего детского возраста [Антелава и др., 2015].
Клиническая картина ФОП. Проявиться данное заболевание может как в детском возрасте [Solomon et al., 2018; Shah et al., 2019], так и у взрослого человека. Одним из признаков ФОП у новорожденных может быть деформация больших пальцев ног. Первичные симптомы выявляются до начала подросткового возраста. При этом в местах травм формируются болезненные конгломераты в виде оссификатов в мягких тканях [Meyers et al., 2019], которые нередко принимают за неопластический процесс. Попытки оперативного лечения образовавшихся гетеротопических оссификатов приводят к новым обострениям [Pignolo et al., 2011].
Также обострения ФОП могут быть спровоцированы не только в результате механической травмы, но и острыми воспалительными процессами и любыми инъекционными процедурами. Как правило, ближе к тридцатилетнему возрасту нарушение двигательной функции прогрессирует, что приводит к анкилозированию суставов и дальнейшей инвалидизации пациентов [Pignolo et al., 2011]. Наиболее выраженные проявления заболевания (образование крупных оссификатов) характерны для суставов позвоночника, чаще всего первым страдает шейный отдел. В связи с анкилозированием нижней челюсти может возникать выраженная потеря массы тела. В результате необратимых изменений структур среднего и внутреннего уха может снижаться слух [Shaikh et al., 2023].
При обследовании стоматологического статуса у пациентов с ФОП выявлены различные патологические состояния. Поражения твердых тканей зубов встречались у 85 % пациентов, отмечено наличие заболеваний слизистой оболочки полости рта, нарушение положения зубов. У трети части пациентов гигиена полости рта была неудовлетворительной [Даньшина, 2021].
Оперативные вмешательства пациентам с ФОП возможны только по жизненным показаниям. Тем не менее в ряде случаев с учетом высоких рисков развития осложнений необходимо выполнение хирургического лечения в плановом порядке, в том числе в челюстно-лицевой области. В качестве консервативного лечения показано назначение глюкокортикоидов и нестероидных противовоспалительных препаратов, преимущественно лечение направлено на предотвращение обострений и улучшение качества жизни [Aziz, Panhwar, 2019].
Ниже представлено ретроспективное описание клинического случая хирургической санации полости рта под эндотрахеальным наркозом у пациента с орфанным заболеванием (ФОП).
Клинический случай, ретроспективное описание
В 2017 году в отделение челюстно-лицевой хирургии клинической стоматологической больницы Пермского государственного медицинского университета имени академика Е.А. Вагнера Минздрава России (ПГМУ) обратился пациент О. 44 года с жалобами на периодически возникающую боль в области зубов верхней и нижней челюсти, невозможность открывания рта, приема и разжевывания пищи.
Из анамнеза: пациент – инвалид I группы по заболеванию Фибродисплазия оссифицирующая прогрессирующая (ФОП). Данным заболеванием страдает с детства. С 10-летнего возраста после травм появились костные конгломераты в области лопаток, позвоночника, плечевых и бедренных костей, коленных суставов. Неоднократно проводились попытки удаления данных оссификатов в медицинских учреждения г. Березники Пермского края, а также в г. Москва. После оперативных вмешательств через 2–3 месяца оссификаты появлялись вновь. Впервые диагноз ФОП был поставлен пациенту в возрасте 15 лет в Свердловском НИИ ортопедии и травматологии. Терапевтическая санация полости рта пациенту проводилась более 10 лет назад. С 35-летнего возраста начал отмечать ограничение открывания рта, до полного его закрытия. В течение последних 5 лет отмечает постепенное разрушение коронок 1.6, 1.1, 3.7, 3.6, 4.5 зубов. За медицинской помощью не обращался по причине невозможности открывания рта. Последние 3 месяца начал отмечать периодические боли в указанных зубах, что явилось причиной обращения в клиническую стоматологическую больницу ПГМУ.
Общее состояние у пациента при осмотре было удовлетворительное. Сознание ясное, когнитивные функции сохранены. Клинически значимых нарушений со стороны систем организма, за исключением костно-мышечной, выявлено не было. Передвижения пациента ограничены ввиду значительной деформации спины и нижних конечностей и осуществляются с использованием кресла-каталки. Позвоночный столб и лопаточные области деформированы за счет разрастания конгломерата оссификатов неправильной формы (рис. 1).
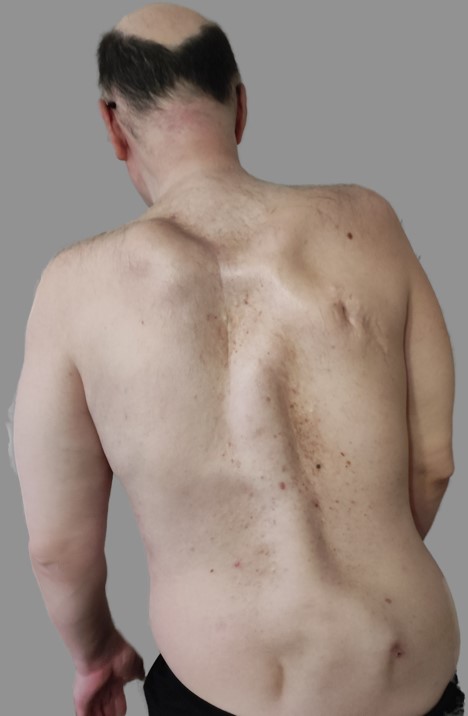
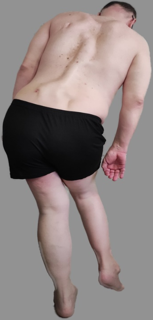
Рис. 1. Деформация спины и нижних конечностей, вид сзади
Fig. 1. Deformation of the back and lower extremities, rear view
Движения шейного отдела позвоночника отсутствуют. Отмечается одностороннее анкилозирование тазобедренного, коленного и голеностопного суставов левой конечности. Пальцы рук и ног деформированы (рис. 2).
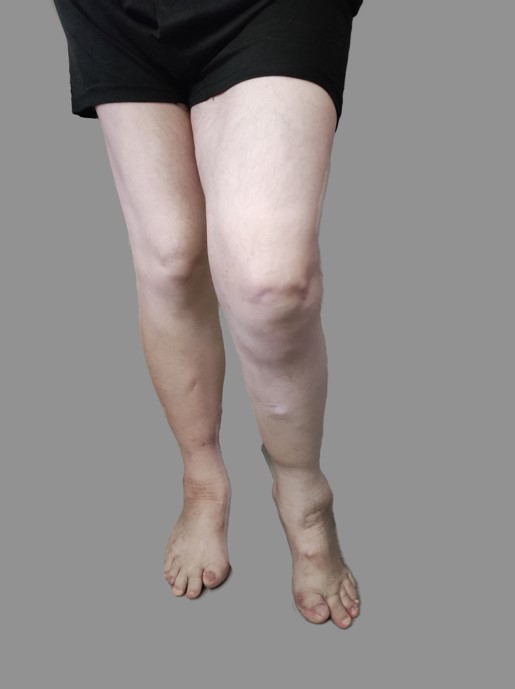

Рис. 2. Деформация нижних конечностей, вид спереди и сбоку
Fig. 2. Deformation of the lower extremities, front and side views
Местный статус: Конфигурация лица не нарушена. Кожные покровы в цвете не изменены. При пальпации ткани эластической консистенции, безболезненные. Региональные лимфатические узлы не увеличены. Чувствительность мягких тканей лица не нарушена. Открывание рта невозможно (рис. 3).

Рис. 3. Степень открывания рта
Fig. 3. Degree of mouth opening
В области преддверия полости рта слизистая оболочка физиологической окраски, влажная, блестящая. Зубы 1.6, 1.1, 4.5 разрушены полностью, коронковая часть зубов отсутствует, корни пигментированы, перкуссия их слабо болезненная, слизистая оболочка вокруг корней зубов розовая, отёчная. На дистальной поверхности 3.6 зуба и медиальной поверхности 3.7 зуба имеются глубокие кариозные полости, коронковые части этих зубов серого цвета, перкуссия слабоболезненная, слизистая оболочка не изменена. Прикус ортогнатический.
На ОПТГ и КЛКТ челюстей от 07.06.2017: имеются признаки двустороннего полного костного анкилоза нижней челюсти. Определяется полное сращение венечных отростков справа и слева с основанием костей черепа. Определяются кариозные дефекты 1.6, 1.1, 4.5, 3.6, 3.7 зубов, периодонтальная щель их расширена. Корневые каналы 1.1, 3.6 и 4.5 зубов запломбированы рентгеноконтрастными материалом (рис. 4, 5).
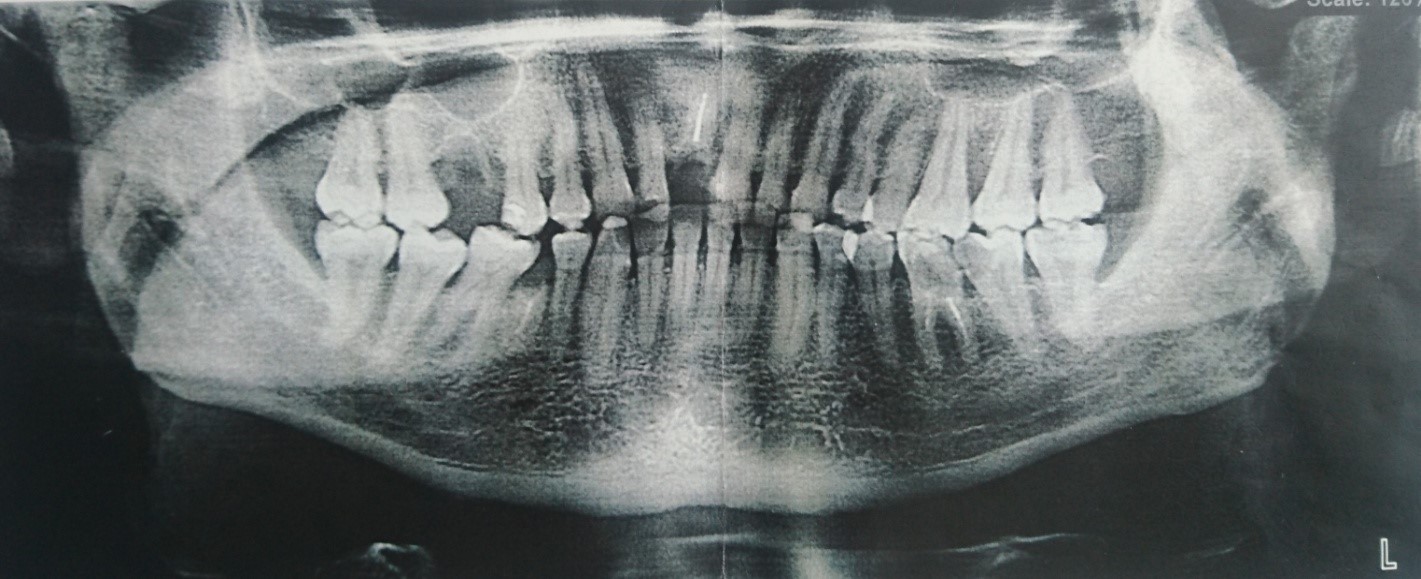
Рис. 4. Ортопантомограмма пациента О., 44 года, до лечения
Fig. 4. Orthopantomogram of patient O., 44 years old, before treatment

Рис. 5. КЛКТ-исследование ВНЧС пациента О., 44 года
Fig. 5. Computer examination of the patient's temporomandibular joint (Patient: O., 44 years old)
Были проведены дополнительные лабораторные и инструментальные обследования: анализы крови и мочи, электрокардиография – без клинических значимых отклонений. На основании клинико-анамнестических данных и результатов рентгенологического исследования установлен диагноз: двусторонний костный анкилоз на фоне прогрессирующей оссифицирующей фибродисплазии. Хронический периодонтит 1.6, 1.1, 3.6, 3.7, 4.5 зубов.
Ввиду наличия хронических одонтогенных очагов инфекции, сопровождающихся болевым синдромом, а также высокого риска развития гнойно-воспалительных осложнений коллегиально принято решение о госпитализации пациента в отделение челюстно-лицевой хирургии для проведения хирургической санации полости рта под эндотрахеальным наркозом (далее – ЭТН) с эндоскопической назотрахеальной интубацией.
В положении лёжа с учетом патологических изменений костно-мышечной системы пациента проведена внутривенная премедикация преднизолоном (90 мг), атропином (0,5 мг) и фентанилом (0,1 мг). Ротоглотка орошена 10 % спреем лидокаина с целью аппликационной анестезии. Далее с помощью эндоскопа через правый нижний носовой ход визуализирована голосовая щель, связки подвижны, смыкаются. Эндоскоп проведен в трахею на 4 см над бифуркацией, по эндоскопу проведена эндотрахеальная трубка диаметром 7.0 (рис. 6).

Рис. 6. Момент проведения ФБС и назотрахеальной интубации. Положение пациента
Fig. 6. The moment of FBS and nasotracheal intubation. Patient position
Под ЭТН рассечена слизистая оболочка с вестибулярной поверхности альвеолярного отростка нижней челюсти слева по маргинальному краю в области 3.6, 3.7 зубов с выкраиванием Г-образного лоскута. С помощью пъезотома в области 3.6 и 3.7 зубов удалена наружная кортикальная пластинка до ½ высоты корней. С помощью элеватора 3.6 зуб смещен в вестибулярную сторону и удален. Зуб 3.7 удален аналогичным образом. Проведена антисептическая обработка лунок 0,05 % раствором хлоргекседина. В лунки уложена гемостатическая губка, лоскут возвращен на место и фиксирован швами сапфил 4.0. Проведена отсепаровка слизистой оболочки с вестибулярной поверхности корня 4.5 зуба. Пьезотомом корень 4.5 зуба освобожден от наружной кортикальной пластинки, смещен элеватором вестибулярно и удален. Аналогично проведено удаление корней 1.6 и 1.1 зубов (рис. 7). Промывание лунок 0,05 % раствором хлоргексидина, в лунки уложена гемостатическая губка, проведено ушивание лунок сапфилом 4.0. Интраоперационно внутривенно введен цефтриаксон 2,0 и метронидазол 0,5.


Рис. 7. Этапы удаления зуба 1.1
Fig. 7. Stages of tooth extraction 1.1
Длительность оперативного вмешательства составила 1 час 05 минут, длительность наркоза – 2 часа 55 минут. Пациент экстубирован без особенностей, на операционном столе, переведен в палату интенсивной терапии. На контрольной ОПТГ от 13.06.2017 лунки удаленных зубов 1.6, 1.1, 4.5, 3.6, 3.7 без инородных тел (рис. 8).

Рис. 8. Контрольная ОПТГ после хирургической санации полости рта
Fig. 8. Control OPTG after surgical sanitation of the oral cavity
В послеоперационном периоде продолжена антибактериальная терапия (цефтриаксон по 1,0 2 раза в день внутривенно в течение 5 дней, метронидазол по 0,5 внутривенно 3 раза в день 5 дней), кетопрофен 100 мг внутривенно 2 раза в день 3 дня, преднизолон внутривенно 60 мг однократно, 30 мг однократно.
Послеоперационный период протекал без особенностей, ежедневно проводилась антисептическая обработка полости рта 0,05 % раствором хлоргексидина, аппликации с кератопластическими препаратами.
Пациент выписан в удовлетворительном состоянии на 5-е сутки после проведенной хирургической санации полости рта. На момент выписки лунки удаленных зубов в стадии гранулирования и краевой эпителизации.
Обсуждение
Пациент 44 года, с установленным диагнозом фибродисплазии прогрессирующей оссифицирующей, с дебютом заболевания в 10-летнем возрасте и дальнейшим его прогрессирующим течением, а именно с появлением костных конгломератов в области лопаток, позвоночника, плечевых и бедренных костей, коленных суставов, которые неоднократно подвергались попыткам удаления, но после оперативных вмешательств через 2–3 месяца появлялись вновь. В литературе описаны результаты изучения КТ-исследований пациентов с ФОП, которым проводились инвазивные стоматологические вмешательства. Обнаружено, что в области соединительнотканных образований возможно появление гетеротопических оссификатов, вызывающих тяжёлые функциональные нарушения в челюстно-лицевой области, 85 % пациентов с данной патологией страдают кариозными поражениями зубов в связи с неудовлетворительной гигиеной полости рта [Даньшина, 2021]. Наш пациент с 35-летнего возраста начал отмечать ограничение открывания рта вплоть до полного его закрытия. В течение последних 5 лет отмечал постепенное разрушение коронок 1.6, 1.1, 3.7, 3.6, 4.5 зубов. На ОПТГ и КТ исследовании определялись признаки двухстороннего полного костного анкилоза нижней челюсти, полное сращение венечных отростков справа и слева с основанием костей черепа, а также кариозные дефекты 1.6, 1.1, 4.5, 3.6, 3.7 зубов с расширением периодонтальной щели. За медицинской помощью пациент не обращался до появления периодических болей в данных зубах длительный период времени, что послужило причиной проведения хирургической санации полости рта.
При оказании медицинской помощи данному пациенту были соблюдены необходимые правила. Не осуществлялись внутримышечные инъекции. В качестве консервативного лечения были использованы стероидные противовоспалительные препараты и НПВС, лечение направлено на предотвращение обострения ФОП, как описано ранее [Aziz, Panhwar, 2019]. Хирургическое вмешательство проведено под эндотрахеальным наркозом атравматично с использованием пъезотома, после удаления зубов лунки ушиты. Наложение марлевого тампона с целью остановки кровотечения и сдавливание краев лунки удаленных зубов, чтобы не спровоцировать обострение ФОП, не проводилось. При проведении ЭТН применена назотрахеальная интубация по фибробронхоскопу. Сведения о проведении подобных операций данной категории пациентов в источниках литературы отсутствуют.
Заключение
Уникальность данного случая заключается в том, что хирургическая санация полости рта под эндотрахеальным наркозом с назотрахеальной интубацией пациенту с ФОП проведена при полном отсутствии функции открывания рта. Методика проведения хирургического вмешательства и особенности проведения анестезиологического пособия опубликованы впервые. Клинический случай считаем интересным с практической точки зрения для специалистов хирургического профиля разных специальностей и врачей-анестезиологов.
Благодарности
Работа выполнена без внешних источников финансирования.





Список литературы
Антелава О.А., Никишина И.П., Гусева И.А., Мякоткин В.А., Хелковская-Сергеева А.Н., Насонов Е.Л., Раденска-Лоповок С.Г. 2015. Прогрессирующая оссифицирующая фибродисплазия. РМЖ. 23(7): 415–420.
Даньшина С.Д. 2019. Влияние фибродисплазии оссифицирующей прогрессирующей на суставы. Инновационные технологии в медицине: взгляд молодого специалиста. Рязань: Рязанский государственный медицинский университет имени академика И.П. Павлова.180–181.
Даньшина С.Д. 2021. Характеристика исследования состояния органов и тканей полости рта пациентов с заболеванием фибродисплазия оссифицирующая прогрессирующая: Автореф. дис. к-та мед. наук С.Д. Даньшина. Москва. 24 с.
Коваленко-Клычкова Н.А., Клычкова И.Ю., Кенис В.М., Мельченко Е.В. 2014. Прогрессирующая оссифицирующая фибродисплазия у детей (обзор литературы и анализ 5 клинических случаев) Травматология и ортопедия России. 20(1): 102–109. doi: 10.21823/2311-2905-51
Козлова С.И., Демикова Н.С. 2007. Наследственные синдромы и медико-генетическое консультирование. КМК - 448 с.
Кораблева Н.Н., Берестнев Е.В., Киселев С.М., Чипсанова Н.Ф. 2022. Фибродисплазия оссифицирующая прогрессирующая: литературный обзор и описание клинического случая. Вопросы современной педиатрии. 21(6S): 558–569. doi: 10.15690/vsp.v21i6S.2482
Севбитов А.В., Даньшина С.Д., Борисов В.В., Платонова В.В., Кузнецов И.И. 2021. Диагностика оссификатов с применением методов компьютерной томограммы у пациентов с диагнозом «фибродисплазия оссифицирующая прогрессирующая». Вестник Волгоградского государственного медицинского университета. 1: 154–158. doi: 10.19163/1994-9480-2021-1(77)-154-158
Севбитов А.В., Даньшина С.Д., Кузнецова М.Ю., Платонова В.В. 2019. ICON как метод выбора неинъекционного метода лечения начального кариеса у пациентов с фибродисплазией оссифицирующей прогрессирующей: клинический случай. Российский стоматологический журнал. 23(6): 280–283.
Aziz P.A.A., Panhwar I.A. 2019. Fibrodysplasia Ossificans Progressiva in a 5-Year Boy. J. Coll. Physicians Surg. Pak. 29(11): 1129–1130. doi: 10.29271/jcpsp.2019.11.1129
Bastepe M., Jüppner H. 2016. Pseudohypoparathyroidism, Albright’s Hereditary Osteodystrophy, and Progressive Osseous Heteroplasia: Disorders Caused by Inactivating GNAS Mutations. In: Endocrinology: Adult and Pediatric. 1147–1159. doi: 10.1016/b978-0-323-18907-1.00066-4
Eekhoff E., Netelenbos J., de Graaf P., Hoebink M., Bravenboer N., Micha D., Pals G., de Vries T., Lammertsma А., Raijmakers P., Robert J. 2017. Flare-Up After Maxillofacial Surgery in a Patient With Fibrodysplasia Ossificans Progressiva: An [18F]-NaF PET/CT Study and a Systematic Review. JBMR Plus. 2(1): 55–58. doi: 10.1002/jbm4.1000
Grunwald Z., Kilmartin E., Rabinowitz А., Kaplan F., Lehmann S. 2022. Anaesthesia Recommendations for Fibrodysplasia Ossificans Progressive. http://www.orphananesthesia.eu/
Hsiao E.C., Di Rocco M., Cali A., Zasloff M., Al Mukaddam M., Pignolo R.J., Grunwald Z., Netelenbos C., Keen R., Baujat G., Brown M.A., Cho T.J., De Cunto C., Delai P., Haga N., Morhart R., Scott C., Zhang K., Diecidue R.J., Friedman C.S., Kaplan F.S., Eekhoff E.M.W. 2018. Special Considerations for Clinical Trials in Fibrodysplasia Ossificans Progressiva (FOP). Br. J. Clin. Pharmacol. Jun; 85(6): 1199–1207. doi: 10.1111/bcp.13777.
Kaplan F., Al Mukaddam M., Baujat G., Brown M., Cali A., Cho T., Crowe C., De Cunto C., Delai P., Diecidue R., Di Rocco M., Eekhoff E., Friedman C., Grunwald Z., Haga N., Hsiao E., Keen R., Kitterman J., Levy C., Morhart R., Netelenbos C., Scott C., Shore E., Zasloff M., Zhang K., Pignolo R. 2019. The Medical Management of Fibrodysplasia Ossificans Progressiva: Current Treatment Considerations. Proc. Intl. Clin. Council. FOP. 1: 1–111.
Meyers C., Lisiecki J., Miller S., Levin A., Fayad L., Ding C., Sono T., McCarthy E., Levi B., James AW. 2019. Heterotopic Ossification: A Comprehensive Review. JBMR Plus. 27; 3(4): e10172. doi: 10.1002/jbm4.10172
Pignolo R., Shore E., Kaplan F. 2011. Fibrodysplasia Ossificans Progressiva: Clinical and Genetic Aspects. Orphanet J. Rare Dis. 6(1): 80. doi: 10.1186/1750-1172-6-80
Saeed A., Toshifumi Y. 2023. Navigating the Complex Landscape of Fibrodysplasia Ossificans Progressiva: From Current Paradigms to Therapeutic Frontiers. Department of Medical Genetics, Faculty of Medicine and Dentistry, University of Alberta, Edmonton, AB T6G 2H7, Canada/ Published
Shah Z.A., Rausch S., Arif U., El Yafawi B. 2019. Fibrodysplasia ossificans progressiva (Stone Man Syndrome): A Case Report. J. Med. Case Rep. 13(1): 364. doi: 10.1186/ s13256-019-2297-z
Shaikh U., Khan A., Kumari P., Ishfaq A., Ekhator C., Yousuf P., Halappa Nagaraj R., Raza H., Ur Rehman U., Zaman M.U., Lakshmipriya Vetrivendan G., Nguyen N., Kadel B., Sherpa T.N., Ullah A., Bellegarde S.B. 2023. Novel Therapeutic Targets for Fibrodysplasia Ossificans Progressiva: Emerging Strategies and Future Directions. Cureus. 15(7): e42614. doi: 10.7759/cureus.42614
Solomon D., Wakjira I., Hailu D., Gorfy Y. 2018. Fibroplasia Ossificans Progressiva: A Case Report of a Rare Disease Entity. Ethiop. J. Health. Sci. 28(4): 513–516. doi: 10.4314/ ejhs.v28i4.17 62