Влияние на липидный профиль комбинации аторвастатина и этилметилгидроксипиридина малата у пациентов с ишемической болезнью сердца
Aннотация
Цель: определить характер влияния комбинации аторвастатина и этилметилгидроксипиридина малата на липидный профиль пациентов с ишемической болезнью сердца (ИБС). Было проведено пилотное рандомизированное клиническое исследование 60 пациентов с ИБС. Пациентов делили на две равнозначные группы: I группу (n = 30) составили пациенты, получавшие базисную терапию ИБС (антиагреганты, статины, бета-адреноблокаторы, антиангинальные средства) с дозировкой аторвастатина 20 мг/сут; II группу (n = 30) – пациенты, получавшие дополнительно к базисным средствам с аторвастатином 20 мг/сут этилметилгидроксипиридина малат в таблетированной форме в дозе 300 мг в сутки со снижением дозировки аторвастатина до 10 мг/сут на амбулаторном этапе наблюдения. Пациенты были комплексно обследованы с оценкой липидного профиля крови. При исходной гиперхолестеринемии в I группе больных спустя 60 дней лечения уровень общего холестерина (ХС) уменьшился на 25 % с 6,63 ± 0,33 до 4,95 ± 0,45 ммоль/л (p < 0,01), уровень ХС липопротеидов низкой плотности (ЛПНП) снизился на 32 % с 4,31 ± 0,32 до 2,91 ± 0,45 ммоль/л (p < 0,05), коэффициент атерогенности (Ка) уменьшился на 32 % с 5,06 ± 0,67 до 3,43 ± 0,63 (p > 0,05); во II группе больных при исходной гиперхолестеринемии уровень общего ХС уменьшился на 34 % с 6,9 8± 0,50 до 4,5 8± 0,47 ммоль/л (p < 0,01), уровень ХС ЛПНП снизился на 47 % с 4,53 ± 0,48 до 2,39 ± 0,54 ммоль/л (p < 0,01), Ка уменьшился на 47 % с 4,59 ± 0,55 до 2,44 ± 0,39 (p < 0,01). При исходно нормальных значениях холестерина сыворотки крови (до 5,0 ммоль/л) достоверной разницы между группами сравнения в динамике лечения не выявлено. Получены доказательства синергичного влияния комбинации аторвастатина и антиоксидантного препарата этилметилгидроксипиридина малата на липидный профиль пациентов с ИБС.
Ключевые слова: ишемическая болезнь сердца, аторвастатин, антиоксиданты (этилметилгидроксипиридина малат), лечение
Введение
Широкая распространённость и высокая смертность от ИБС в нашей стране и зарубежом нацеливают на поиск рациональных комбинаций лекарственных средств при лечении больных [Усачёва и др., 2021; Шарапова и др., 2022; Ralapanawa, Sivakanesan, 2021]. Комплексная фармакотерапия должна быть патогенетически обоснованной и обладать доказанной эффективностью [Ежов и др., 2023].
Согласно отечественным и зарубежным клиническим рекомендациям по лечению стабильной ИБС. снижение уровня холестерина липопротеидов низкой плотности (ХС ЛПНП) является основной стратегией комплексной фармакотерапии, нацеленной на улучшение прогноза [Ежов и др., 2023; Knuuti et al., 2020; Virani et al., 2023]. Лидирующим классом гиполипидемических средств по-прежнему считаются статины (класс рекомендаций I, уровень доказательности А), несмотря на то, что монотерапия статинами без их сочетания с другими классами гиполипидемических средств не достигает требуемого уровня эффективности [Ежов и др., 2023; Knuuti et al., 2020; Ray et al., 2022; Masana et al., 2023; Virani et al., 2023].
Оценивают эффективность гиполипидемической терапии по уровню достижения целевых цифр ХС ЛПНП, который зависит от степени риска развития осложнений со стороны сердечно-сосудистой системы. У пациентов с ИБС, которые относятся к категории очень высокого риска, согласно последним клиническим рекомендациям по лечению хронической ишемической болезни сердца (2020, 2023) и дислипидемий (2023), целевой уровень ХС ЛПНП составляет < 1,4 ммоль/л [Кухарчук и др., 2020; Ежов и др., 2023; Grundy et al., 2019; Knuuti et al., 2020; Mach et al., 2020; Virani et al., 2023]. Для этих целей рекомендовано использовать высокие дозы статинов – аторвастатин 80 мг или розувастатин 40 мг [Ежов и др., 2023; Visseren et al., 2021; Virani et al., 2023]. Однако применение высоких доз статинов в клинической практике ассоциируется с развитием ряда побочных эффектов, среди которых печёночный цитолитический синдром с повышением уровней трансаминаз в крови [Mach et al., 2018; Mizrahi et al., 2018], миопатия и рабдомиолиз [Mach et al., 2018; Newman, 2022]; когнитивные расстройства и периферическая нейропатия с увеличением частоты развития геморрагического инсульта [Mach et al., 2018]; могут развиваться нарушения репродуктивной функции у мужчин и женщин – снижение либидо, импотенция, нарушение эякуляции и сперматогенеза, метроррагия [Rejraji et al., 2014; Sokalska et al., 2014]. Имеются литературные данные об ухудшении углеводного обмена и прогрессировании сахарного диабета при длительном приёме статинов [Mach et al., 2018; Newman, 2022], а также об увеличении частоты возникновения злокачественных новообразований при существенном снижении уровня холестерина при длительном применении статинов [Renman et al., 2017].
Ввиду ухудшения переносимости статинов с повышением их дозировки до максимальной и в связи с недостижением низких целевых значений ХС ЛПНП путём монотерапии ингибиторами ГМГ-КоА редуктазы, рекомендовано комбинированное назначение гиполипидемических средств с разным механизмом действия. В качестве второго гиполипидемического средства предлагается использовать селективный ингибитор абсорбции холестерина и некоторых растительных стеринов в кишечнике – эзетимиб, ингибиторы пропротеиновой конвертазы субтилизин-кексинового 9-го типа (PCSK9) – алирокумаб, эволокумаб или малую интерферирующую рибонуклеиновую кислоту (миРНК) к матричной РНК PCSK9 – инклисиран [Ежов и др., 2023; Knuuti et al., 2020; Abdul-Rahman et al., 2022; Ray et al., 2022; Masana et al., 2023; Virani et al., 2023]. Такая комбинированная гиполипидемическая терапия приводит к повышению эффективности лечения, но не безопасности (количество побочных эффектов возрастает). Таким образом, остаётся ниша для дальнейших исследований возможных рациональных комбинаций лекарственных средств, способных улучшить профиль эффективности и безопасности гиполипидемической фармакотерапии.
Мы предположили, что комбинация статина с антиоксидантом может способствовать повышению эффективности и безопасности гиполипидемической терапии ввиду наличия плейотропного гиполипидемического свойства у некоторых антиоксидантов, описанного в официальных инструкциях по их медицинскому применению. Известно, что активация перекисного окисления липидов (ПОЛ) является одним из ведущих патогенетических механизмов развития атеросклероза. В этой связи было бы логичным предположить потенциальную пользу от применения лекарственного препарата, подавляющего ПОЛ, в комплексном лечении пациентов с ИБС, что было показано в ряде небольших клинических исследований [Hadzi-Petrushev et al., 2018; Romaschenko et al., 2020]. По нашему мнению, антиоксиданты следует использовать строго индивидуально для получения эффективности, а отсутствие учёта индивидуальных особенностей пациентов в крупномасштабных исследованиях объясняет отсутствие популяционного эффекта данной группы препаратов на прогноз [Romaschenko et al., 2022]. Поскольку в показаниях к назначению некоторых препаратов антиоксидантного ряда значится «ИБС», мы сочли возможным с этической точки зрения изучить возможный плейотропный гиполипидемический эффект у этилметилгидроксипиридина малата (ЭМГПМ) в комбинации со статином.
Целью настоящего исследования явилось определение характера влияния комбинации аторвастатина и этилметилгидроксипиридина малата на липидный профиль пациентов с ишемической болезнью сердца.
Материал и методы. Нами было проведено пилотное открытое рандомизированное сравнительное исследование 60 пациентов с ИБС: стабильной стенокардией напряжения I–III функционального класса (ФК). Диагноз устанавливали на основании комплекса данных исследований согласно Клиническим рекомендациям Министерства здравоохранения Российской Федерации «Стабильная ишемическая болезнь сердца» 2020 года [Барбараш и др., 2020].
Критериями включения в исследование явились:
– наличие стабильной стенокардии напряжения I–III ФК;
– допустимо наличие сопутствующей патологии – первичной артериальной гипертензии, хронической сердечной недостаточности I–IIА стадии, I–III ФК, нарушений ритма сердца, сахарного диабета II типа;
– наличие добровольного согласия пациента на участие в исследовании.
Критериями исключения из исследования явились:
– отсутствие стабильной стенокардии напряжения I–III ФК;
– острый коронарный синдром;
– наличие острого воспалительного процесса любой локализации;
– острая сердечная недостаточность;
– хроническая сердечная недостаточность IIБ – III стадии, IV ФК;
– отсутствие согласия пациента на участие в исследовании.
Пациенты были разделены на две равнозначные группы путём рандомизации – по 30 человек в каждой группе:
I группа – пациенты, получавшие базисную терапию стабильной стенокардии: антитромбоцитарные препараты (только аспирин в дозе 75 мг/сут), гиполипидемические средства (аторвастатин в дозе 20 мг/сут), бета-адреноблокаторы, ингибиторы АПФ, антагонисты кальция и нитраты.
II группа – пациенты, получавшие на фоне базисной терапии дополнительно этилметилгидроксипиридина малат в дозе 100 мг 3 раза в сутки в таблетках под язык на протяжении 10–14 дней стационарного лечения и 46–50 дней амбулаторно. Базисная терапия в данной группе наблюдения изменялась на амбулаторном этапе – снижалась дозировка аторвастатина в ½ до 10мг/сут (в стационаре эти пациенты получали аторвастатин в дозе 20 мг/сут).
Наша позиция применения умеренно интенсивной терапии статином обусловлена, во-первых, умеренно повышенным исходным уровнем холестерина ЛПНП у наших пациентов (в среднем 3,34 ± 0,12 ммоль/л), что является приемлемым согласно последним международным и отечественным клиническим рекомендациям по лечению пациентов с ишемической болезнью сердца (хронической коронарной болезнью) (2020, 2023) [Барбараш и др., 2020; Virani et al., 2023], и, во-вторых, нашим предположением о возможном положительном влиянии добавления антиоксиданта на липидный профиль, что может потенциально уменьшить потребность в основном гиполипидемическом препарате. Более того, обнаруженные в многонациональных рандомизированных исследованиях данные о меньшей прогностической значимости уровня холестерина ЛПНП в сравнении с показателями воспаления (С-реактивный белок в крови) в развитии кардиоваскулярных осложнений [Ridker et al., 2023] подтверждает идею о необходимости умеренного снижения уровня холестерина ЛПНП и открывает перспективы включения в программу лечения дополнительно к статинам лекарственных препаратов с противовоспалительной активностью.
Группы были сопоставимы по полу, возрасту, тяжести течения основной патологии и медикаментозной терапии. Продолжительность наблюдения за больными составила до 60 дней (стационарный плюс амбулаторный период наблюдения) с оценкой состояния больных в исходном состоянии (при поступлении в стационар), при выписке из стационара и по окончании амбулаторного этапа наблюдения.
Клиническое исследование проведено в соответствии со стандартами GCP, было одобрено локальным этическим комитетом Белгородской областной клинической больницы Святителя Иоасафа (Протокол № 3 от 24.03.2018).
Для определения гиполипидемического эффекта фармакотерапии в группах наблюдения всем пациентам выполняли биохимический анализ крови с определением липидного профиля (ХС общий, ХС-ЛПВП, ХС-ЛПНП, ХС-ЛПОНП, ТГ, коэффициент атерогенности) в динамике лечения. Исследование липидного профиля проводили энзиматическим колориметрическим методом на автоматизированном биохимическом анализаторе Cobas 8000 производства компании «Roche Diagnostics Rus» (Швейцария) на базе централизованной клинико-диагностической лаборатории Белгородской областной клинической больницы Святителя Иоасафа.
Проводили обработку полученных данных методом вариационной статистики. Рассчитывали среднее арифметическое значение, стандартное (среднеквадратическое) отклонение и ошибку среднего. Различия между двумя зависимыми группами наблюдений (до и после лечения) по количественному признаку, имеющему распределение близкое к нормальному, оценивали с помощью t-критерия Стьюдента для зависимых выборок. Результаты считали статистически значимыми при р < 0,05. При проведении расчетов использовали программу Microsoft Excel 2016.
Результаты и их обсуждение
Проводили сравнительный анализ данных липидограммы на этапах наблюдения в группах. При этом были выделены две подгруппы лиц – с исходной гиперхолестеринемией (при исходном уровне общего холестерина в крови более 5,0 ммоль/л) и исходно нормальным уровнем общего холестерина в крови (до 5,0 ммоль/л включительно). Полученные данные представлены в таблицах 1, 2 и на рисунках 1, 2.
Таблица 1
Table 1
Гиполипидемический эффект в группах сравнения.
Пациенты с исходно нормальным уровнем холестерина в сыворотке крови
Hypolipidemic effect in comparison groups.
Patients with initially normal serum cholesterol levels
Показатели | I группа (n = 17) (аторвастатин 20 мг/сут) | II группа (n = 16) (аторвастатин 20 10 мг/сут + ЭМГПМ) | ||||
исходное состояние | после стационарного лечения | после амбулаторного лечения | исходное состояние | после стационарного лечения | после амбулаторного лечения | |
ХС общ, ммоль/л | 4,27 ± 0,16 | 3,96 ± 0,24 | 3,87 ± 0,26 | 4,16 ± 0,16! | 3,69 ± 0,12! | 3,78 ± 0,22 |
ТГ, ммоль/л | 1,61 ± 0,20 | 1,75 ± 0,27 | 1,57 ± 0,18 | 1,45 ± 0,16 | 1,59 ± 0,17 | 1,42 ± 0,12 |
ХС-ЛПВП, ммоль/л | 1,17 ± 0,07 | 1,12 ± 0,08 | 1,16 ± 0,08 | 1,11 ± 0,09 | 1,03 ± 0,07 | 1,12 ± 0,10 |
ХС-ЛПНП, ммоль/л | 2,37 ± 0,12 | 1,94 ± 0,19 | 1,99 ± 0,29 | 2,37 ± 0,18! | 1,96 ± 0,09! | 1,41 ± 0,24 |
Окончание табл. 1
1 | 2 | 3 | 4 | 5 | 6 | 7 |
ХС-ЛПОНП, ммоль/л | 0,73 ± 0,09 | 0,92 ± 0,15 | 0,71 ± 0,08 | 0,66 ± 0,07 | 0,72 ± 0,08 | 0,64 ± 0,05 |
Коэффициент атерогенности, ЕД | 2,79 ± 0,24 | 2,62 ± 0,25 | 2,65 ± 0,33 | 3,07 ± 0,36 | 2,84 ± 0,25 | 2,92 ± 0,25 |
Примечание. ! – p < 0,05 достоверность различий при сравнении между показателями исходного состояния и после стационарного лечения внутри группы; ХС общ. – холестерин общий в крови; ТГ – триглицериды; ХС-ЛПВП – холестерин липопротеидов высокой плотности; ХС-ЛПНП – холестерин липопротеидов низкой плотности; ХС-ЛПОНП – холестерин липопротеидов очень низкой плотности, ЭМГПМ – этилметилгидроксипиридина малат.
Таблица 2
Table 2
Гиполипидемический эффект в группах сравнения.
Пациенты с исходной гиперхолестеринемией
Hypolipidemic effect in comparison groups.
Patients with baseline hypercholesterolemia
Показатели | I группа (n = 13) (аторвастатин 20 мг/сут) | II группа (n = 14) (аторвастатин 20 10 мг/сут + ЭМГПМ) | ||||
исходное состояние | после стационарного лечения | после амбулаторного лечения | исходное состояние | после стационарного лечения | после амбулаторного лечения | |
ХС общ, ммоль/л | 6,63 ± 0,33** | 4,60 ± 0,41 | 4,95 ± 0,45** | 6,98 ± 0,50**!! | 4,87 ± 0,51!! | 4,58 ± 0,47** |
ТГ, ммоль/л | 2,30 ± 0,26 | 1,75 ± 0,25 | 1,84 ± 0,25 | 2,53 ± 0,49 | 2,25 ± 0,29 | 1,75 ± 0,32 |
ХС-ЛПВП, ммоль/л | 1,27 ± 0,22 | 1,21 ± 0,15 | 1,20 ± 0,14 | 1,58 ± 0,24 | 1,12 ± 0,11 | 1,39 ± 0,18 |
ХС-ЛПНП, ммоль/л | 4,31 ± 0,32* | 2,59 ± 0,37 | 2,91 ± 0,45* | 4,53 ± 0,48**! | 2,73 ± 0,38! | 2,39 ± 0,54** |
ХС-ЛПОНП, ммоль/л | 1,09 ± 0,12 | 0,80 ± 0,11 | 0,84 ± 0,11 | 1,15 ± 0,22 | 1,02 ± 0,13 | 0,80 ± 0,14 |
Коэффициент атерогенности, ЕД | 5,06 ± 0,67 | 2,96 ± 0,31 | 3,43 ± 0,63 | 4,59 ± 0,55** | 3,41 ± 0,49 | 2,44 ± 0,39** |
Примечание. * – p < 0,05; ** – p < 0,01 при сравнении между показателями исходного состояния и после амбулаторного лечения внутри группы; ! – p < 0,05; !! – p < 0,01 при сравнении между показателями исходного состояния и после стационарного лечения внутри группы; ; ХС общ. – холестерин общий в крови; ТГ – триглицериды; ХС-ЛПВП – холестерин липопротеидов высокой плотности; ХС-ЛПНП – холестерин липопротеидов низкой плотности; ХС-ЛПОНП – холестерин липопротеидов очень низкой плотности, ЭМГПМ – этилметилгидроксипиридина малат.
У пациентов с исходной гиперхолестеринемией показатели липидного обмена нормализовались достоверно к концу стационарного этапа наблюдения только во второй группе, в то время как в первой они изменялись недостоверно. Так, в группе больных, получавших дополнительно к 20 мг/сут аторвастатина этилметилгидроксипиридина малат, к концу стационарного этапа наблюдения уровень холестерина в крови снижался на 25 % (p < 0,01), уровень липопротеидов низкой плотности уменьшался на 40 % (p < 0,05), а коэффициент атерогенности уменьшался на 26 % (p > 0,05). У пациентов, не получавших этилметилгидроксипиридина малат, к концу стационарного периода лечения уровень общего холестерина уменьшался на 30 % (p > 0,05), уровень холестерина липопротеидов низкой плотности уменьшался на 40 % (p > 0,05), а коэффициент атерогенности уменьшался на 42 % (p > 0,05).
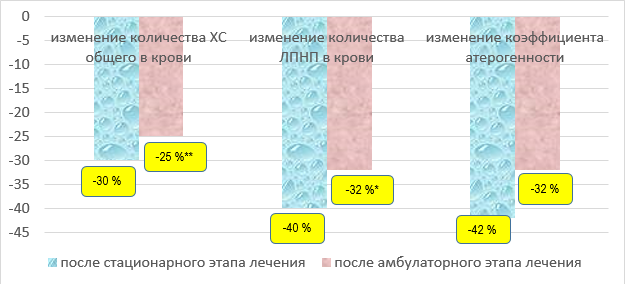
Рис. 1. Относительное изменение показателей липидного профиля у пациентов I группы в динамике лечения при исходной гиперхолестеринемии
Fig. 1. Relative change in lipid profile parameters in patients of the 1st group in the dynamics of treatment with initial hypercholesterolemia
Примечание. * – p < 0,05; ** – p < 0,01 при сравнении между показателями исходного состояния и после амбулаторного лечения внутри группы; ! – p < 0,05; !! – p < 0,01 при сравнении между показателями исходного состояния и после стационарного лечения внутри группы.

Рис. 2. Относительное изменение показателей липидного профиля у пациентов II группы в динамике лечения при исходной гиперхолестеринемии
Fig. 2. Relative change in lipid profile parameters in patients of the 2nd group in the dynamics of treatment with initial hypercholesterolemia
Примечание. * – p < 0,05; ** – p < 0,01 при сравнении между показателями исходного состояния и после амбулаторного лечения внутри группы; ! – p < 0,05; !! – p < 0,01 при сравнении между показателями исходного состояния и после стационарного лечения внутри группы; ЭМГПМ – этилметилгидроксипиридина малат.
Примечательно, что к концу амбулаторного этапа лечения в первой группе пациентов наблюдалось ослабление эффективности гиполипидемической терапии, несмотря на продолжение приёма больными 20 мг/сут аторвастатина, как наглядно продемонстрировано на рисунке 1. В то же время у пациентов, принимавших этилметилгидроксипиридина малат, несмотря на снижение дозировки аторвастатина до 10 мг/сут, наблюдалось стойкое достоверное прогрессивное уменьшение показателей атерогенности крови: уровень общего холестерина уменьшился на 34 % от исходного уровня (p < 0,01), уровень холестерина липопротеидов низкой плотности снизился на 47 % (p < 0,01) и коэффициент атерогенности уменьшился на 47 % (p < 0,01).
Таким образом, комбинация аторвастатина с этилметилгидроксипиридина малатом в группе с исходной гиперхолестеринемией приводила к достоверному снижению уровня холестерина с более высоких цифр до более низких, в более короткие сроки (уже к концу стационарного этапа лечения) и лучшему «удержанию» холестеринового профиля на более низком уровне атерогенности, несмотря на снижение дозы аторвастатина с 20 мг/сут до 10 мг/сут.
При исходно нормальном уровне общего холестерина в крови только в группе пациентов с комбинированной фармакотерапией (аторвастатин с этилметилгидроксипиридина малатом) к концу стационарного этапа лечения отмечалось достоверное снижение уровня общего холестерина и холестерина липопротеидов низкой плотности до средних значений показателей с отсутствием дальнейшего снижения на амбулаторном этапе наблюдения.
Низкие дозы аторвастатина (10–20 мг/сут) и достаточно короткий период наблюдения (60 дней) в нашем исследовании не позволили достичь целевых значений ХС ЛПНП (менее 1,4 ммоль/л) ни в одной из групп, однако можно предположить, что в случае увеличения дозы статина и/или продления периода наблюдения целевые цифры ХС ЛПНП были бы достигнуты. Учитывая требование клинических рекомендаций к умеренноинтенсивной терапии статином достигать снижения уровня ХС ЛПНП на 30–50 %, эта цель была достигнута в обеих группах наблюдения.
Обнаруженный синергизм аторвастатина и этилметилгидроксипиридина малата в отношении гиполипидемического эффекта имеет своё теоретическое обоснование и может быть пояснён следующим положением.
Так, основной причиной ишемии миокарда является атеросклероз коронарных сосудов [Boudoulas et al., 2016; Gasparovic et al., 2023]. На начальных этапах атеросклероза наблюдается атерогенная гиперлипопротеинемия [Ference et al., 2018]. При наличии дисфункции эндотелия сосудов (повышения проницаемости эндотелия вследствие активации перекисного окисления липидов) атерогенные ЛПНП поступают внутрь сосудистой стенки. Избыток липидов в клетке способствует дальнейшей активации перекисного окисления липидов, вследствие чего холестерин становится чужеродным для клетки и запускаются иммунные механизмы прогрессирования атеросклероза [Wu et al., 2017; Ridker et al., 2023]. Кроме того, перекисному окислению подвергаются липиды мембран клеток и митохондрий, что приводит к нарушению клеточного гомеостаза: снижению синтеза АТФ, ДНК, РНК, активации протеолитических ферментов, ферроптозу, цитолизу и в конечном итоге – к гибели клетки [Gaschler et al., 2017; Fang et al., 2024; Xu et al., 2024].
Статины подавляют синтез ХС ЛПНП, в результате чего снижается количество ХС в крови [Кухарчук и др., 2020; Ежов и др., 2023; Grundy et al., 2019; Mach et al., 2020; Ray et al., 2022; Masana et al., 2023], а антиоксидант, благодаря присутствию в своей молекуле неспаренных электронов, способен улавливать электроны реактивных форм кислорода и нейтрализовать их, предупреждая таким образом повреждение мембран клеток и других структур – митохондрий, молекул ДНК, РНК, сохраняя нормальную выработку АТФ и жизнеспособность клеток [Shivakumar et al., 2018; Punetha et al., 2023]. В результате оба препарата – статин и антиоксидант – совместными усилиями с разных точек приложения подавляют процесс атерогенеза. Кроме того, изученный нами препарат этилметилгидроксипиридина малат стимулирует образование метаболитов холестерина посредством индукции изофермента цитохрома CYP3A4, и таким образом регулирует синтез холестерина и способствует его снижению [Кукес, Горошко, 2014]. Здесь заложена схожесть механизма действия и синергичность этилметилгидроксипиридина малата со статинами, которые метаболизируются цитохромами Р-450, в том числе CYP3A4, с образованием активных метаболитов, способствующих снижению уровня холестерина.
Для того, чтобы удостовериться в наличии либо отсутствии собственного гиполипидемического свойства у этилметилгидроксипиридина малата, следовало бы провести экспериментальное исследование на животных с моделированным атеросклерозом сосудов с соответствующим дизайном. В клинических условиях по этическим соображениям выполнение такого исследования невозможно, поскольку все больные с документированной ИБС обязаны получать статины [Барбараш и др., 2020; Knuuti et al., 2020; Virani et al., 2023]. По результатам проведенного пилотного исследования мы можем лишь сказать о том, что применение препарата антиоксидантного ряда этилметилгидроксипиридина малата совместно со статином (аторвастатином в низких дозировках 10–20 мг/сут) оказывает положительное влияние на липидный профиль пациентов с ИБС, демонстрируя потенцирование гиполипидемического свойства ингибитора ГМГ-КоА редуктазы, и это может быть расценено как плейотропный эффект антиоксиданта.
Согласно официальной инструкции по медицинскому применению и литературным данным, этилметилгидроксипиридина малат обладает целым рядом плейотропных эффектов, таких как гиполипидемический, интиишемический, антиагрегантный, мембраностабилизирующий, эндотелиопротективный и др.. Очевидно, все эти плейотропные эффекты происходят от непосредственно антиоксидантного действия препарата.
Таким образом, патогенетически обоснованным является фармакологическая стратегия, нацеленная на комбинирование гиполипидемического препарата из группы статинов и антиоксиданта.
Выводы
1. Комбинация аторвастатина с антиоксидантным препаратом этилметилгидроксипиридина малатом в группе с исходной гиперхолестеринемией достоверно снижает уровень холестерина с более высоких цифр до более низких, в более короткие сроки (уже к концу стационарного этапа лечения) и лучше удерживает холестериновый профиль на более низком уровне атерогенности, несмотря на снижение дозы аторвастатина с 20 мг/сут до 10 мг/сут.
2. При исходно нормальном уровне холестерина в крови только в группе пациентов с комбинированной фармакотерапией (аторвастатин с этилметилгидроксипиридина малатом) к концу стационарного этапа лечения отмечается достоверное снижение уровня общего холестерина и холестерина липопротеидов низкой плотности до средних значений показателей, с отсутствием дальнейшего снижения на амбулаторном этапе наблюдения.
Благодарности
Работа выполнена при финансовой поддержке ООО «Медимэкс» (г. Курган, Россия).





Список литературы
Барбараш О.Л., Карпов Ю.А., Кашталап В.В., Бощенко А.А., Руда М.М., Акчурин Р.С., Алекян Б.Г., Аронов Д.М., Беленков Ю.Н., Бойцов С.А., Болдуева С.А., Бубнова М.Г., Васюк Ю.А., Габинский Я.Л., Галявич А.С., Глезер М.Г., Голубев Е.П., Голухова Е.З., Гринштейн Ю.И., Давидович И.М., Ежов М.В., Карпов Р.С., Кореннова О.Ю., Космачева Е.Д., Кошельская О.А., Кухарчук В.В., Лопатин Ю.М., Миронов В.М., Марцевич С.Ю., Миролюбова О.А., Михин В.П., Недошивин А.О., Олейников В.Э., Панов А.В., Панченко Е.П., Перепеч Н.Б., Петрова М.М., Поздняков Ю.М., Протасов К.В., Савенков М.П., Самко А.Н., Скибицкий В.В., Соболева Г.Н., Шалаев С.В., Шапошник И.И., Шевченко А.О., Шевченко О.П., Ширяев А.А., Шляхто Е.В., Чумакова Г.А., Якушин С.С. 2020. Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 25(11): 4076. doi:10.15829/1560-4071-2020-4076.
Ежов М.В., Кухарчук В.В., Сергиенко И.В., Алиева А.С., Анциферов М.Б., Аншелес А.А., Арабидзе Г.Г., Аронов Д.М., Арутюнов Г.П., Ахмеджанов Н.М., Балахонова Т.В., Барбараш О.Л., Бойцов С.А., Бубнова М.Г., Воевода М.И., Галстян Г.Р., Галявич А.С., Горнякова Н.Б., Гуревич В.С., Дедов И.И., Драпкина О.М., Дупляков Д.В., Ерегин С.Я., Ершова А.И., Иртюга О.Б., Карпов Р.С., Карпов Ю.А., Качковский М.А., Кобалава Ж.Д., Козиолова Н.А., Коновалов Г.А., Константинов В.О., Космачева Е.Д., Котовская Ю.В., Мартынов А.И., Мешков А.Н., Небиеридзе Д.В., Недогода С.В., Обрезан А.Г., Олейников В.Э., Покровский С.Н., Рагино Ю.И., Ротарь О.П., Скибицкий В.В., Смоленская О.Г., Соколов А.А., Сумароков А.Б., Ткачева О.Н., Филиппов А.Е., Халимов Ю.Ш., Чазова И.Е., Шапошник И.И., Шестакова М.В., Якушин С.С., Шляхто Е.В. 2023. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 28(5): 5471. doi:10.15829/1560-4071-2023-5471.
Кукес В.Г., Горошко О.А. 2014. Возможности влияния на биосинтез и метаболизм холестерина и липопротеинов в организме человека. Лекарственные препараты и рациональная фармакотерапия. 1: 8–12.
Кухарчук В.В., Ежов М.В., Сергиенко И.В., Арабидзе Г. Г., Бубнова М. Г., Балахонова Т.В., Гуревич В.С., Качковский М.А., Коновалов Г.А., Константинов В.О., Малышев П.П., Покровский С.Н., Соколов А.А., Сумароков А.Б., Горнякова Н.Б., Обрезан А. Г., Шапошник И.И. 2020. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации, VII пересмотр. Атеросклероз и дислипидемии. 1: 7–40. doi: 10.34687/2219-8202.JAD.2020.01.0002
Усачева Е.В., Нелидова А.В., Куликова О.М., Флянку И.П. 2021. Смертность трудоспособного населения России от сердечно-сосудистых заболеваний. Гигиена и санитария. 100 (2): 159–165. doi:10.47470/0016-9900-2021-100-2-159-165
Шарапова О.В., Кича Д.И., Герасимова Л.И., Рукодайный О.В., Фомина Р.В., Евзерихина А.В., Барсукова Е.В. 2022. Картографический анализ показателей заболеваемости и смертности от болезней системы кровообращения населения Российской Федерации (2010–2019 гг.). Комплексные проблемы сердечно-сосудистых заболеваний. 11(1): 56–68. doi: 10.17802/2306-1278-2022-11-1-56-68
Abdul-Rahman T., Bukhari S.M., Herrera E.C., Awuah W.A., Lawrence J., de Andrade H., Patel N., Shah R., Shaikh R., Capriles C.A., Ulusan S. 2022. Lipid Lowering Therapy: An Era Beyond Statins. Current Problems in Cardiology. 47(12): 101342. doi: 10.1016/j.cpcardiol.2022.101342.
Boudoulas K.D., Triposciadis F., Geleris P., Boudoulas H. 2016. Coronary Atherosclerosis: Pathophysiologic Basis for Diagnosis and Management. Prog Cardiovasc Dis. 58(6): 676–92. doi: 10.1016/j.pcad.2016.04.003.
Fang W., Xie S., Deng W. 2024. Ferroptosis Mechanisms and Regulations in Cardiovascular Diseases in the Past, Present, and Future. Cell. Biol. Toxicol. 40(1): 17. doi: 10.1007/s10565-024-09853-w.
Ference B.A., Graham I., Tokgozoglu L., Catapano A.L. 2018. Reprint of: Impact of Lipids on Cardiovascular Health: JACC Health Promotion Series. J. Am. Coll. Cardiol. 72(23 Pt B): 2980–2995. doi: 10.1016/j.jacc.2018.10.021.
Gaschler M.M., Stockwell B.R.. 2017. Lipid Peroxidation in Cell Death. Biochem Biophys Res Commun. 482(3): 419–425. doi: 10.1016/j.bbrc.2016.10.086.
Gasparovic I., Artemiou P., Domonkos A., Bezak B., Gazova A., Kyselovic J., Hulman M. 2023. Multivessel Coronary Disease and Severe Atherosclerotic Aorta: Real-World Experience. Medicina (Kaunas). 59(11): 1943. doi: 10.3390/medicina59111943.
Grundy S.M., Stone N.J., Bailey A.L., Beam C., Birtcher K.K., Blumenthal R.S., Braun L.T., de Ferranti S., Faiella-Tommasino J., Forman D.E., Goldberg R., Heidenreich P.A., Hlatky M.A., Jones D.W., Lloyd-Jones D., Lopez-Pajares N., Ndumele C.E., Orringer C.E., Peralta C.A., Saseen J.J., Smith S.C. Jr, Sperling L., Virani S.S., Yeboah J. 2019. 2018. AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J. Am. Coll Cardiol. 73(24): 3168–3209. doi: 10.1016/j.jacc.2018.11.002.
Hadzi-Petrushev N., Dimovska K., Jankulovski N., Mitrov D., Mladenov M. 2018. Supplementation with Alpha-Tocopherol and Ascorbic Acid to Nonalcoholic Fatty Liver Disease’s Statin Therapy in Men. Advances in Pharmacological Sciences. 2018: 4673061. doi: 10.1155/2018/4673061.
Knuuti J., Wijns W., Saraste A., Capodanno D., Barbato E., Funck-Brentano C., Prescott E., Storey R.F., Deaton C., Cuisset T., Agewall S., Dickstein K., Edvardsen T., Escaned J., Gersh B.J., Svitil P., Gilard M., Hasdai D., Hatala R., Mahfoud F., Masip J., Muneretto C., Valgimigli M., Achenbach S., Bax J.J.; ESC Scientific Document Group. 2020. 2019 ESC Guidelines for the Diagnosis and Management of Chronic Coronary Syndromes. Eur. Heart. J. 41(3): 407–477. doi: 10.1093/eurheartj/ehz425.
Mach F., Baigent C., Catapano A.L., Koskinas K.C., Casula M., Badimon L., Chapman M.J., De Backer G.G., Delgado V., Ference B.A., Graham I.M., Halliday A., Landmesser U., Mihaylova B., Pedersen T.R., Riccardi G., Richter D.J., Sabatine M.S., Taskinen M.R., Tokgozoglu L., Wiklund O.; ESC Scientific Document Group. 2020. 2019 ESC/EAS Guidelines for the Management of Dyslipidaemias: Lipid Modification to Reduce Cardiovascular Risk. Eur. Heart. J. 41(1): 111–188. doi: 10.1093/eurheartj/ehz455.
Mach F., Ray K.K., Wiklund O., Corsini A., Catapano A.L., Bruckert E., De Backer G., Hegele R.A., Hovingh G.K., Jacobson T.A., Krauss R.M., Laufs U., Leiter L.A., März W., Nordestgaard B.G., Raal F.J., Roden M., Santos R.D., Stein E.A., Stroes E.S., Thompson P.D., Tokgözoglu L., Vladutiu G.D., Gencer B., Stock J.K., Ginsberg H.N., Chapman M.J.; European Atherosclerosis Society Consensus Panel. 2018. Adverse Effects of Statin Therapy: Perception vs. the Evidence – Focus on Glucose Homeostasis, Cognitive, Renal and Hepatic Function, Haemorrhagic Stroke and Cataract. Eur. Heart. J. 39(27): 2526–2539. doi: 10.1093/eurheartj/ehy182.
Masana L., Plana N., Andreychuk N., Ibarretxe D. 2023. Lipid Lowering Combination Therapy: From Prevention to Atherosclerosis Plaque Treatment. Pharmacological Research. 190: 106738. doi: 10.1016/j.phrs.2023.106738
Mizrahi M., Adar T., Lalazar G., Nachman D., El Haj M., Ben Ya'acov A., Lichtenstein Y., Shabat Y., Kanovich D., Zolotarov L., Ilan Y. 2018. Glycosphingolipids Prevent APAP and HMG-CoA Reductase Inhibitors-mediated Liver Damage: A Novel Method for "Safer Drug" Formulation that Prevents Drug-induced Liver Injury. J. Clin. Transl. Hepatol. 6(2): 127–134. doi: 10.14218/JCTH.2017.00071.
Newman C.B. 2022. Safety of Statins and Nonstatins for Treatment of Dyslipidemia. Endocrinol Metab Clin North Am. 51(3): 655–679. doi: 10.1016/j.ecl.2022.01.004.
Punetha M., Saini S., Chaudhary S., Bala R., Sharma M., Kumar P., Kumar D., Yadav P.S. 2023. Mitochondria-Targeted Antioxidant MitoQ Ameliorates ROS Production and Improves Cell Viability in Cryopreserved Buffalo Fibroblasts. Tissue Cell. 82: 102067. doi: 10.1016/j.tice.2023.102067.
Ralapanawa U., Sivakanesan R. 2021. Epidemiology and the Magnitude of Coronary Artery Disease and Acute Coronary Syndrome: A Narrative Review. J. Epidemiol. Glob. Health. 11(2): 169–177. doi: 10.2991/jegh.k.201217.001.
Ray K.K., Reeskamp L.F., Laufs U., Banach M., Mach F., Tokgözoğlu L.S., Connolly D.L., Gerrits A.J., Stroes E.S.G., Masana L., Kastelein J.J.P. 2022. Combination Lipid-Lowering Therapy as First-Line Strategy in Very High-Risk Patients. Eur. Heart. J. 43(8): 830–833. doi: 10.1093/eurheartj/ehab718.
Rejraji H.P., Brugnon F., Sion B., Maqdasy S., Gouby G., Pereira B., Marceau G., Gremeau A.-S., Drevet J., Grizard G., Janny L., Tauveron I., Rejraji P. 2014. Evaluation of Atorvastatin Efficacy and Toxicity on Spermatozoa, Accessory Glands and Gonadal Hormones of Healthy Men: A Pilot Prospective Clinical Trial. Reproductive Biology and Endocrinology. 12: 65. doi: 10.1186/1477-7827-12-65.
Renman D., Lundberg E., Gunnarsson U., Strigård K. 2017. Statin Consumption as a Risk Factor for Developing Colorectal Cancer: A Retrospective Case Study. World Journal of Surgical Oncology. 15(1): 222. doi: 10.1186/s12957-017-1287-0.
Ridker P.M., Bhatt D.L., Pradhan A.D., Glynn R.J., MacFadyen J.G., Nissen S.E. 2023. PROMINENT, REDUCE-IT, and STRENGTH Investigators. Inflammation and cholesterol as Predictors of Cardiovascular Events Among Patients Receiving Statin Therapy: A Collaborative Analysis of Three Randomised Trials. Lancet. 401(10384): 1293-1301. doi: 10.1016/S0140-6736(23)00215-5.
Romaschenko O.V., Gorbach T.V., Alferov P.K., Grischenko N.D., Pokrovskaya T.G., Rumbesht V.V. 2020. Endothelioprotective Effect of a Combination of Statin with Antioxidant in the Treatment of Patients with Coronary Heart Disease. Journal of critical reviews. 7(10): 571–575. doi: 10.31838/jcr.07.10.113.
Romaschenko O.V., Pokrovsky M.V., Nadezhdin S.V., Gorbach T.V., Alferov P.K., Grischenko N.D., Rumbesht V.V. 2022. Personalized Approaches to the Use of the Antioxidant Ethoxidol in Patients with Coronary Heart Disease. J. Nanostruct. 12(2): 343–352. doi: 10.22052/JNS.2022.02.011
Shivakumar A., Yogendra Kumar M.S. 2018. Critical Review on the Analytical Mechanistic Steps in the Evaluation of Antioxidant Activity. Crit. Rev. Anal. Chem. 48(3): 214–236. doi: 10.1080/10408347.2017.1400423.
Sokalska A., Stanley S.D., Villanueva J.A., Ortega I., Duleba A.J. 2014. Comparison of Effects of Different Statins on Growth and Steroidogenesis of Rat Ovarian Theca-Interstitial Cells. Biology of reproduction. 90(2): 44. doi: 10.1095/biolreprod.113.114843.
Virani S.S., Newby L.K., Arnold S.V., Bittner V., Brewer L.C., Demeter S.H., Dixon D.L., Fearon W.F., Hess B., Johnson H.M., Kazi D.S., Kolte D., Kumbhani D.J., LoFaso J., Mahtta D., Mark D.B., Minissian M., Navar A.M., Patel A.R., Piano M.R., Rodriguez F., Talbot A.W., Taqueti V.R., Thomas R.J., van Diepen S., Wiggins B., Williams M.S.; Peer Review Committee Members. 2023. 2023 AHA/ACC/ACCP/ASPC/NLA/PCNA Guideline for the Management of Patients With Chronic Coronary Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 148(9): e9-e119. doi: 10.1161/CIR.0000000000001168.
Visseren F.L.J., Mach F., Smulders Y.M., Carballo D., Koskinas K.C., Bäck M., Benetos A., Biffi A., Boavida J.M., Capodanno D., Cosyns B., Crawford C., Davos C.H., Desormais I., Di Angelantonio E., Franco O.H., Halvorsen S., Hobbs F.D.R., Hollander M., Jankowska E.A., Michal M., Sacco S., Sattar N., Tokgozoglu L., Tonstad S., Tsioufis K.P., van Dis I., van Gelder I.C., Wanner C., Williams B.; ESC National Cardiac Societies; ESC Scientific Document Group. 2021. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur. Heart. J. 42(34): 3227–3337. doi: 10.1093/eurheartj/ehab484.
Wu M.Y., Li C.J., Hou M.F., Chu P.Y. 2017. New Insights into the Role of Inflammation in the Pathogenesis of Atherosclerosis. Int. J. Mol. Sci. 18(10): 2034. doi: 10.3390/ijms18102034.
Xu X., Xu X.D., Ma M.Q., Liang Y., Cai Y.B., Zhu Z.X., Xu T., Zhu L., Ren K. 2024. The Mechanisms of Ferroptosis and its Role in Atherosclerosis. Biomed Pharmacother. 171: 116112. doi: 10.1016/j.biopha.2023.116112.