Гидроксипролин как маркер эффективности терапии кожной раны в условиях ишемии
Aннотация
Цель исследования – анализ уровня гидроксипролина в тканях как маркера эффективности заживления экспериментальной кожной раны в условиях ишемии. На 90 крысах Вистар воспроизводили рану по разработанному нами способу. Выделены 3 группы крыс по 30 особей. В группе «Контроль» терапия не проводилась, в группе «Первая опытная» выполнялось местное лечение многокомпонентным средством, в группе «Вторая опытная» – магнитотерапия с применением вышеупомянутого средства. Содержание гидроксипролина оценивали на основе методики Newman, Logan в модификации Cissel. Результаты сопоставляли с планиметрическими, визуальными и морфологическими данными. На 10 сутки в каждой серии наблюдали образование рубца, в опытных группах было зафиксировано преобладание зрелой соединительной ткани над грануляционной, в отличие от группы «Контрольная». Установлена прямая сильная корреляционная связь между содержанием гидроксипролина и площадью ран во всех группах. Отмечена достоверность методики количественного анализа гидроксипролина, которая в совокупности с другими методами исследования позволяет повысить объективность представления о течении раневого процесса.
Ключевые слова: раневой процесс, гидроксипролин, планиметрия, макроскопическая картина, гистология, лечение ран
Введение
Острые раны, возникшие на фоне трофических нарушений, представляют актуальную медико-социальную проблему [Моргун и др., 2018; Муромцева и др., 2022]. Во-первых, длительное течение раневого процесса снижает качество жизни пациентов ввиду снижения устойчивости мягких тканей к воздействию внешних факторов, ограничения функции пораженного участка тела, формирования косметического дефекта. Во-вторых, ишемические изменения в области травмы выступают фактором риска присоединения вторичной инфекции, что требует увеличения материальных затрат на лечение больных, также данная проблема связана и с увеличением срока временной нетрудоспособности работающих граждан [Shukla et al., 2019; O`Brien et al., 2024].
По данным литературы, ежегодно частота встречаемости пациентов с ранами, возникшими на фоне ишемии, колеблется от 500 до 1 000 новых случаев на один миллион человек. При неэффективном лечении у 40 % пациентов с данной патологией выполняется ампутация нижней конечности в течение шести месяцев после возникновения раневого дефекта, а смертность достигает 20 % этой популяции [O`Brien et al., 2024].
Реваскуляризация артерий нижних конечностей является основополагающей стратегией для сохранения конечности и является оптимальным выбором для лечения пациентов с трофическими язвами. Выбор наиболее подходящего открытого или эндоваскулярного оперативного вмешательства зависит от расположения и распределения поражения артерий, а также от общего состояния пациента и сопутствующих заболеваний, поэтому не всегда имеется возможность выполнить данное лечебное мероприятие [Pasek et al., 2023].
Для местного лечения кожных ран в условиях ишемии рекомендовано применение противомикробных средств (предпочтительно бактерицидных антисептиков), стимуляторов регенерации и ангиопротекторов в сочетании с физиотерапевтическими методами воздействия [Najafi et al., 2018; Moradi et al., 2023].
Трудности в ведении пациентов, страдающих дефектами кожи и подлежащих мягких тканей в условиях ишемии, отчасти обусловлены недостаточной оценкой процесса регенерации, ограниченной учётом планиметрических показателей и местными признаками воспаления [Туш и др., 2019]. В связи с тем, что забор у пациентов полнослойного фрагмента раны для гистологического изучения невозможен, в качестве маркера, дающего объективное представление о течении фиброза, может стать определение содержания в ране гидроксипролина (hydroxyproline, Hyp), характеризуемого как высокоспецифичный маркер коллагеногенеза независимо от типа и происхождения последнего [Максимов и др., 2019].
Существует несколько способов определения данной аминокислоты. Иммуногистохимический анализ содержания гидроксипролина позволяет установить тип коллагена и их содержание в биологических тканях. В свою очередь, метод сопряжен со сложностями в подборе специфических антител, если химический состав исследуемого материала неизвестен, а также представлен множеством пептидов и их производных различного строения [Сидоренко и др., 2020; Golaraei et al., 2019]. Посредством хроматографического метода проводится качественный и количественный анализ протеинов, изучаются особенности конфигурации коллагеновых и неколлагеновых белков в составе биологических тканей [Русланова и др., 2021]. Калориметрическое исследование биологических объектов является перспективным, поскольку присутствие протеогликанов практически не влияет на исход процедуры. В отношение гидроксипролина предпочтение отдаётся взаимодействию реагента Эрлиха с продуктами окисления данной аминокислоты в присутствии Хлорамин Т в связи с тем, что гликозамины вступают в данную химическую реакцию после предварительной обработки в ацетоне [Путятина и др., 2020]. В выполненных ранее пилотных экспериментальных исследованиях у нас был опыт определения содержания гидроксипролина в составе соединительнотканного компонента поверхности гнойной раны [Бежин и др., 2019].
Цель исследования – определение диагностической ценности уровня гидроксипролина в тканях раны как маркера эффективности лечения на примере использования оригинальной лекарственной комбинации и магнитотерапии при местном лечении экспериментальной кожной раны в условиях ишемии.
Объекты и методы исследования
Исследование проводилось на базе лаборатории экспериментальной хирургии и онкологии научно-исследовательского института экспериментальной медицины и экспериментально-биологической клиники ФГБОУ ВО КГМУ Минздрава России. Проведение данного эксперимента одобрено региональным этическим комитетом ФГБОУ ВО КГМУ Минздрава России (протокол № 7 от 30 ноября 2020 г.).
В исследовании in vivo на 90 белых крысах породы Вистар осуществлялось моделирование кожной раны в условиях ишемии по разработанному нами способу (патент РФ на изобретение № 2807383) [Терехов и др., 2023]. Оперативные вмешательства сопровождались анестезией изофлюраном на аппарате R340 (RWD Life Science, Китай), вводная и поддерживающие дозы ингаляционного агента в дыхательной смеси составляли 2,5 и 1–2 объемных процента соответственно.
Был выполнен доступ к сосудисто-нервному пучку на внутренней поверхности бедра, выполнялось иссечение участка ствола общей бедренной артерии (рис. 1A, В). Рана послойно ушивалась.
Спустя 7 суток на выбритом от шерсти участке кожи в средней трети боковой поверхности ранее оперированного бедра осуществлялась эксцизия кожного лоскута до поверхностной фасции в виде круга диаметром 16 мм (рис. 1С).
Сформированный дефект мягких тканей удерживался под стерильной повязкой в течение 4 дней. По истечении указанного срока формировалась модель кожной раны в условиях ишемии (рис. 1D).
Животные были разделены на 3 группы исследования (по 30 особей в каждой группе): «Контроль», «Первая опытная», «Вторая опытная». Оценка эффективности заживления ран осуществлялась посредством количественного определения содержания Hyp в грануляционном ложе, расчёт площади экспериментально смоделированного дефекта. Физико-химические и планиметрические измерения с последующими лечебными мероприятиями начинали проводить в день, который следовал за датой введения в эксперимент и соответствовал 1 суткам наблюдения, а также на 3, 5, 8, 10 сутки относительно дня начала наблюдений (из эксперимента выводили по 6 животных в каждой группе).

Рис. 1. Моделирования кожной раны в условиях ишемии.
А – доступ к бедренному сосудисто-нервному пучку; B – перевязка и резекция общей бедренной артерии; C – иссечение кожного лоскута; D – вид кожной раны на 4 сутки после иссечения кожного лоскута
Fig. 1. Modeling a skin wound in ischemic conditions.
A – access to the femoral neurovascular bundle; B – ligation and resection of the common femoral artery; C – excision of the skin flap; D – type of skin wound on the 4th day after excision of the skin flap
В группе «Контроль» животным проводились измерения учётных признаков в отсутствие терапии.
В группе «Первая опытная» проводились ежедневные перевязки с нанесением на рану 0,5 мл геля следующего состава (в массовых долях): бензалкония хлорид (0,02), декспантенол (5,0) и раствор пентоксифиллина 2 % до 100 г, иммобилизованные на натриевой соли карбоксиметилцеллюлозы (4,0). Лекарственная комбинация была разработана на базе кафедры фармацевтической технологии ФГБОУ ВО КГМУ Минздрава России (патент РФ на изобретение № 2812221).
В группе «Вторая опытная» животным ежедневно проводили сеанс дозированного воздействия магнитным полем в области раны, далее выполняли перевязки с использованием вышеуказанной лекарственной комбинации. Каждые последующие сутки раневую поверхность очищали от остатков геля, затем приступали к магнитотерапии. Для проведения данной процедуры использовали магнито-инфракрасный-светолазерный терапевтический аппарат «Милта-Ф-8-01» в режиме магнитотерапии. При лечении использовались частоты 80, 150, 300, 600, 1 500, 5 000 Гц; мощность 50 мВт; длительность сеанса 6 минут (1 минута на каждой частоте) [Моргун и др., 2019].
Количественный анализ интенсивности коллагенообразования проводили в соответствии с оригинальной методикой Neuman R.E. и Logan M.A. (1950) в модификации Cissel D.D. и соавторов [Cissel et al., 2017]. Сущность лабораторной практики заключалась в калориметрической оценке содержания соединения, которое образуется в ходе взаимодействия свободного Hyp, предварительно выделенного из фрагментов мягких тканей в пределах раны, с реагентом Эрлиха и Хлорамином Т. Реагент Эрлиха, раствор хлорамина Т, стандартный водный раствор гидроксипролина (Std Hyp) в концентрации 0,1 мкг/мкл готовили согласно алгоритмам, используемым в оригинальной методике Neuman R.E., Logan M.A. (1950). Биологический материал для количественного определения Hyp получали путем иссечения раневой поверхности протяжённостью 14 мм на глубину дефекта в мягких тканях под контролем гемостаза. Процедуру выполняли на 3, 5, 8, 10 сутки наблюдения.
В начале этапа пробоподготовки биологический материал массой 40 ± 2 мг подвергали щелочному гидролизу, добавляя по 600 мкл 10N раствор гидроксида натрия в каждый образец в условиях термостата типа «драй-блок» TDB-120 (Biosan, Латвия) при температуре 90 ºС в течение 15 часов. По истечении времени во все пробирки вносили по 600 мкл 5N раствора соляной кислоты. Далее гидролизат, который тщательно перемешивался в течение 15 секунд на каждый образец, помещался в высокоскоростную мини-центрифугу Microspin 12 (Biosan, Латвия), разделение содержимого на фракции происходило под перегрузкой 13 000 g в течение 5 минут. Надосадочную жидкость каждого образца в объеме 600 мкл переносили в новую пробирку. С целью уменьшения содержания высокомолекулярных соединений в полученные растворы добавляли по 150 мкл изопропанола, повторно проводили перемешивание и разделение на фракции с использованием высокоскоростной мини-центрифуги без изменения параметров. От полученных супернатантов отбирали по 80 мкл жидкости, которую переносили в новую пробирку.
Заполнение планшета начинали с внесения Std Hyp с тем расчетом, чтобы в ячейках А2-F2 происходило постепенное увеличение массы исследуемой аминокислоты на 0,2 мкг от 0 до 1 мкг соответственно (таблица 1).
Таблица 1
Table 1
Соответствие объема Std Hyp и количества исследуемой аминокислоты расположению ячеек
Correspondence of the volume of the standard hydroxyproline solution and the amount of the amino acid under study to the location of the cells
Название ячейки | Объем Std Hyp, мкл | Масса Hyp в ячейке, мкг |
A2 | 0 | 0,0 |
B2 | 2 | 0,2 |
C2 | 4 | 0,4 |
D2 | 6 | 0,6 |
E2 | 8 | 0,8 |
F2 | 10 | 1,0 |
Далее осуществляли перенос супернатантов каждого образца, добавляя по 20 мкл раствора в 3 последовательно расположенные ячейки на одной линии. Затем добивались полного испарения жидкости, помещая планшет в рефрижераторный инкубатор IMH-S Heratherm (Thermo Fisher Scientific, США) с установленной температурой 65 ºС в течение 40 минут. Далее образцы оставляли остыть на воздухе, сухой остаток в ячейках А2-F2 и всех ячейках, в которых содержался супернатант, растворяли в 100 мкл раствора хлорамина Т. Спустя 20 минут с момента начала реакции в те же ячейки добавляли по 100 мкл реагента Эрлиха. Затем добивались однородного распределения гидроксипролина в ячейках посредством перемешивания содержимого планшета с использованием орбитального шейкера OS-20 (Biosan, Латвия) на скорости 200 об/мин в течение 45 минут. По истечении времени реакция прерывалась посредством помещения планшета в холодильник при –20 ºС на 3 минуты. В завершение методики дважды проводилось измерение оптической плотности (optical dencity, OD) содержимого ячеек каждого планшета при выборе длины волны потока излучения 540 нм.
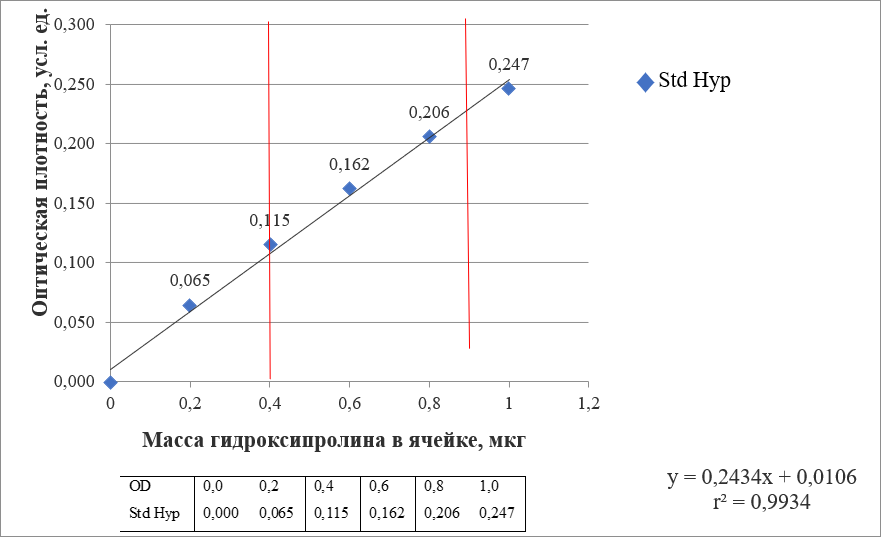
Рис. 2. Исследуемый фрагмент частного случая калибровочной кривой, отражающей корреляцию между массой Hyp в ячейке и соответствующей ей OD (красными линиями выделены границы, внутри которых функция описывается линейным уравнением первого порядка)
Примечание: r2 – коэффициент ранговой корреляции Спирмена
Fig. 2. The studied fragment of a special case of a calibration curve reflecting the correlation between the mass of Hyp in a cell and the corresponding OD (red lines mark the boundaries which the function is described by a linear equation of the first order within)
Note: r2 is Spearman's rank correlation coefficient
Полученные данные анализировались полуавтоматическим способом с использованием пакета MS Office 2010. Значения, соответствующие ячейкам А2-F2, рассматривали в качестве точек, расположенных на калибровочной кривой и отражающих зависимость экспериментально определенной OD содержимого ячейки (зависимая переменная) от концентрации Hyp из стандартного раствора в ячейке (независимая переменная). Было установлено, что корреляция обоих параметров характеризуется наибольшей силой связи при значениях содержания исследуемой аминокислоты в ячейке в пределах от 0,4 до 0,8 мкг/мкл (см. рис. 2). Обнаружено, что в искомом диапазоне функция описывается линейным уравнением первого порядка. Значения коэффициентов, необходимые для решения двучлена, рассчитывались на основании известных данных о концентрации Hyp в ячейках A2-F2 (см. таблицу 1) и полученных в процессе измерения показаний OD содержимого вышеуказанных ячеек (см. рис. 2).
Вначале с учетом значений коэффициентов линейного уравнения вычисляли массу Hyp в каждой из исследуемых ячеек по формуле (1):
 (1)
(1)
где m(Hyp)я – масса Hyp в ячейке, мкг;
OD – оптическая плотность содержимого ячейки в составе триплета, усл. ед.;
i – индекс суммирования;
a – угловой коэффициент линейного уравнения;
b – свободный коэффициент линейного уравнения.
Затем рассчитывали концентрацию Hyp в гидролизате, используя формулу (2):
 (2)
(2)
где c(Hyp)г-т – концентрация Hyp в гидролизате, мкг/мл;
m(Hyp)я – масса Hyp в ячейке, мкг;
v – объем гидролизата, мкл (v = 600 мкл).
Наконец определяли концентрацию Hyp в грануляционном ложе кожных ран по формуле (3):
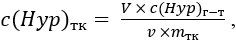 (3)
(3)
где c(Hyp)тк – концентрация гидроксипролина в тканях кожного лоскута раны, мкг/мг;
V – объем разведения исследуемого образца кожного лоскута ран, мкл (V = 2 000 мкл);
c(Hyp)г-т – концентрация Hyp в гидролизате, мкг/мл;
v – объем гидролизата, мкл (v = 600 мкл);
mтк – масса тканей в составе исследуемого образца кожного лоскута, мг.
Планиметрию проводили с использованием мобильного приложения «Lession Metter». Измерение площади происходило автоматически посредством подсчёта пикселей внутри заданных границ [Iljukhin et al., 2021].
При визуальном исследовании отмечали изменения внешнего вида ран: наличие и выраженность отека мягких тканей, объем и характер отделяемого, сроки очищения от некротических масс, появления грануляций и начала эпителизации.
Морфологическое исследование проводили посредством изготовления гистологических препаратов раневого дефекта, окрашенных гематоксилином и эозином, с последующим описанием микроскопического изображения под 40-кратным увеличением.
Статистическую обработку данных осуществляли посредством программного обеспечения «Microsoft Office 2010» и «Statistica 13.0». Количественные признаки выражали с помощью медианы и перцентилей (Me (25; 75)). При проведении статистического анализа для множественного сравнения использовали H-критерий Краскела – Уоллиса. Уровень статистической значимости (p) различий показателей между группами исследования соответствовал значению менее 0,05.
Результаты и их обсуждение
Во всех исследуемых группах наблюдался ежедневный прирост содержания Hyp в грануляционном ложе (см. рис. 3). В отличие от первых суток на 3, 5, 8 и 10 день эксперимента между группами были зафиксированы статистически значимые различия.
В ходе анализа планиметрических показателей (см. рис. 3) было установлено, что исходные значения данного параметра у животных не имели статистически значимой разницы, с течением времени появились отличия между всеми группами. В группе «Контроль» площадь ран в период с 1 по 10 сутки наблюдения сократилась в 2,3 раза, в группе «Первая опытная» – в 12,5 раза, в группе «Вторая опытная» – в 23,8 раз.
На основании корреляционного анализа установлена обратная сильная связь между концентрацией Hyp и площадью ран, коэффициент корреляции в группах «Контрольная», «Первая опытная» и «Вторая опытная» составил –0,88, –0,93 и –0,94 соответственно (рис. 3).

Рис. 3. Корреляция между концентрацией гидроксипролина в грануляционном ложе и площадью раны
Fig. 3. Correlation between hydroxyproline concentration in the granulation bed and wound square
Во всех группах на 1 сутки наблюдали умеренный отек по периферии в сочетании с розово-цианотичным цветом кожных покровов, скудное серозное отделяемое. Изучив гистологические препараты, отмечали инфильтрацию мягких тканей макрофагами, отложения некротического детрита на дне и стенках раны (рис. 4).

Рис. 4. А: микрофотография фрагмента кожи в области тканевого дефекта на 1 сутки эксперимента, увеличение ×40. B: снимок раны на 1 сутки эксперимента
Примечание: { – отложение клеточного детрита
Fig. 4. А: the microphotograph of a fragment of skin in the area of a tissue defect on the 1st day of the experiment, magnification ×40. B: the image of a wound on the 1st day of the experiment
Note: { is deposition of cellular detritus
В контрольной группе на 5 сутки эксперимента отек в области раны значительно уменьшился, кожные покровы бледно-розовые, по краям дефекта определялись грануляции, скудное серозно-геморрагическое отделяемое. При микроскопии гистологического препарата была выявлена макрофагально-лимфоцитарная инфильтрация, на дне и стенках раны присутствовал детрит, были обнаружены участки роста грануляционной ткани (рис. 5).

Рис. 5. A: микрофотография фрагмента кожи в области тканевого дефекта на 5 сутки эксперимента (группа «Контрольная»), увеличение ×40. B: снимок раны на 5 сутки эксперимента.
Примечание: { – новообразованная грануляционная ткань, заполняющая раневой дефект; ↑ – отложение детрита
Fig. 5. А: the micriphotograph of a fragment of skin in the area of a tissue defect on the 5th day of the experiment (there is «Control» group), magnification ×40. B: the image of a wound on the 5th day of the experiment
Note: { is newly formed granulation tissue filling the wound defect; ↑ is deposition of detritus
В контрольной группе на 10 сутки эксперимента отек и цвет кожных покровов сохранялись без существенной динамики, дно раны было выполнено грануляциями, отделяемое отсутствовало. На этапе морфологического исследования была обнаружена лимфоцитарная инфильтрация, тканевой дефект покрыт грануляционной тканью, по краям раны определялось нарастание тонкого эпидермиса (рис. 6).
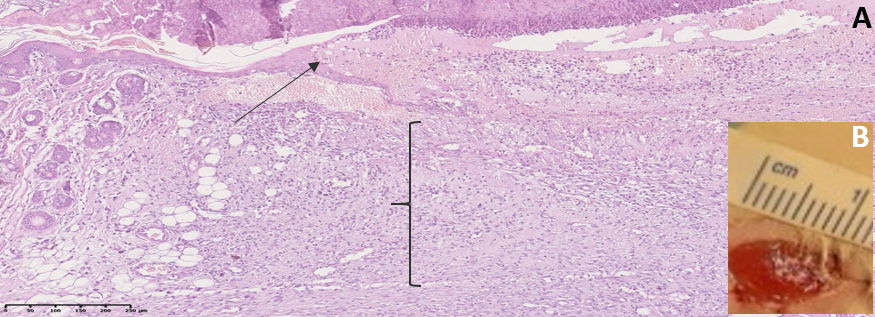
Рис. 6. A: микрофотография фрагмента кожи в области тканевого дефекта на 10 сутки эксперимента (группа «Контрольная»), увеличение ×40. B: снимок раны на 10 сутки эксперимента
Примечание: { – новообразованная грануляционная ткань, заполняющая раневой дефект; ↑ – новообразованный эпидермис
Fig. 6. А: the micriphotograph of a fragment of skin in the area of a tissue defect on the 10th day of the experiment (there is «Control» group), magnification ×40. B: the image of a wound on the 10th day of the experiment
Note: { is newly formed granulation tissue filling the wound defect; ↑ is newly formed epidermis
В группе «Первая опытная» на 5 сутки эксперимента наблюдали значительное уменьшение отека, бледно-розовой цвет кожных покровов, наличие отчетливых грануляций, в ране скудное серозно-фибринозное отделяемое. При гистологическом исследовании в верхней трети микропрепарата были отмечены очаговые наложения фибрина, ниже – в большом количестве определялась грануляционная ткань. По краям раны была прослежена эпителиальная выстилка (рис. 7).
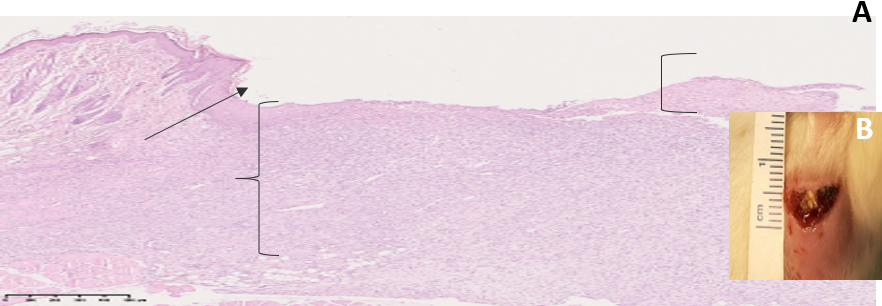
Рис. 7. A: микрофотография фрагмента кожи в области тканевого дефекта на 5 сутки эксперимента (группа «Первая опытная»), увеличение ×40. B: снимок раны на 5 сутки эксперимента
Примечание: ↑ – краевое нарастание эпителия; [ – участок раны, не покрытый эпидермисом с наложением фибрина; { – грануляционная ткань
Fig. 7. А: the micriphotograph of a fragment of skin in the area of a tissue defect on the 5th day of the experiment (there is «First experimental» group), magnification ×40. B: the image of a wound on the 5th day of the experiment
Note: ↑ is marginal growth of epithelium, [ is wound area not covered by epidermis with fibrin overlay, { is granulation tissue
В группе «Первая опытная» на 10 сутки эксперимента на месте кожного дефекта наблюдали образование нормотрофического рубца красно-розового цвета. При изучении микропрепарата определяется макрофагальная инфильтрация, на протяжении раны прослеживались фибробласты и плотно укомплектованная сеть коллагеновых волокон в структуре зрелой соединительной ткани, поверх которой определялся тонкий слой эпителия. В поле зрения визуализировались отдельные сосуды (рис. 8).
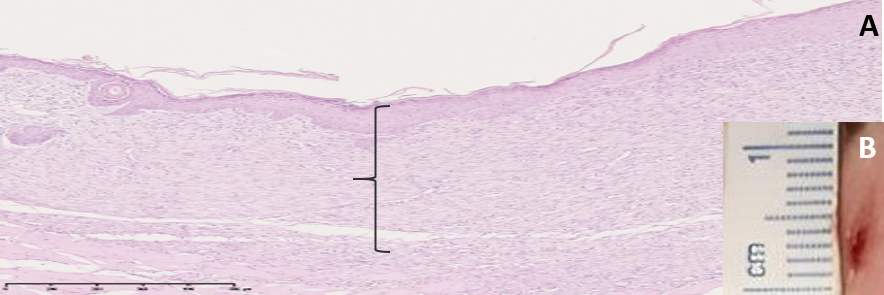
Рис. 8. A: микрофотография фрагмента кожи в области тканевого дефекта на 10 сутки эксперимента (группа «Первая опытная»), увеличение ×40. B: снимок раны на 10 сутки эксперимента
Примечание: { – рубцовая ткань
Fig. 8. А: the micriphotograph of a fragment of skin in the area of a tissue defect on the 5th day of the experiment (there is «First experimental» group), magnification ×40. B: the image of a wound on the 10th day of the experiment
Note: { is scar
В группе «Вторая опытная» на 5-е сутки эксперимента было отмечено уменьшение отека и нормализация цвета кожных покровов. В микропрепарат раны наблюдали рост грануляционной ткани, макрофагально-лимфоцитарную инфильтрацию, краевое нарастание эпидермиса (рис. 9).
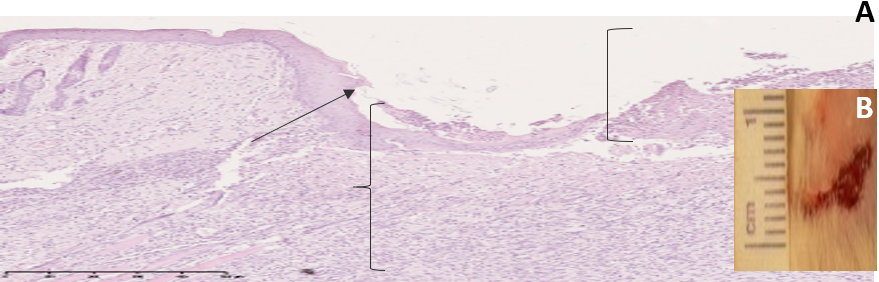
Рис. 9. A: микрофотография фрагмента кожи в области тканевого дефекта на 5 сутки эксперимента (группа «Вторая опытная»), увеличение ×40. Б: снимок раны на 5 сутки эксперимента
Примечание: ↑ – краевое нарастание эпителия; [ – участок раны, не покрытый эпидермисом с наложением фибрина; { – грануляционная ткань
Fig. 9. А: the micriphotograph of a fragment of skin in the area of a tissue defect on the 5th day of the experiment (there is «Second experimental» group), magnification ×40. B: the image of a wound on the 5th day of the experiment
Note: ↑ is marginal growth of epithelium, [ is wound area not covered by epidermis with fibrin overlay, { is granulation tissue
В группе «Вторая опытная» на 10-е сутки эксперимента рана без признаков воспаления. При микроскопии на месте кожного дефекта прослеживался многослойный неороговевающий эпителий, равномерно выраженный по всей поверхности. Структура подлежащей рубцовой ткани была представлена фибробластами и упорядоченными волокнами, имеющими тенденцию к образованию коллагеновых пучков (рис. 10).

Рис. 10. A: микрофотография фрагмента кожи в области тканевого дефекта на 10 сутки эксперимента (группа «Вторая опытная»), увеличение ×40. B: снимок раны на 10 сутки эксперимента
Примечание: { – рубцовая ткань
Fig. 10. А: the micriphotograph of a fragment of skin in the area of a tissue defect on the 5th day of the experiment (there is «Second experimental» group), magnification ×40. B: the image of a wound on the 10th day of the experiment
Note: { is scar
В процессе лечения постепенно уменьшались отек и инфильтрация окружающих тканей, происходило очищение ран от некротических масс, появлялись грануляции и начиналась эпителизация.
Обсуждение
Оценка состояния ран является необходимой составляющей лечебно-диагностического процесса, позволяющей значительно повысить качество ведения больных [Dini et al., 2023]. Одним из объективных способов контроля эффективности лечения ран являются методы изучения динамики коллагенообразования. В исследованиях, проведенных нами ранее, темпы фиброза как проявления регенерации оценивались на основании описательного гистологического и последующего морфометрического методов с определением клеточного индекса, что требовало выведения лабораторного животного из эксперимента для забора полнослойного участка раны для изготовления микропрепаратов [Григорьян и др., 2023].
Существует методика, основанная на измерении уровня щелочной фосфатазы в качестве индикатора коллагенообразования. Согласно данному методу, повышение активности щелочной фосфатазы предшествует образованию коллагена III типа, которое сопровождается снижением доли коллагена I типа. Когда активность щелочной фосфатазы исчезает, пропорция обоих типов I и III возвращается к норме, соответствующей соотношению 4:1. Однако данный метод также является косвенным и не дает однозначного представления о коллагеногенезе [Иванов и др., 2018].
На наш взгляд, наиболее оптимальным маркером интенсивности коллагенообразования является гидроксипролин, определенный непосредственно в тканях раны. В результате проведенного экспериментального исследования на модели кожной раны в условиях ишемии нами была показана эффективность применяемого метода лечения и метода определения уровня гидроксипролина, а также его диагностическая ценность и корреляционная взаимосвязь с другими показателями эффективности заживления раны.
Заключение
В аспекте проведенного нами экспериментального исследования по местному комбинированному лечению кожной раны в условиях ишемии путем применения разработанного оригинального лекарственного средства и магнитотерапии можно отметить, что наиболее высокий прирост гидроксипролина в грануляционном ложе и сокращение площади ран в условиях ишемии отмечались в группе «Вторая опытная». Данное обстоятельство свидетельствует о высокой эффективности сочетанного использования физиотерапевтических методов и местного многокомпонентного медикаментозного лечения в отношение дефектов мягких тканей на фоне артериальной недостаточности. Ввиду наличия сильной корреляционной связи между учетными показателями, а также на основании данных гистологического описания микропрепаратов ран была подтверждена достоверность методики количественного анализа гидроксипролина, которая в совокупности с планиметрическим методом исследования позволяет повысить объективность представления о течении раневого процесса.
Благодарности
Работа выполнена без внешних источников финансирования.





Список литературы
Бежин А.И., Липатов В.А., Фрончек Э.В., Григорьян А.Ю., Наимзада М.Д.З., Лазаренко Е.Д., Медведева М.А. 2019. Влияние хитозан-коллагенового комплекса с наночастицами серебра на течение раневого процесса в эксперименте. Человек и его здоровье, (2): 5–16. doi: 10.21626/vestnik/2019-2/01.
Григорьян А.Ю., Бежин А.И., Панкрушева Т.А., Жиляева Л.В., Мишина Е.С., Чекмарева М.С. 2023. Экспериментальная оценка особенностей течения раневого процесса при использовании оригинального раневого покрытия. Сибирское медицинское обозрение, 141: 93–99. doi: 10.20333/25000136-2023-3-93-99.
Иванов И.С., Темирбулатов В.И., Клеткин М.Е., Окунев О.А., Иванова И.А. 2018. Соотношение коллагена I и III типов в легких и коже у пациентов с буллезной эмфиземой легких, осложненной спонтанным пневмотораксом. Новости хирургии, 3: 293–300. doi: 10.18484/2305-0047.2018.3.293.
Максимов А.В., Кирьянова В.В. 2019. Магнитная терапия в клинической практике. Физиотерапия, бальнеология и реабилитация, 18(6): 412–426. doi: 10.17816/1681-3456-2019-18-6-412-426.
Моргун Е.И., Роговая О.С., Воротеляк Е.А. 2018. Модель ишемизированной длительно незаживающей кожной раны: клеточная гибель и механизмы ранозаживления. Современные технологии в медицине, 10(4): 69–77. doi: 10.17691/stm2018.10.4.08.
Муромцева Е.В., Сергацкий К.И., Никольский В.И., Шабров А.В., Альджабр М., Захаров А.Д. 2022. Лечение ран в зависимости от фазы раневого процесса. Известия вузов. Поволжский регион. Медицинские науки, 3(63): 93–109. doi: 10.21685/2072-3032-2022-3-9.
Путятина А.Н., Русских Г.С., Ким Л.Б. 2020. Способ определения фракций гидроксипролина в биологическом материале. Патент РФ № 2735375 C1, МПК G01N. 33/52:31.
Нохсорова М.А., Борисова Н.В., Аммосова А.М. 2019. Возможность диагностики недифференцированной дисплазии соединительной ткани с помощью биологических маркеров. Вестник новых медицинских технологий. Электронное издание, 13(4): 138–143. doi: 10.24411/2075-4094-2019-16435.
Сидоренко Г.Н., Кузьменко О.В., Лаптев Б.И., Горленко Н.П., Антошкин Л.В. 2020. Оценка механизмов действия и эффективности сочетанного действия фото и магнитотерапии (обзор литературы). Вестник новых медицинских технологий, 14(6): 100–109. doi: 10.24411/2075-4094-2020-16730.
Терехов А.Г., Григорьян А.Ю., Мишина Е.С. 2023. Способ моделирования кожной раны в условиях ишемии. Патент РФ № 2807383. МПК A61D 17/00 (2006.01), G09B 23/28 (2006.01). 32:12.
Туш Е.В., Елисеева Т.И., Халецкая О.В., Красильникова С.В., Овсянников Д.Ю., Потемина Т.Е., Игнатов С.К. 2019. Маркеры состояния экстрацеллюлярного матрикса и методы их исследования (обзор). Современные технологии в медицине, 11(2): 133–149. doi: 10.17691/stm2019.11.2.20.
Cissell D.D., Link J.M., Hu J.C., Athanasiou K.A.A. 2017. Modified Hydroxyproline Assay Based on Hydrochloric Acid in Ehrlich's Solution Accurately Measures Tissue Collagen Content. Tissue Eng. Part. C. Methods, 23(4): 243–250. doi: 10.1089/ten.tec.2017.0018.
Dini V., Granieri G., Michelucci A., Romanelli M. 2023. «Wound Measurement is an Essential Part of Wound Management». Chronic Wound Management: The Significance of Evidence and Technology. Cham: Springer International Publishing: 263–283. doi: 10.1007/978-3-031-26110-7_13.
Iljukhin E.A., Ivanov K.E., Micheev M.M. 2020. Lesion Meter: the Mobile App for the Ulcers Surface Area Measuring. URL: https://phlebounion.ru/en/projects#popup=/en/projects/mobilnoye-prilozheniye-izmereniya-ploshchadi-yazv-lesionmeter-5 (accessed: 17 February 2023).
Golaraei A., Mirsanaye K., Ro Y., Krouglov S., Akens M.K., Wilson B.C., Barzda V. 2019. Collagen Chirality and Three-Dimensional Orientation Studied with Polarimetric Second-Harmonic Generation Microscopy. J Biophotonics, 12(1). https://onlinelibrary.wiley.com/doi/full/10.1002/jbio.201800241 (accessed 17 February 2023). doi: 10.1002/jbio.201800241.
Moradi, M., Sabiza S., Rezaie A., Ezzati-Givi M. 2023. Investigating the Effect of Pentoxifylline and Zinc Oxide Combination on Experimental Full-Thickness Wound Healing in Rats. Iranian Journal of Veterinary Surgery, 18(1): 8–17. doi: 10.30500/ivsa.2022.355334.1313.
Najafi E., Ahmadi M., Mohammadi M., Beigmohammadi M.T., Heidary Z., Vatanara A., Khalili H. 2018. Topical Pentoxifylline for Pressure Ulcer Treatment: a Randomised, Double-Blind, Placebo-Controlled Clinical Trial. Journal of Wound Care, 27(8): 495–502. doi: 10.12968/jowc.2018.27.8.495.
O’Brien J., Parker C.N., Bui U., MacAndrew M., Mitchell J., Finlayson K.J. 2024. What is the Evidence on Skin Care for Maintaining Skin Integrity and Prevention of Wounds? An Integrative Review. Wound Practice & Research: Journal of the Australian Wound Management Association, 32(1): 25–33. doi: 10.33235/wpr.32.1.25-33.
Pasek J., Szajkowski S., Cieślar G. 2023. Application of Topical Hyperbaric Oxygen Therapy and Medical Active Dressings in the Treatment of Arterial Leg Ulcers. A Pilot Study. Sensors, 23(12): 5582. doi: 10.3390/s23125582.
Shukla S.K., Sharma A.K., Gupta V., Yashavarddhan M.H. 2019. Pharmacological Control of Inflammation in Wound Healing. Journal of Tissue Viability, 28(4): 218–222. doi: 10.1016/j.jtv.2019.09.002.