Анти-TSLP терапия тяжелой бронхиальной астмы
Aннотация
Бронхиальная астма – одно из самых распространенных хронических заболеваний в человеческой популяции. Тяжелая, неконтролируемая астма приводит к значительному снижению качества жизни пациента и повышенному использованию ресурсов здравоохранения. В последние годы были обнаружены различные молекулярные эффекторы и сигнальные пути, которые являются стартовыми медиаторами воспалительной реакции. Их возможное блокирование может значительно повысить эффективность терапии и позволит достичь контроля заболевания у подавляющего числа пациентов с тяжелой астмой. Препарат Тезепелумаб специфически связывается с тимическим стромальным лимфопоэтином (TSLP) на уровне его сайта связывания TSLPR (рецептор TSLP). Тезепелумаб применяется для лечения тяжелой неконтролируемой астмы без ограничения в биомаркерах и фенотипе и имеет значительную доказательную базу в отношении влияния на частоту обострений, улучшая показатели функции легких и качество жизни пациентов, связанное со здоровьем.
Ключевые слова: астма, хроническое воспаление дыхательных путей, фенотипы и эндотипы астмы, тезепелумаб, тимический стромальный лимфопоэтин
Введение
Бронхиальная астма (БА) – одно из самых распространенных хронических заболеваний респираторного тракта неинфекционного генеза, проявляющееся респираторными симптомами, обратимой обструкцией и гиперреактивностью дыхательных путей [Saglani, Lloyd, 2015; Global Initiative for Asthma, 2020]. В структуре заболевания преобладающими являются легкие и среднетяжелые формы, примерно у 5–10 % наблюдается тяжелое течение болезни [Авдеев и др., 2018; GINA Report, 2023]. У многих пациентов с тяжелой астмой заболевание остается неконтролируемым, несмотря на стандартную терапию, что серьезно влияет на качество жизни, связанное со здоровьем, из-за стойких симптомов и частых потенциально угрожающих для жизни обострений [Bleecker et al., 2020].
Важнейшей особенностью заболевания является гетерогенность, обусловленная различием иммунологических механизмов и ключевых молекул воспаления, что нашло отражение в формировании представления о фенотипах и эндотипах бронхиальной астмы. Знание об иммунологических механизмах формирования астмы и совокупных характеристиках вариантов течения болезни необходимо на современном этапе с целью осуществления персонализированного подхода к терапии заболевания. Наиболее распространенные фенотипы БА включают эозинофильное (в том числе аллергическое) воспаление 2-го типа (Тh2). Эозинофильные фенотипы характеризуются повышенным количеством эозинофилов в крови, обычно определяемым как минимум 150 или 300 клеток/мкл, и/или повышенным уровнем эозинофилов в мокроте как минимум на 2–3 % [Carr, Kraft, 2018]. При формировании аллергического фенотипа астмы у пациентов также наблюдается повышенный уровень сывороточного иммуноглобулина IgE – не менее 30 МЕ/мл в сочетании с гиперчувствительностью к аэроаллергенам и появлением симптомов, обусловленным аллергией [Carr et al., 2018; Carr, Kraft, 2018]. Еще одним маркером Тh2-воспаления является уровень фракционного выдыхаемого оксида азота (FeNO), который может быть повышен у пациентов с эозинофильным или аллергическим фенотипом, хотя пока нет единого мнения о пороге, при котором происходит повышенное содержание FeNO [Carr et al., 2018; Carr, Kraft, 2018; Alobaidi et al., 2021]. Тh2 эндотип бронхиальной астмы, опосредованный преимущественно цитокинами IL4, IL5, IL13, IgE и, соответственно, эозинофилией крови и мокроты, встречается примерно в 80 % случаев заболевания [Wang et al., 2020; Pérez de Llano et al., 2021]. Другие фенотипы (не-Тh2 воспаление) характеризуются преимущественно нейтрофильным воспалением с нормальным количеством эозинофилов или сочетанием с повышенным количеством эозинофилов и нейтрофилов (смешанное гранулоцитарное воспаление), нормальным или низким количеством нейтрофилов и эозинофилов (Pauci-гранулоцитарное воспаление) [Carr, Kraft, 2018; Tliba, Panettieri, 2019]. Помимо гетерогенности иммунных клеток и биомаркеров, среди вариантов течения астмы наблюдаются различия в других патофизиологических особенностях, таких как гиперреактивность и ремоделирование дыхательных путей, которые могут быть как связаны с воспалительными процессами в дыхательных путях, так и проявляться отдельно от них [Varricchi et al., 2022].
Материалы и методы
Литературными источниками явились базы данных PubMed, MedLine и eLibrary. Поиск проводился по ключевым словам среди русско- и англоязычных работ с 2018 года по 2023 год. Использовались систематические обзоры, метаанализы, когортные и рандомизированные оригинальные исследования.
Анализ современных литературных источников
Идентификация специфических иммунных путей, связанных с отдельными клиническими фенотипами, позволяет проводить таргетную терапию для определенной группы пациентов с тяжелой астмой и продолжает оставаться областью активных исследований. Биологические агенты, такие как моноклональные антитела, зарекомендовали себя как эффективный и общепризнанный метод контроля астмы, уменьшения частоты обострений и улучшения функции легких у пациентов с тяжелой БА [FitzGerald et al., 2018]. Таргетные препараты нацелены на специфические медиаторы и пути воспаления, которые играют решающую роль в патогенезе тяжелой астмы. Нейтрализуя или модулируя эти медиаторы, биологическая терапия направлена на снижение воспалительной реакции, которая является отличительной чертой тяжелой неконтролируемой астмы [Maeda, Khurana, 2023]. До 2023 г. в России применялись иммунобиологические препараты, позволяющие моделировать IgE-опосредованное воспаление (анти-IgE антитела, препарат омализумаб); дупилумаб – блокатор IL-4Ra, блокирующий сигнальный путь для IL-4 и IL-13, ключевых цитокинов Тh2 воспаления, и блокаторы IL-5 или IL-5Ra, влияющие на выживаемость эозинофилов (меполизумаб, реслизумаб и бенрализумаб). Согласно рекомендациям Глобальной инициативы по астме (GINA), таргетные препараты используются при персонализированной терапии тяжелой бронхиальной астмы на 5 ступени [GINA Report, 2023].
Вместе с тем тяжелое течение астмы у пациентов может быть ассоциировано с ключевой ролью нескольких цитокинов или иметь вариабельность цитокинового профиля, что может ограничивать контроль заболевания с помощью одного антицитокинового биологического препарата [Menzies-Gow et al., 2021; Maeda, Khurana, 2023]. Кроме того, существовавшие биологические методы лечения снижали частоту обострений только примерно на 50 %, что может быть связано с тем, что они нацелены на отдельные, нижестоящие элементы воспалительного каскада астмы, оставляя другие компоненты Th2 воспаления неизменными. Таргетные препараты назначались пациентам с эозинофильным или аллергическим фенотипом астмы, при этом отсутствуют одобренные биологические методы лечения пациентов с подтвержденной астмой с низким содержанием эозинофилов (при отсутствии системной кортикостероидной терапии, снижающей уровень эозинофилов) [Bleecker et al., 2016; Castro et al., 2018; Bleecker et al., 2020]. Выбор в качестве мишени для биологической терапии медиатора с широкой сферой влияния на воспалительный каскад может значимо сильнее угнетать воспаление дыхательных путей и обеспечивать более эффективный контроль астмы, в том числе у пациентов с низким содержанием эозинофилов. Одной из таких новых мишеней для таргетной терапии является тимический стромальный лимфопоэтин (TSLP).
Тимический стромальный лимфопоэтин (TSLP) был впервые выделен в 1994 году как цитокин, продуцируемый стромальными клетками тимуса, экспрессируется преимущественно на барьерных тканях, таких как кожа, эпителий бронхов, слизистая оболочка носа и слизистая оболочка кишечника. В верхних дыхательных путях TSLP в основном продуцируется реснитчатыми эпителиальными клетками, тучными клетками, макрофагами и эндотелиальными клетками [Toki et al., 2020]. Инвазия инфекционных патогенов и присутствующие на них патогенассоциированные молекулярные образы (PAMP) через взаимодействие с паттернраспознающими рецепторами (PRR) запускают активацию ядерного фактора NF-κB и выброс ряда цитокинов, в том числе TSLP. Также было показано, что механические повреждения и протеазы, связанные с образованием молекулярных фрагментов, ассоциированных с повреждениями (DAMP), индуцируют высвобождение TSLP [Gauvreau et al., 2020].
Тимический стромальный лимфопоэтин стимулирует созревание миелоидных дендритных клеток (ДК). Дендритные клетки, расположенные в эпителии дыхательных путей и подлежащей слизистой оболочке, представляют собой тип антигенпрезентирующих клеток. Эти клетки экспрессируют рецепторы врожденной иммунной системы и поглощают аллергены для переработки их в небольшие пептиды, представляя их через основные комплексы гистосовместимости (MHC) классов I и II для распознавания Т-клеточными рецепторами. Дыхательные пути не содержат ДК при рождении. Инфекционные агенты и различные повреждающие факторы, триггеры активации респираторного эпителия, вероятно, являются основными иммунологическими стимулами, инициирующими проникновение незрелых ДК из костного мозга [Ramsahai et al., 2019]. TSLP также активирует ДК через рецептор (TSLPR) на мембране и способствует инициации дифференцировки дендритной клеткой наивных CD4+ лимфоцитов в Th2 лимфоциты. TSLP способен непосредственно активировать тучные клетки после стимуляции эпителиальных клеток и индуцировать тучные клетки к высвобождению множественных провоспалительных цитокинов и хемокинов независимо от иммуноглобулина E (IgE). Кроме того, активированные IgE-опосредованные тучные клетки могут высвобождать фактор некроза опухоли-α (TNF-α), который может побуждать гладкомышечные клетки продуцировать TSLP эпителиальными клетками слизистой оболочки дыхательных путей [Boonpiyathad et al., 2019]. TSLP может стимулировать эозинофилы человека за счет активации внеклеточного и внутриклеточного сигнального пути. Повторное воздействие аллергенов или триггеров окружающей среды вызывает формирование адаптивного иммунного ответа. Воспалительные эффекторные клетки Th2 также секретируют цитокины IL-4, IL-9 и IL-13, которые усиливают выработку IgE, активность тучных клеток и, как следствие, способствуют гиперпродукции слизи и увеличивают гиперреактивность дыхательных путей [Koczulla et al., 2017].
Множественные данные свидетельствуют о способности TSLP управлять эффекторными функциями разных популяций миелоидных и лимфоидных клеток, участвующих в воспалительных реакциях при астме [Martini et al., 2017]. Также было показано, что экспрессия TSLP повышена в дыхательных путях пациентов с астмой по сравнению со здоровыми людьми, а уровни TSLP коррелируют с экспрессией хемокинов, привлекающих Тh2, тяжестью заболевания и риском обострения астмы (см. рисунок) [Menzies-Gow et al., 2020; Ko et al., 2021].
Таким образом, учитывая положение TSLP на старте воспалительного каскада, терапия, модифицирующая влияние TSLP, может обеспечить новый подход к лечению воспаления при астме.
В 2023 году в Российской Федерации был зарегистрирован препарат тезепелумаб, представляющий собой моноклональное антитело IgG2λ, которое специфически связывается с TSLP, предотвращая взаимодействие с его гетеродимерным рецептором. Основой для одобрения тезепелумаба в Российской Федерации стали положительные результаты клинического исследования III фазы NAVIGATOR. В ходе данного исследования тезепелумаб продемонстрировал достижение всех первичных и ключевых вторичных конечных точек у пациентов с тяжёлой бронхиальной астмой по сравнению с плацебо в качестве дополнительной терапии при добавлении к базисной терапии [Menzies-Gow et al., 2020; Menzies-Gow et al., 2021]. NAVIGATOR – это многоцентровое двойное слепое рандомизированное исследование III фазы длительностью 52 недели, в котором приняли участие 1 059 взрослых (18–80 лет) и подростков (12–17 лет) с тяжелой неконтролируемой астмой. Все пациенты во время исследования продолжали получать базисную терапию, включающую как минимум один препарат для базисной терапии (одновременно с ежедневным приёмом пероральных глюкокортикостероидов или без них) на фоне средних или высоких доз ингаляционного глюкокортикостероида. Исследуемые группы включали больных как с низким, так и с высоким уровнем эозинофилов в крови примерно в равных долях. Первичной конечной точкой эффективности была частота обострений БА в пересчёте на год в течение 52-недельного периода лечения. Ключевые вторичные конечные точки включали влияние тезепелумаба на лёгочную функцию, степень контроля бронхиальной астмы и качество жизни [Menzies-Gow et al., 2020; Menzies-Gow et al., 2021].
С целью изучения безопасности и эффективности тезепелумаба также было проведено исследование II фазы PATHWAY [Corren, et al., 2019]. Исследование PATHWAY представляло собой 52-недельное рандомизированное двойное слепое плацебо-контролируемое исследование IIb фазы в параллельной группе, проводимое для оценки эффективности и безопасности трёх режимов дозирования тезепелумаба: 70 мг и 210 мг каждые четыре недели и 280 мг каждые две недели в качестве дополнительной терапии у пациентов, имеющих в анамнезе обострения БА и неконтролируемую БА, получавших ИГКС или ДДБА одновременно с пероральными глюкокортикостероидами или без них и дополнительные средства для базисной терапии бронхиальной астмы. Первичной конечной точкой эффективности была частота обострений БА в пересчёте на год в течение 52-недельного периода лечения. Ключевые вторичные конечные точки включали влияние тезепелумаба на лёгочную функцию, степень контроля бронхиальной астмы и качество жизни, частоту тяжелых обострений в пересчёте на год, время до возникновения первого обострения [Corren, et al., 2019].
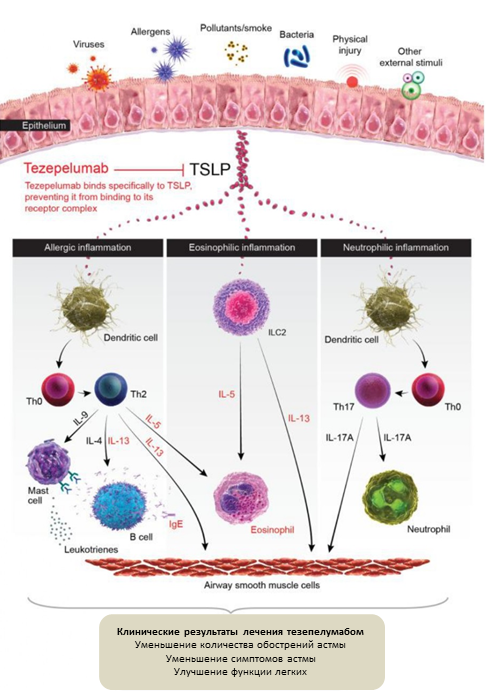
Механизм действия, благодаря которому тезепелумаб улучшает клинические исходы у пациентов с тяжелой астмой
Mechanism of action by which tezepelumab improves clinical outcomes in patients with severe asthma
В обоих исследованиях ежегодная частота обострений астмы оценивалась при различных фенотипах и эндотипах заболевания. Были проанализированы подгруппы пациентов, определенные по исходному количеству эозинофилов в крови и дыхательных путях, уровням FeNO и IgE. Для каждой из этих подгрупп в обоих исследованиях у пациентов, получавших тезепелумаб, наблюдалось снижение ежегодной частоты обострений астмы, повышался уровень контроля астмы, улучшение показателей дыхания и качества жизни по сравнению с пациентами в сопоставимых подгруппах, получавших плацебо [Corren et al., 2019; Menzies-Gow et al., 2020; Menzies-Gow et al., 2021].
Выводы
Бремя пациентов с тяжелой астмой является значительным и еще не полностью решено с помощью доступных вариантов лечения, включая биологическую терапию. В частности, в настоящее время не существует одобренных методов лечения пациентов с астмой с низким содержанием эозинофилов. Блокирование активности TSLP потенциально может оказывать более значимое воздействие на воспаление дыхательных путей, что достигается стартовым положением TSLP на вершине воспалительного каскада, опосредуя широкий спектр процессов, запускающих эозинофильное и нейтрофильное воспаление, а также структурные изменения дыхательных путей. Завершенные к настоящему времени клинические испытания тезепелумаба дали многообещающие результаты у пациентов с различными фенотипами астмы, у которых на фоне применения препарата наблюдалось значительное снижение частоты обострений и улучшение функции легких, контроля симптомов и качества жизни человека.





Список литературы
Авдеев С.Н., Ненашева Н.М., Жуденков К.В., Петраковская В.А., Изюмова Г.В. Распространенность, заболеваемость, фенотипы и другие характеристики тяжелой бронхиальной астмы в Российской Федерации. Пульмонология. 2018; 28(3): 341–358. doi: 10.18093/0869-0189-2018-28-3-341-358.
Alobaidi A.H., Alsamarai A.M., Alsamarai M.A. Inflammation in Asthma Pathogenesis: Role of T Cells, Macrophages, Epithelial Cells and Type 2 Inflammation. Antiinflamm Antiallergy Agents Med Chem. 2021; 20(4): 317–332. doi: 10.2174/1871523020666210920100707. PMID: 34544350
Bleecker E.R., FitzGerald J.M., Chanez P., Papi A., Weinstein S.F., Barker P., Sproule S., Gilmartin G., Aurivillius M., Werkström V., Goldman M.; SIROCCO study investigators. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. Lancet. 2016 Oct 29; 388(10056): 2115–2127. doi: 10.1016/S0140-6736(16)31324-1. Epub 2016 Sep 5. PMID: 27609408.
Bleecker E.R., Menzies-Gow A.N., Price D.B., Bourdin A., Sweet S., Martin A.L., Alacqua M., Tran T.N. Systematic Literature Review of Systemic Corticosteroid Use for Asthma Management. Am. J. Respir. Crit. Care. Med. 2020 Feb 1; 201(3): 276–293. doi: 10.1164/rccm.201904-0903SO. PMID: 31525297; PMCID: PMC6999108.
Boonpiyathad T., Sözener Z.C., Satitsuksanoa P., Akdis C.A. Immunologic mechanisms in asthma. Semin Immunol. 2019 Dec; 46: 101333. doi: 10.1016/j.smim.2019.101333. Epub 2019 Nov 6. PMID: 31703832.
Carr T.F., Kraft M. Use of biomarkers to identify phenotypes and endotypes of severeasthma. Ann Allergy Asthma Immunol. 2018 Oct; 121(4): 414–420. doi: 10.1016/j.anai.2018.07.029. Epub 2018 Jul 27. PMID: 30059792.
Carr T.F., Zeki A.A., Kraft M. Eosinophilic and Noneosinophilic Asthma. Am. J. Respir. Crit. Care. Med. 2018 Jan 1; 197(1): 22–37. doi: 10.1164/rccm.201611-2232PP. PMID: 28910134; PMCID: PMC5765385.
Castro M., Corren J., Pavord I.D., Maspero J., Wenzel S., Rabe K.F., Busse W.W., Ford L., Sher L., FitzGerald J.M., Katelaris C., Tohda Y., Zhang B., Staudinger H., Pirozzi G., Amin N., Ruddy M., Akinlade B., Khan A., Chao J., Martincova R., Graham N.M.H., Hamilton J.D., Swanson B.N., Stahl N., Yancopoulos G.D., Teper A. Dupilumab Efficacy and Safety in Moderate-to-Severe Uncontrolled Asthma. N. Engl. J. Med. 2018 Jun 28; 378(26): 2486–2496. doi: 10.1056/NEJMoa1804092. Epub 2018 May 21. PMID: 29782217.
Corren J. et al. Tezepelumab in adults with uncontrolled asthma [supplementary appendix; updated April 18, 2019]. N. Engl. J. Med. 2017; 377: 936–946.
FitzGerald J.M., Bleecker E.R., Menzies-Gow A., Zangrilli J.G., Hirsch I., Metcalfe P., Newbold P., Goldman M. Predictors of enhanced response with benralizumab for patients with severe asthma: pooled analysis of the SIROCCO and CALIMA studies. Lancet. Respir. Med. 2018 Jan; 6(1): 51–64. doi: 10.1016/S2213-2600(17)30344-2. Epub 2017 Sep 11. PMID: 28919200.
Gauvreau G.M., Sehmi R., Ambrose C.S., Griffiths J.M. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert Opin. Ther. Targets. 2020 Aug; 24(8): 777–792. doi: 10.1080/14728222.2020.1783242. Epub 2020 Jun 27. PMID: 32567399.
GINA Report, Global Strategy for Asthma Management and Prevention 2023. Available from: https://ginasthma.org/2023-gina-main-report/
Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2020. Available from: www.ginasthma.org
Ko H.-K., Cheng S.-L., Lin C.-H. et al. Blood tryptase and thymic stromal lymphopoietin levels predict the risk of exacerbation in severe asthma. Sci Rep. 2021; 11(1): 8425. doi: 10.1038/s41598-021-86179-1/
Koczulla A.R., Vogelmeier C.F., Garn H., Renz H. New concepts in asthma: Clinical phenotypes and pathophysiological mechanisms. Drug. Discov. Today 2017, 22, 388–396.
Maeda T., Khurana S. Heterogeneity of Treatment Response to Asthma. Adv. Exp. Med. Biol. 2023; 1426: 143–161. doi: 10.1007/978-3-031-32259-4_7. PMID: 37464120.
Martini E., Krug S.M., Siegmund B., Neurath M.F., Becker C. Mend Your Fences: The Epithelial Barrier and its Relationship With Mucosal Immunity in Inflammatory Bowel Disease. Cell. Mol. Gastroenterol. Hepatol. 2017 Mar 23; 4(1): 33–46. doi: 10.1016/j.jcmgh.2017.03.007. PMID: 28560287; PMCID: PMC5439240.
Menzies-Gow A. et al. Tezepelumab in Adults and Adolescents with Severe, Uncontrolled Asthma. N. Engl. J. Med. 2021; 384: 1800–1809. doi: 10.1056/NEJMoa2034975.
Menzies-Gow A., Wechsler M.E., Brightling C.E. Unmet need in severe, uncontrolled asthma: can anti-TSLP therapy with tezepelumab provide a valuable new treatment option? Respir Res. 2020 Oct 15; 21(1): 268. doi: 10.1186/s12931-020-01505-x. PMID: 33059715; PMCID: PMC7560289
Pérez de Llano L., Dacal Rivas D., Blanco Cid N., Martin Robles I. Phenotype-Guided Asthma Therapy: An Alternative Approach to Guidelines. J. Asthma Allergy. 2021 Mar 12; 14: 207–217. doi: 10.2147/JAA.S266999. PMID: 33737814; PMCID: PMC7966411
Ramsahai J.M., Hansbro P.M., Wark P.A.B. Mechanisms and Management of Asthma Exacerbations. Am. J. Respir. Crit. Care. Med. 2019 Feb 15; 199(4): 423–432. doi: 10.1164/rccm.201810-1931CI. PMID: 30562041
Tliba O., Panettieri R.A. Jr. Paucigranulocytic asthma: Uncoupling of airway obstruction from inflammation. J. Allergy Clin. Immunol. 2019 Apr; 143(4): 1287–1294. doi: 10.1016/j.jaci.2018.06.008. Epub 2018 Jun 19. PMID: 29928921; PMCID: PMC6301131
Toki S., Goleniewska K., Zhang J., Zhou W., Newcomb D.C., Zhou B., Kita H., Boyd K.L., Peebles R.S. Jr. TSLP and IL-33 reciprocally promote each other's lung protein expression and ILC2 receptor expression to enhance innate type-2 airway inflammation. Allergy. 2020 Jul; 75(7): 1606–1617. doi: 10.1111/all.14196. Epub 2020 Feb 24. PMID: 31975538; PMCID: PMC7354889
Wang E., Wechsler M.E., Tran T.N., Heaney L.G., Jones R.C., Menzies-Gow A.N., Busby J., Jackson D.J., Pfeffer P.E., Rhee C.K., Cho Y.S., Canonica G.W., Heffler E., Gibson P.G., Hew M., Peters M., Harvey E.S., Alacqua M., Zangrilli J., Bulathsinhala L., Carter V.A., Chaudhry I., Eleangovan N., Hosseini N., Murray R.B., Price D.B. Characterization of Severe Asthma Worldwide: Data From the International Severe Asthma Registry. Chest. 2020 Apr; 157(4): 790–804. doi: 10.1016/j.chest.2019.10.053. Epub 2019 Nov 27. Erratum in: Chest. 2021 Nov; 160(5): 1989. PMID: 31785254.
Varricchi G., Ferri S., Pepys J., Poto R., Spadaro G., Nappi E., Paoletti G., Virchow J.C., Heffler E., Canonica W.G. Biologics and airway remodeling in severe asthma. Allergy. 2022 Dec; 77(12): 3538–3552. doi: 10.1111/all.15473. Epub 2022 Aug 23. PMID: 35950646; PMCID: PMC10087445.