Хирургическая тактика при остром нарушении мезентериального кровообращения и его последствиях
Aннотация
Экстренная хирургия – кладезь бедственных патологий, отличающихся молниеносностью течения и требующих незамедлительного начала лечения. Среди таких заболеваний особое место отложено острому нарушению мезентериального кровообращения, которое было и остается нерешенной проблемой ургентной хирургии. Актуальность темы бесспорна ввиду значительного роста заболеваемости за последние годы наряду с отсутствием на сегодняшний день единой общепринятой тактики ведения подобных больных, что сказывается на высокой летальности и оправдывает интерес к данной патологии. С развитием медицины меняются видение и подходы к хирургическим вмешательствам, но так ли все просто в условиях современных возможностей и в эпоху развития малоинвазивной хирургии – вопрос открытый. В этой статье мы старались собрать воедино и изложить имеющиеся на данном этапе последние сведения о заболевании, разносторонние рекомендации по диагностике и лечению патологии. Возможно, секрет успеха кроется в другом.
Ключевые слова: острое нарушение мезентериального кровообращения, диагностика, эндоваскулярная хирургия, гибридная операция, шунтирование, резекция кишечника
Острое нарушение мезентериального кровообращения (ОНМезК) – патологическое состояние, характеризующееся внезапным полным или частичным нарушением кровотока по брыжеечным артериям и венам. Последствия такого процесса могут варьировать в самых разных проявлениях от обратимого до необратимого характера, определяемых большим количеством предрешающих факторов. Несмотря на практическое применение новых методов диагностики и лечения, ОНМезК было и остается трудным заболеванием с высокой летальностью.
Возрастной диапазон ОНМезК коррелирует в различных значениях, но, в частности, встречается у лиц пожилого и старческого возраста. Пусть патология и считается редкой, но ее распространенность среди лиц данной возрастной группы растет в геометрической прогрессии, что делает ее наиболее выявляемой причиной «острого живота» [Chou et al., 2021; Tolonen et al., 2021]. Исключением являются тромбозы мезентериальных вен, на которые приходится относительно молодой контингент пациентов. Не отмечается достоверного гендерного преимущества заболеваемости ОНМезК, но больше авторов отмечают высокий процент выявления среди лиц женского пола.
Этиопатогенез. Существует множество классификаций патологии, наиболее значимые из которых [Савельев и соавт., 2014, с. 239] для удобства восприятия представлены в виде кластера (рисунок 1).
Однако на практике применяется деление на 4 основные клинические формы ОНМезК [Гафарова, Тимербулатов, 2022; Lim et al., 2019; Sakamoto et al., 2021]: вследствие артериальной эмболии, артериального тромбоза, венозного тромбоза и неокклюзионной формы мезентериальной ишемии. Отмечается преобладание артериального генеза ОНМезК над венозным. Среди непосредственных причин преимущественно поражение сосудов эмболом, далее по убыванию идут тромбоз мезентериальных артерий, неокклюзионная мезентериальная ишемия и мезентериальный венозный тромбоз [Панкратов и др., 2020].
Закупорке эмболом подвергается в бо́льшей степени верхняя брыжеечная артерия (ВБА), что связано с ее анатомическими особенностями: малый угол отхождения при относительно большом диаметре сосуда. Источниками эмболов, как правило, являются камеры сердца [Гафарова, Тимербулатов, 2022], реже – аорта. Характерна для мезентериальной эмболии закупорка более дистальных отделов ВБА и сопутствующая эмболия в других органах: селезенке, печени, почках, даже в головном мозге.
Тромб, противоположно эмболии, поражает проксимальные отделы брыжеечных артерий [Chou et al., 2021], возникая у места отхождения сосудов, что характеризуется более масштабными поражениями кишечника, но относительно замедленным течением [Гафарова, Тимербулатов, 2022].
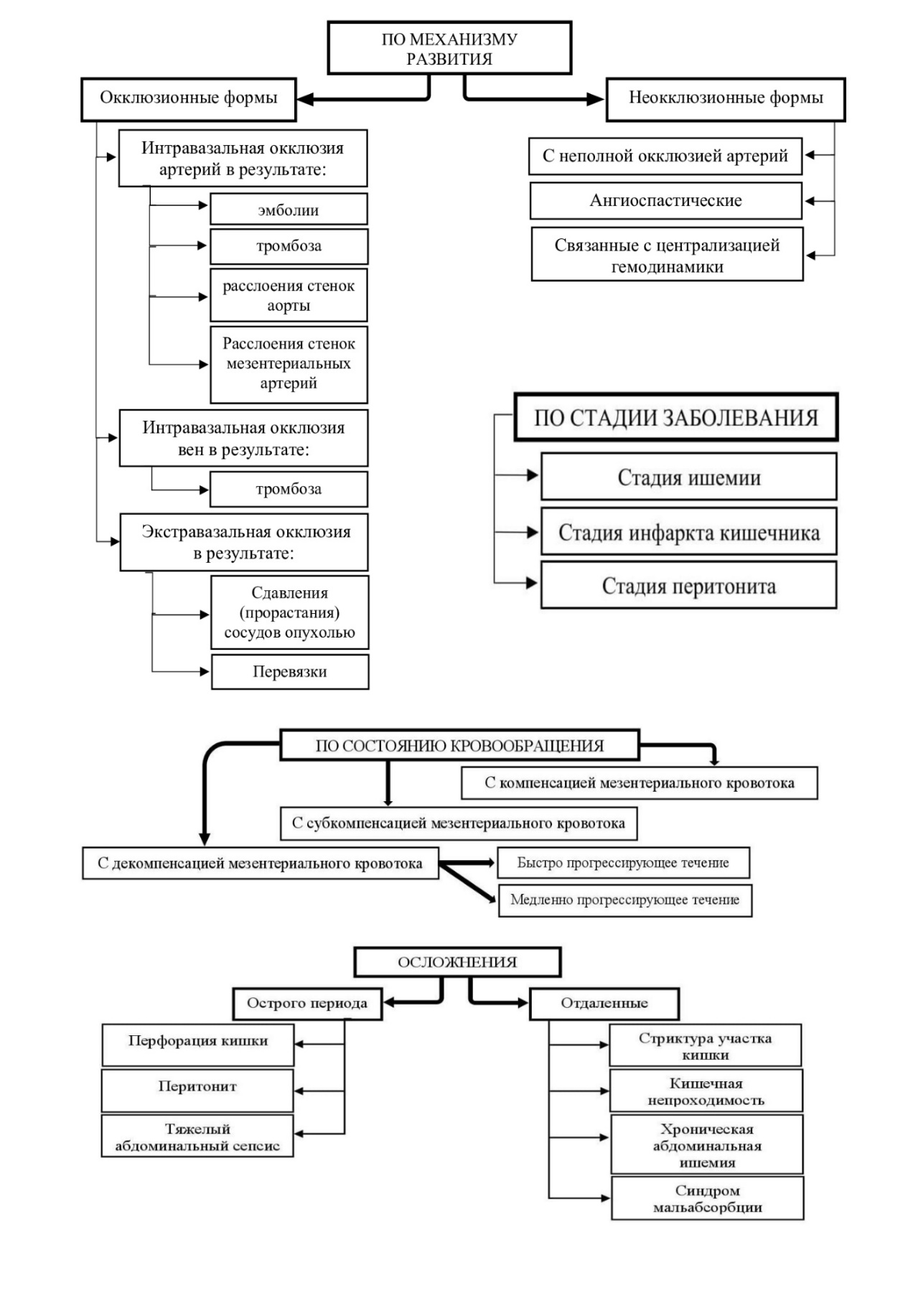 Рис. 1. Классификация острого нарушения мезентериального кровообращения
Рис. 1. Классификация острого нарушения мезентериального кровообращения
Fig. 1. Classification of acute mesenteric ischemia
Острый мезентериальный венозный тромбоз – самая редкая форма ОНМезК. Причинные факторы варьируют в совершенно разных диапазонах клинических проявлений от наследственных заболеваний до злокачественных новообразований. Но в основе патогенеза, как утверждается, так или иначе лежит одна из причин: гиперкоагуляция, снижение скорости кровотока, повреждение эндотелия (триада Вирхова) [Björck et al., 2017]. Следует отметить выявление данной формы, в частности, у лиц молодого и трудоспособного возраста, среди которых особый контингент – представители женского пола с курением и длительным применением оральных контрацептивов в анамнезе.
Неокклюзионная мезентериальная ишемия (НОМИ) – своего рода неведомая завеса в числе ОНМезК. Очень часто НОМИ обнаруживается у критических больных [Yu, Kirkpatrick, 2022], находящихся в отделении реанимации и интенсивной терапии (ОРИТ). В сущности, НОМИ является третичным проявлением на фоне гипоперфузии, возникающей вследствие вторичной вазоконстрикции мезентериальных артерий по причине какого-либо первичного фактора среди огромного разнообразия [Kärkkäinen, 2021], в числе которых сердечная недостаточность, гиповолемия, снижение сердечного выброса, септический шок, масштабные оперативные вмешательства, гемодиализ, прием вазоконстрикторов и даже раннее послеоперационное энтеральное питание.
В патогенезе ОНМезК значима способность капиллярной сети подслизистого слоя стенки кишечника перенаправлять кровь от слизистой в мышечную и серозную оболочки кишечника в условиях нарушения кровотока (адаптивный механизм противотока) [Björck et al., 2017], что указывает на последовательность развития ишемического процесса от внутреннего слоя к наружному. В условиях острой нехватки кислорода вследствие нарушенного кровотока и работы компенсаторных механизмов клетки претерпевают ряд патологических изменений. При раннем восстановлении кровотока клетки, подверженные ишемии, могут восстановиться, испытывая лишь клеточную дисфункцию (обратимые изменения). Затяжной процесс нарушенного кровотока вызывает необратимые изменения, характеризующиеся повреждением эндотелия сосудов и высвобождением в большом количестве активных форм кислорода, способствующие развитию местной воспалительной реакции. Чем дольше длится процесс ишемии, тем выше риск развития фатальных проявлений в виде реперфузионного синдрома при естественной попытке технической ликвидации причины закупорки/спазма сосудов [Yu, Kirkpatrick, 2022], когда иммунная система с механизмов защиты «переключается» на обратное, местное воспаление прогрессирует до системной воспалительной реакции, развивается полиорганная недостаточность [Eltzschig, Eckle, 2011]. Наряду с проблемой ишемия-реперфузия в условиях ОНМезК условно-патогенная микрофлора кишечника обретает патогенные свойства. Микроорганизмы способны проникать в слизистую оболочку и выделять в просвет кишечника эндо- и экзотоксины, распространяться за пределы кишечника гематогенным и лимфогенным путями, что приводит к развитию бактериальной транслокации [Luther et al., 2018].
Макроскопически проявления соответствуют стадиям ишемического и геморрагического инфаркта кишки. На начальных этапах стенка кишечника обретает застойный и отечный вид, по мере прогрессирования ишемии она становится рыхлой, истончается вплоть до толщины «пергаментной бумаги» ввиду разрушения мышечного слоя и потери тонуса, что будет свидетельствовать о необратимом трансмуральном некрозе кишечника, приводящем к перфорации и перитониту.
Характерные на ранних стадиях ОНМезК мигрирующие, «мозаичного» характера боли по всему животу без четкой локализации объясняются спастическими сокращениями мышечной оболочки тонкого кишечника в условиях ишемии, которые также способствуют появлению диареи с кровью и рефлекторной рвоты. Ну а период «мнимого благополучия» связан непосредственно с трансмуральным некрозом [Luther et al., 2018], когда спастические сокращения сменяются атонией.
Клиника. ОНМезК – труднодиагностируемая патология. Тщательный сбор анамнеза с выявлением сопутствующих заболеваний и факторов риска – основа высокой подозрительности. Клиническая симптоматика ОНМезК неспецифична и очень затруднительна [Резниченко и др., 2022]. Однако среди прочего выделяется симптомокомплекс: боли в животе, не соответствующие физикальному обследованию [Gupta, Tomar, 2020]; рвота, возможно с примесью крови или в виде «кофейной гущи»; диарея, часто по типу «малинового желе». Прогрессирование заболевания приводит к угасанию вышеописанных симптомов: боли сменяются латентным периодом, а на смену диарее приходят вздутие живота и запор, свидетельствующие о развитии необратимой ишемии.
Диагностика. На этапе постановки диагноза важно каждое звено от момента транспортировки в стационар и до прибытия в операционную. Значима повышенная осведомленность сотрудников СМП, специалистов смежных отделений неотложной помощи [Tolonen et al., 2021], так как от них в том числе зависит скорейшее начало специализированного лечения пациента с ОНМезК в отделении/стационаре по профилю.
Лабораторная диагностика при этой патологии на данном отрезке времени не радует, так как нет специфических маркеров, способных с точностью подтвердить или опровергнуть диагноз [Дарвин и др., 2019; Гафарова, Тимербулатов, 2022; Jagielski et al., 2020; Bala et al., 2022], все состоит из предполагаемых условностей. Упоминаемые биомаркеры: лейкоциты, С-реактивный белок, трансаминазы, амилаза, лактат и его изомеры, D-димер, прокальцитонин – относительны и играют лишь вспомогательную роль. Есть сообщения о последних открытиях в сфере лабораторной диагностики. Речь идет о следующих биомаркерах: кишечный белок, связывающий жирные кислоты – I-FABP; белок цитоскелета виллин-1 – VIL-1; маркер гладких мышц – Smooth Muscle 22 (SM22). Отмечается высокая специфичность этих показателей, есть предположения, что именно они станут основными параметрами ранней и безоговорочной диагностики ОНМезК. Также упоминается об анализе летучих органических соединений (ЛОС) в выдыхаемом воздухе. Исследования с описанными биомаркерами и ЛОС еще продолжаются, завершение планируется лишь к 2024 году [Clinical trial, 2022].
Самые распространенные и доступные методы инструментальной диагностики – рентгенография и УЗИ, к сожалению, неспецифичны при ОНМезК. Ангиография, считавшаяся «золотым» стандартом диагностики ОНМезК, сдала свои позиции ввиду инвазивности, длительности процедуры и недоступности в большинстве стационаров [Дарвин и др., 2019]. На сегодняшний день бесспорным лидером среди инструментальных методов диагностики по чувствительности и специфичности является КТ-ангиография (КТА) (трехфазная), способная оценить не только кровоток в сосудах, но и дать некоторую характеристику патологического состояния самого кишечника и других органов [Гафарова, Тимербулатов, 2022; Lim et al., 2019]. Однако неправильно полагаться только на результаты КТА, особенно в вопросах степени поражения кишечника [Bukhari, Kumar, 2021] и диагностики НОМИ. При данном исследовании для полноценной интерпретации радиологом снимков КТА значим направительный диагноз, результативность напрямую зависит от правильного подозрения в направлении [Гафарова, Тимербулатов, 2022]. Минусом КТА является нефротоксичность контрастного вещества. Но даже тогда рекомендуется ее проведение больным с заболеваниями почек при подозрении ОНМезК, так как любые колебания и промедление чреваты катастрофическими последствиями, а польза ранней диагностики и лечения будет превышать риски от КТА [Гафарова, Тимербулатов, 2022]. Есть предположения, что в будущем МР-ангиография станет эталоном диагностики ОНМезК ввиду возможности избежать рисков ионизирующей радиации, аллергической реакции и исключения нефротоксичности, ну а пока этот метод не столь распространен из-за неспособности пространственного разрешения и длительности обследования [Lim et al., 2019].
Диагностическая лапароскопия – отдельный предмет для обсуждения. Малоинформативность лапароскопии способна снизить настороженность лечащей команды и повлечь серьезные последствия. На практике же диагностическая лапароскопия полезна при многоэтапном лечении ОНМезК через 12–24–48 часов после проведенной реканализации сосуда, при резекции некротизированного участка кишечника с или без наложения анастомоза. Обретает популярность так называемый метод «прикроватной лапароскопии», позволяющий избежать транспортировки критических больных с возможностью проведения процедуры непосредственно в ОРИТ [Bala et al., 2022].
Лечение. В определении тактики ведения больных с ОНМезК важную роль играет совокупность различных факторов. Если раньше о лечении инфарктов кишечника судили как о «бесполезном и малоперспективном деле», то сегодня мы наблюдаем пусть и не желаемую, но положительную динамику. ОНМезК – состояние, для благополучного исхода которого требуется не только комплекс мероприятий, но и согласованная командная работа разнопрофильных специалистов.
С развитием медицины изменились взгляды и подходы к хирургическому лечению ОНМезК, однако основные принципы неизменны: скорейшая реваскуляризация и удаление некротизированных сегментов кишечника [Sakamoto et al., 2021]. Споры относительно лучшего метода лечения в пользу одного и в ущерб другого совсем неуместны, ведь тактика лечения должна основываться на индивидуальности конкретного клинического случая [Bala et al., 2022]. Современные методы, бесспорно, малоинвазивные и щадящие в отношении пациентов, однако не все новое и современное означает лучшее и незаменимое для всех и каждого. При принятии решения о выборе тактики ведения нужно уметь строго различать грань между актуальным, допустимым, возможным и целесообразным, а не зацикливаться на «современности». Алгоритм ведения подобных больных должен быть обширным и всеобъемлющим, значим мультидисциплинарный подход, важно учесть все возможные клинические формы ОНМезК, необходимо предположить всяческие варианты отклонения от прописанных пунктов с предложенными альтернативными выходами из любой потенциально возможной ситуации вплоть до конкретного исхода (желательно, благополучного), что будет способствовать незамедлительной реакции и действиям медицинского персонала без лишнего колебания ни на одном из этапов лечения.
Выбор хирургической тактики при окклюзии мезентериальных артерий напрямую зависит от длительности патологического процесса. Ранняя диагностика и начало лечения требуют щадящих подходов в лечении и связаны с благополучным исходом [Bukhari, Kumar, 2021]. Чем дольше длится процесс ишемии, тем сложнее подходы в лечении и, соответственно, стремительнее приближение осложнений, несовместимых с жизнью. Согласно исследованиям, временно́й диапазон обратимости ишемии условно варьирует в пределах первых 6–12 часов от момента появления симптомов. Считается, что в рамках этого отрезка времени достаточно лишь реваскуляризации без дополнительных вмешательств [Jagielski et al., 2020]. При длительности заболевания более 24 часов стоит задача посерьезнее, включающая реваскуляризацию и лапаротомию с целью оценки жизнеспособности кишечника с последующей, при необходимости, резекцией некротического участка. Ну а промежуток времени между 12 и 24 часами – дилемма, требующая реваскуляризацию, но вызывающая сомнения по поводу лапаротомии [Jagielski et al., 2020].
В последнее время популярность обрели эндоваскулярные вмешательства, зарекомендовавшие себя ввиду меньшей травматичности [Дарвин и др., 2019] и, согласно исследованиям, меньшей кровопотери и потребности в лапаротомии, значительно меньшего объема резекции кишечника, сокращения сроков пребывания в стационаре, низкой смертности [Агасян и др., 2020; Bala et al., 2022]. Среди эндоваскулярных методов региональный и локальный тромболизис, реолитическая/аспирационная тромб-/эмболэктомия, баллонная ангиопластика со стентированием, анте-/ретроградная реканализация со стентированием, чрескожные чреспеченочные тромболизис/тромбэктомия. Проводятся описанные процедуры (за исключением чреспеченочных методов) через бедренный или плечевой артериальные доступы, может потребоваться и их комбинация. В частности, по сообщениям авторов, показатели технического успеха довольно высоки. Но при неудачных попытках или невозможности проведения эндоваскулярных операций возникает потребность в открытой реканализации сосудов, что приводит к временны́м задержкам [Li et al., 2022]. Противопоказаниями к проведению подобных операций являются некроз и перфорация кишечника, сепсис, перитонит [Luther et al., 2018]. Однако есть утверждения, что даже перитонит не является помехой, так как не всегда свидетельствует о необратимости кишечной ишемии [Hayashi et al., 2020]. Крайне опасное потенциальное осложнение эндоваскулярных вмешательств – дистальная эмболизация [Агасян и др., 2020; Luther et al., 2018; Kärkkäinen, 2021]. В сущности, эндоваскулярные вмешательства способны обеспечить только восстановление кровотока, поэтому являются методом выбора у больных относительно стабильных, без признаков ишемии или в стадии обратимой ишемии кишки [Sakamoto et al., 2021; Li et al., 2022]. Самый значимый недостаток – отсутствие возможности оценки жизнеспособности кишечника. Поэтому крайне важен процесс отбора соответствующих пациентов для эндоваскулярного вмешательства.
При длительном пребывании кишечника в условиях нарушенного кровотока тактика лечения не столь банальна, а ожидаемые исходы менее обнадеживающие. Тромбоэмболия мезентериальных артерий наряду с признаками развитой ишемии кишечника предполагает следующие варианты хирургического лечения: стандартное эндоваскулярное вмешательство с последующей лапаротомией и резекцией кишечника; обретающая популярность гибридная операция; открытая реваскуляризация с резекцией по требованию.
Гибридные операции подразумевают одномоментное проведение эндоваскулярной реваскуляризации и лапаротомии в условиях гибридных операционных [Дарвин и др., 2019]. Реваскуляризация осуществляется путем ретроградного открытого мезентериального стентирования (РОМС). Преимуществами гибридной операции являются работа на «открытом» животе и возможность проведения открытой реканализации сосудов без прерывания операции и лишних трат времени при неудаче попыток устранения причины окклюзии методом РОМС [Tolonen et al., 2021]. Считается, что гибридная операция предпочтительна при тромботической окклюзии, в сложных клинических ситуациях, когда стандартные методы лечения не способны справиться. Но проведенные ретроспективные исследования в определенной когорте не выявили статистически значимых преимуществ РОМС над мезентериальным шунтированием. Единственной доказанной положительной отличительной характеристикой стал показатель продолжительности оперативного вмешательства, который короче при РОМС [Sakamoto et al., 2021; Bala et al., 2022]. Важным препятствием является отсутствие гибридных операционных при большом количестве стационаров хирургического профиля, что делает данный метод лечения невозможным к применению.
Открытые методы реваскуляризации включают открытые эмболэктомии, тромбартерэктомии, артериальное мезентериальное шунтирование. Исследования повествуют бо́льшую вероятность 1- и 2-годичной проходимости сосудов при мезентериальном шунтировании по сравнению с эндоваскулярными вмешательствами [Lim et al., 2019], особенно со стентированием. Главное преимущество открытых методов – возможность оценки жизнеспособности кишечника [Bala et al., 2022; Li et al., 2022]. Наряду с методом РОМС у шунтирования есть преимущества над чрескожными вмешательствами – работа на перекрытом сосуде, что отменяет риски дистальной эмболизации разрушенными частицами тромба или атеросклеротической бляшки. Недостатки шунтирования: необходимость и трудность выделения мезентериальных артерий, технические сложности и невозможность выполнения при выраженной кальцификации сосудов, длительность процедуры, большая кровопотеря.
Подходы в реваскуляризации пораженных сосудов при остром мезентериальном венозном тромбозе и НОМИ масштабно отличаются от вышеописанных методов. Тромбоз мезентериальных вен, в частности, лечится консервативно [Bala et al., 2022], проводятся антикоагулянтная, антиагрегантная и системная тромболитическая терапия. При неэффективности консервативной терапии применяются чрескожные вмешательства [Дарвин и др., 2019], а именно селективный/региональный тромболизис, чрескожный чреспеченочный/трансяремный катетерный тромболизис, сочетание этих методов с тромбоаспирацией. Необходимость длительного лечения и применения высоких доз тромболитических препаратов является значимым недостатком катетерного тромболизиса, также имеется немало противопоказаний.
С неокклюзионной формой дела обстоят гораздо сложнее, так как первостепенным шагом в лечении является устранение триггера вазоспазма [Sakamoto et al., 2021; Bala et al., 2022]. Есть сообщения об эффективности непосредственного введения в пораженный сосуд папаверина, нитроглицерина, простагландина Е [Luther et al., 2018; Kärkkäinen, 2021]. Однако эти сообщения основаны лишь на небольших клинических испытаниях, и нет официальных рекомендаций в пользу внутриартериальной терапии.
В отношении резекции кишечника важен учет понятий физиологической и хирургической радикальности. К сожалению, на практике не всегда удается обеспечить физиологическую радикальность ввиду обширного инфаркта кишечника, что впоследствии приводит к развитию «Синдрома короткой кишки». Спорные вопросы, связанные с резекцией, касаются многих аспектов. Сравнивая результаты исследований, можно сказать, что при ОНМезК с признаками ишемии/некроза кишечника и перитонита больше сторонников многоэтапного лечения с плановой релапаротомией согласно принципам «контроля повреждений» («Damage Control») [Панкратов и др., 2020; Luther et al., 2018; Bala et al., 2022]. Данная стратегия оправдана ввиду большого риска несостоятельности первично-наложенного межкишечного анастомоза из-за загрязненности брюшной полости и воспалительных изменений самой стенки кишки [Lim et al., 2019]. Следование тактике «контроля повреждений» подразумевает максимальное сокращение длительности первой операции с выполнением только крайне необходимых для выживания больного манипуляций: реваскуляризации и резекции некротического участка кишечника [Атаян и др., 2019]. Реконструктивная операция должна выполняться в плановом порядке после коррекции состояния больного в ОРИТ [Gupta, Tomar, 2020]. Описаны следующие варианты временного закрытия концов резецированного кишечника: закрытие концов приводящей и отводящей участков наглухо, выведение дистальной части приводящей кишки в виде стомы с закрытием конца отводящей кишки наглухо, У-образный межкишечный анастомоз (с выведением дистального участка приводящей кишки наружу в виде стомы). Важным пунктом при резекции кишечника является сохранение брыжейки, а не ее удаление по принципам онкологической хирургии [Атаян и др., 2019; Kärkkäinen, 2021]. Вопросы временного закрытия лапаротомной раны с целью меньшей травматизации пациента и профилактики абдоминального компартмент-синдрома до сих пор не решены, не существует единого оптимального метода временного закрытия брюшной полости, в разных исследованиях применяются абсолютно разные подходы: закрытие протезной сеткой, вакуум-ассистированными повязками, провизорными швами. Критической точкой в вопросе резекции является объем, так как определение четкой зоны некроза – понятие субъективное и сложная задача даже для опытного хирурга [Атаян и др., 2019]. Описанные методы интраоперационной оценки степени кровотока в капиллярах – флоуметрия и ICG-технология – не получили широкого применения. При последнем имеется ряд факторов, влияющих на результаты с возможной неверной интерпретацией истинного положения, в числе которых гемодинамическая нестабильность пациентов, обученность и опыт оперирующей бригады, способность к расшифровке полученных данных. Этот вопрос остается открытым по сей день, но принципы резекции неизменны: сохранение по возможности максимального участка жизнеспособного кишечника наряду с возможным полным удалением некротического участка с целью минимизации осложнения в виде «синдрома короткой кишки» [Панкратов и др., 2020].
К сожалению, бывают безвыходные неоперабельные ситуации на фоне ОНМезК, когда единственным подходом в лечении является паллиативная терапия [Gupta, Tomar, 2020; Bala et al., 2022].
На этапе лечения ОНМезК обязательным считаются разгрузка ЖКТ, покой кишечника с применением назогастроеюнального зонда [Gupta, Tomar, 2020; Bala et al., 2022], вне зависимости от предшествующей лапаротомии. Начало антибиотикотерапии на дооперационном этапе является неоспоримым [Bala et al, 2022]. Рекомендуется эмпирическая антибиотикотерапия [Lim et al., 2019] до определения чувствительности присутствующей бактериальной флоры к антибиотикам. До-, интра-, послеоперационная коррекция состояния пациента значимы для снижения анестезиологических рисков. Крайне важна профилактика развития реперфузионного синдрома, предотвращение которого достигается путем стабилизации состояния и функции внутренних органов. Есть предположения, что с данным нарушением помогает справляться антиоксидантная терапия, но нет доказанных клинических исследований [Luther et al., 2018]. Вопросы антикоагулянтной терапии, парентерального питания, необходимости нутритивной поддержки требуют мультидисциплинарного подхода для благополучия лечения.
В современном мире существуют специализированные «центры кишечного инсульта» для лечения больных с ОНМезК, обеспечивающие мультидисциплинарный подход [Chou et al., 2021]. Имеются сообщения об эффективности работы данных центров с тенденцией к снижению показателей смертности, однако открыты они лишь в определенных уголках мира.
В процессе диагностики ОНМезК мы не обходимся без упоминания сопутствующих патологий и факторов риска, которые определяют развитие ишемии по той или иной причине, что следует брать во внимание для выявления группы риска пациентов, предрасположенных к ОНМезК, чтобы усилить мероприятия на стадии профилактики заболевания, ведь, как говорится, «легче предупредить, чем лечить». Возможно, акцент внимания именно на профилактике приведет к глобальным переменам в исходе ОНМезК.
1. ОНМезК сквозь десятилетия были и остаются масштабной проблемой экстренной хирургии со многими спорными моментами.
2. Диагностика ОНМезК сложна, степень подозрительности низка, что напрямую коррелирует с конечными результатами.
3. Лечение ОНМезК не всегда успешно несмотря на прогрессы в медицине, что сказывается на высокой летальности.
4. Возможно, успех предотвращения фатальных последствий патологии кроется именно в профилактике развития ОНМезК у лиц в группе риска.





Список литературы
Агасян Г.А., Миронков А.Б., Прямиков А.Д., Хрипун А.И. 2020. Эндоваскулярные методики в лечении острой ишемии кишечника (обзор литературы). Вестник хирургии имени И.И. Грекова, 179 (4): 102–108. doi: 10.24884/0042-4625-2020-179-4-102-108
Атаян А.А., Косенков А.Н., Кузнецов М.Р. и др. 2019. Гибридная тактика в лечении острого нарушения мезентериального кровообращения. Русский Медицинский Журнал, 8 (II): 83–88.
Гафарова А.Р., Тимербулатов Ш.В. 2022. Острая мезентериальная ишемия: этиология и современные методы ранней диагностики. Медицинский вестник Башкортостана, 17 (1): 58–65.
Дарвин В.В., Мазайшвили К.В., Климова Н.В., Васильев В.В. 2019. Современные возможности и перспективы организации неотложной ангиохирургической помощи больным с острой мезентериальной ишемией. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова, 14 (2): 89–93. doi: 10.25881/BPNMSC.2019.80.36.019
Панкратов А.А., Переходов С.Н., Зеленин Д.А., Израилов Р.Е., Матков И.В. 2020. Острая мезентериальная ишемия – инкурабельная ситуация? Современное состояние проблемы. Хирургия. Журнал им. Н.И. Пирогова, 12: 105–110. doi: 10.17116/hirurgia2020121105
Резниченко А.М., Михайличенко В.Ю., Бутырский А.Г. 2022 Острое нарушение мезентериального кровообращения: нерешенные проблемы в диагностике и лечении. Таврический медико-биологический вестник, 25 (2): 198–204. doi: 10.37279/2070-8092-2022-25-2-198-204
Руководство по неотложной хирургии органов брюшной полости. Под редакцией В.С. Савельева: Издательство «Медицинское информационное агентство»; 2014: 239.
Bala M. et al. 2022. Acute mesenteric ischemia: updated guidelines of the World Society of Emergency Surgery. World journal of emergency surgery, 17 (1): 54. doi: 10.1186/s13017-022-00443-x
Björck M., Koelemay M., Acosta S. et al. 2017. Editor's Choice – Management of the Diseases of Mesenteric Arteries and Veins: Clinical Practice Guidelines of the European Society of Vascular Surgery (ESVS). European journal of vascular and endovascular surgery, 53 (4): 460–510. doi: 10.1016/j.ejvs.2017.01.010
Bukhari H.A., Kumar A. 2021. Early Surgical Intervention Improves Survival in Acute Intestinal Ischemia in the Intensive Care Unit. BioMed research international, 2021. doi: 10.1155/2021/6672591
Chou E.L., Wang L.J., McLellan R.M., Feldman Z.M., Latz C.A., LaMuraglia G.M., Clouse W.D., Eagleton M.J., Conrad M.F. 2021. Evolution in the Presentation, Treatment, and Outcomes of Patients with Acute Mesenteric Ischemia. Annals of vascular surgery, 74: 53–62. doi: 10.1016/j.avsg.2021.01.116
Clinical trial. 2022. The Detrimental Course of Acute Intestinal Ischemia: Improvement of the Diagnosis.
Eltzschig H.K., Eckle T. 2011. Ischemia and reperfusion – from mechanism to translation. Nature medicine, 17 (11): 1391–1401. doi: 10.1038/nm.2507
Hayashi K., Hayashi K., Narita M., Tsunoda A., Kusanagi H. 2020. Still time to perform intestinal revascularization in patients with acute mesenteric ischemia with peritonitis: An analysis of bowel viability in resections. SAGE open medicine, 8. doi: 10.1177/2050312120923227
Jagielski M., Piątkowski J., Jackowski M. 2020. Challenges Encountered during the Treatment of Acute Mesenteric Ischemia. Gastroenterology research and practice, 2020. doi: 10.1155/2020/5316849
Kärkkäinen J.M. 2021. Acute Mesenteric Ischemia: A Challenge for the Acute Care Surgeon. Scandinavian journal of surgery, 110 (2): 150–158. doi: 10.1177/14574969211007590
Li W., Cao S., Zhang Z., Zhu R., Chen X., Liu B., Feng H. 2022. Outcome Comparison of Endovascular and Open Surgery for the Treatment of Acute Superior Mesenteric Artery Embolism: A Retrospective Study. Frontiers in surgery, 9. doi: 10.3389/fsurg.2022.833464
Lim S., Halandras P.M., Bechara C., Aulivola B., Crisostomo P. 2019. Contemporary Management of Acute Mesenteric Ischemia in the Endovascular Era. Vascular and Endovascular Surgery, 53 (1): 42–50. doi: 10.1177/153857441880
Luther B., Mamopoulos A., Lehmann C., Klar E. 2018. The Ongoing Challenge of Acute Mesenteric Ischemia. Visceral medicine, 34 (3): 217–223. doi: 10.1159/000490318
Sakamoto T., Kubota T., Funakoshi H., Lefor A.K. 2021. Multidisciplinary management of acute mesenteric ischemia: Surgery and endovascular intervention. World journal of gastrointestinal surgery, 13 (8): 806–813. doi: 10.4240/wjgs.v13.i8.806
Tolonen M., Lemma A., Vikatmaa P., Peltola E., Mentula P., Björkman P., Leppäniemi A., Sallinen V. 2021. The implementation of a pathway and care bundle for the management of acute occlusive arterial mesenteric ischemia reduced mortality. The journal of trauma and acute care surgery, 91 (3): 480–488. doi: 10.1097/TA.0000000000003305
Yu H., Kirkpatrick I.D.C. 2022. An Update on Acute Mesenteric Ischemia. Canadian Association of Radiologists Journal, 0 (0). doi: 10.1177/08465371221094
Gupta S., Tomar D.S. 2020. Ischemic Gut in Critically Ill (Mesenteric Ischemia and Nonocclusive Mesenteric Ischemia). Indian journal of critical care medicine, 24 (4): 157–161. doi: 10.5005/jp-journals-10071-23611