Применение коллагенового матрикса для аугментации мягких тканей во фронтальном отделе верхней челюсти
Aннотация
Повышение эффективности лечения пациентов с дефицитом толщины мягких тканей при проведении дентальной имплантации в эстетически значимой зоне является актуальным вопросом хирургической стоматологии. Проведение гистоморфометрического анализа мягких тканей, полученных в результате применения коллагенового матрикса и соединительнотканного трансплантата. В рамках исследования было проведено обследование и лечение 30 пациентов, которых случайным образом распределили на две группы. В 1-й группе для увеличения толщины мягких тканей применяли свободный соединительнотканный трансплантат (ССТ) с неба или бугра верхней челюсти, во 2-й группе использовали коллагеновый матрикс с поперечно-сшитой структурой (КМ). Через 3 месяца после оперативного вмешательства на этапе установки формирователей десны при помощи мукотома проводили забор фрагмента мягких тканей для проведения гистоморфометрического анализа. В обеих группах слизистая оболочка биоптатов десны была выстлана многослойным плоским эпителием относительно большой толщины с выраженным акантозом. Собственно слизистая оболочка десны, отграниченная от эпителия базальной мембраной, представлена рыхлой соединительной тканью. По итогам морфометрического анализа статистически значимых различий выявлено не было, за исключением того, что среднее значение количества клеток воспаления в эпителиальном слое в группе ССТ было равно 7,1 ± 0,8, при этом в группе КМ – 12,8 ± 1,1 (p = 0,0001), в собственно слизистой оболочке этот показатель в группе ССТ был равен 63,8 ± 4,9, а в группе КМ – 82,7 ± 9,0 (p = 0,03). Доля коллагеновых волокон в группе ССТ достигала 88,5 ± 0,9 %, а в группе КМ – 82,5 ± 1,8 % (0,005). После проведенного гистоморфометрического анализа можно сделать вывод о возможности применения коллагенового матрикса в качестве материала для увеличения толщины мягких тканей.
Ключевые слова: соединительнотканный трансплантат, ксеногенный коллагеновый матрикс, увеличение объема мягких тканей, дентальный имплантат, гистоморфометрический анализ
В последнее время характеристикам мягких тканей вокруг дентальных имплантатов уделяется значительное внимание. Известно, что такой параметр, как ширина кератинизированной прикрепленной слизистой оболочки, является важным фактором для поддержания здорового состояния тканей пародонта и тканей, окружающих дентальные имплантаты [Ашурко и др., 2022; Cairo et al., 2019; Lee et al., 2021]. Большой интерес в области хирургической стоматологии в настоящее время уделяется изучению другого параметра периимплантного фенотипа – толщине мягких тканей вокруг имплантатов [Puisys et al., 2019; Cosyn et al., 2021]. Толщина мягких тканей имеет важное значение для достижения удовлетворительного эстетического результата, который определяется цветом, текстурой и контуром мягких тканей, что особенно актуально при проведении имплантации во фронтальном отделе верхней челюсти [Testori et al., 2018; Zuiderveld et al., 2018]. Принято считать, что минимально допустимой является толщина мягких тканей в 2–3 мм, и в случае ее дефицита необходимо проводить реконструктивные операции [Тарасенко, Загорский, 2019; Avila-Ortiz et al., 2020].
Таким образом, увеличение толщины мягких тканей является важным этапом при проведении дентальной имплантации, который может быть выполнен как с применением аутогенных тканей, так и с использованием их заменителей [Rojo et al., 2018; Ashurko et al., 2022a]. Использование заменителей мягких тканей представляется все более привлекательным для практического применения. Недавние исследования сообщают об успешном использовании ксеногенных коллагеновых матриксов, которые сокращают время операции, снижают частоту осложнений, болезненность манипуляции и демонстрируют хороший эстетический результат [Ашурко и др., 2022; Gargallo-Albiol et al., 2019; Angelis De et al., 2021].
Большинство авторов сходятся во мнении, что именно ксеногенные коллагеновые матрицы являются достойной заменой аутогенным трансплантатам за счет их способности к полной биодеградации, быстрой васкуляризации, замещению соединительной тканью и биосовместимости [Puisys et al., 2019; Toledano et al., 2020b]. При этом необходимо отметить недостаточное количество исследований, посвященных изучению особенностей гистологического строения и морфометрических характеристик мягких тканей, полученных с применением коллагеновых матриксов с поперечно-сшитой структурой, в особенности при их использовании во фронтальном отделе верхней челюсти.
Данное рандомизированное контролируемое продольное исследование с двумя параллельными группами проводилось на клинической базе кафедры хирургической стоматологии Института стоматологии им. Е.В. Боровского Первого МГМУ им. И.М. Сеченова, в рамках которого было обследовано и прооперировано 30 пациентов с диагнозом «частичное отсутствие зубов», у которых был выявлен дефицит толщины мягких тканей в зоне планируемой установки имплантатов. Все пациенты методом случайной выборки были распределены на 2 группы. Для увеличения толщины мягких тканей в области установленных дентальных имплантатов у пациентов 1-й группы (N = 15) проводилась пересадка свободного соединительнотканного трансплантата (ССТ) из области бугра верхней челюсти, во 2-й группе (n = 15) использовался коллагеновый матрикс (КМ) Fibro-Gide (Geistlich Pharma AG, Wolhusen, Switzerland).
В исследование были включены 16 женщин и 14 мужчин в возрасте от 18 до 45 лет. Все пациенты подписали добровольное информированное согласие на участие в исследовании, которое было одобрено этическим комитетом Первого МГМУ им. И.М. Сеченова. Данное исследование было также зарегистрировано в международном реестре клинических исследований ClinicalTrials.gov (№ NCT05551962).
Операцию выполняли стандартным образом: проводили разрез по вершине альвеолярного гребня в пределах дефекта, откидывали полнослойный слизисто-надкостничный лоскут, по стандартному протоколу устанавливали дентальный имплантат. Далее у пациентов 1-й группы проводили забор свободного соединительнотканного трансплантата с неба или бугра верхней челюсти и фиксировали трансплантат при помощи горизонтального П-образного шва к вестибулярному слизисто-надкостничному лоскуту. У пациентов 2-й группы аналогичным образом фиксировали фрагмент коллагенового матрикса. Следующим этапом операции у пациентов обеих групп была мобилизация слизисто-надкостничного лоскута с последующим наложением простых узловых швов без натяжения. В постоперационном периоде пациентам назначали стандартную антибактериальную и противовоспалительную терапию с применением местных антисептиков для ежедневного ухода в первые 5–7 дней.
Через 3 месяца после оперативного вмешательства на этапе установки формирователей десны в области ранее проведенного увеличения толщины слизистой оболочки при помощи мукотома провели забор фрагмента мягких тканей с обнажением винта-заглушки имплантата.
Биоптаты фиксировали в забуференном формалине, обезвоживали в изопропаноле, заливали в парафин, получали срезы толщиной 4 микрона, окрашивали гематоксилином-эозином, пикросириусом красным, орсеином. Окрашенные срезы заключали в синтетическую среду «Shandon mount» (США). Изучали при светлопольной, фазово-контрастной и поляризационной световых микроскопиях в микроскопе Leica DM 4000 B LED с камерой Leica DFC 7000 T. В лицензионной программе ImageJ на изображениях микропрепаратов при увеличении ×50 через каждые 100 мкм измеряли толщину слоев в биоптатах десны пациентов: эпителиальный слой (отдельно длина и количество гребней), сосочковый (отдельно длина сосочков) и сетчатый слои. Также на 100 мкм2 слизистой оболочки десны были подсчитаны площадь сосудов, плотность расположения коллагеновых и эластических волокон, количество клеток воспаления.
Статистический анализ экспериментальных данных проводился с использованием программного обеспечения GraphPad Prism 7.00. Достоверность различий оценивали с помощью однофакторного анализа ANOVA с тестом множественного сравнения Тьюки. P-значения ≤ 0,05 считались статистически значимыми. Результаты статистического анализа были представлены в виде гистограммы.
При гистологическом исследовании слизистая оболочка биоптатов десны в обеих группах была выстлана многослойным плоским эпителием относительно большой толщины с выраженным акантозом (рис. 1).
1.1) 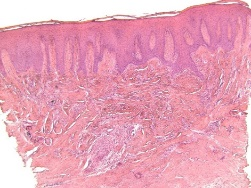 1.2)
1.2) 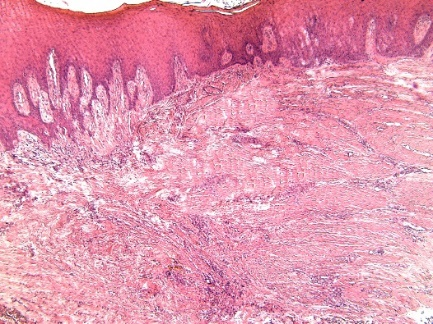
Рис. 1. Гипертрофия и акантоз многослойного плоского эпителия десны:
1.1) биоптат ССТ. Светлопольная микроскопия. Увеличение ×50;
1.2) биоптат КМ. Светлопольная микроскопия. Увеличение ×50. Окраска гематоксилином-эозином
Fig. 1. Hypertrophy and acanthosis of the multilayered squamous epithelium of the gum:
1.1) biopsy of CTG. Light-field microscopy. Magnification ×50;
1.2) biopsy of CM. Light-field microscopy. Magnification ×50. Staining with hematoxylin-eosin
Собственно слизистая оболочка десны, отграниченная от эпителия базальной мембраной, представлена рыхлой соединительной тканью, непосредственно под эпителием – сосочковый слой и в глубоких отделах – сетчатый слой. Сосочковый слой имеет более рыхлую структуру, чем сетчатый слой. В сосочках, находящихся между эпителиальными гребнями, коллагеновые волокна собраны в пучки и расположены вертикально, что отчетливо видно при фазово-контрастной микроскопии (рис. 2).
1.1) 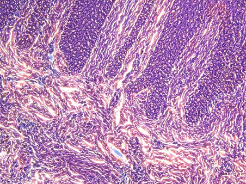 1.2)
1.2) 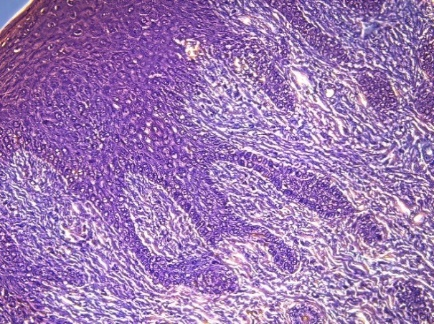
Рис. 2. Сосочковый слой слизистой оболочки десны:
1.1) биоптат ССТ. Фазово-контрастная микроскопия. Увеличение ×200;
1.2) биоптат КМ. Фазово-контрастная микроскопия. Увеличение ×200. Окраска гематоксилином-эозином
Fig. 2. Papillary layer of the gingival mucosa:
1.1) biopsy of CTG. Phase contrast microscopy. Magnification ×200;
1.2) biopsy of CM. Phase contrast microscopy. Magnification ×200. Staining with hematoxylin-eosin
Сетчатый слой представлен рубцовой тканью, состоящей из переплетающихся между собой или ориентированных продольно коллагеновых пучков, между которыми располагаются в основном фибробласты с незначительным количеством лейкоцитов и макрофагов. При окраске пикросириусом красным коллагеновые волокна окрашиваются в ярко-красный цвет (рис. 3.1, 3.2), а при поляризационной микроскопии с такой окраской волокна дают яркую анизотропию (рис. 3.3, 3.4). При окраске орсеином в этой ткани практически отсутствуют эластические волокна, что характерно для рубцов, единичные эластические волокна обнаруживаются лишь в околососудистых зонах (рис. 3.5, 3.6).
3.1) 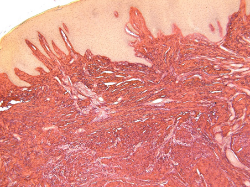 3.2)
3.2) 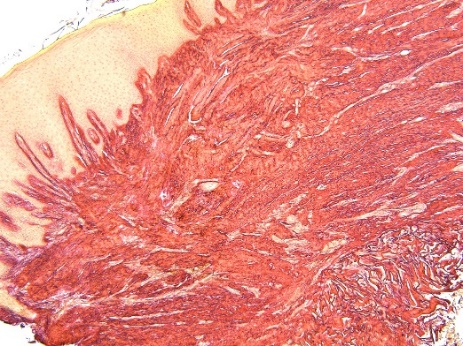
3.3)  3.4)
3.4) 
3.5) 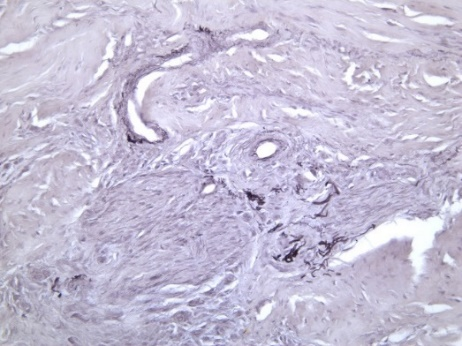 3.6)
3.6) 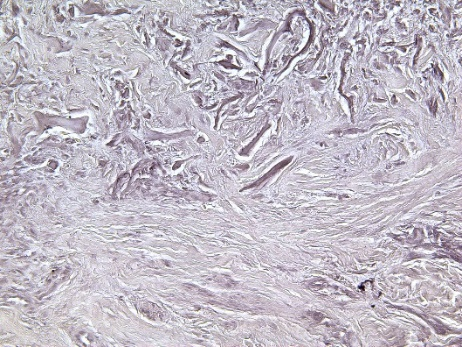
Рис. 3. Формирование рубцовой ткани в сетчатом слое слизистой оболочки:
3.1) биоптат ССТ. Светлопольная микроскопия. Окраска пикросириусом красным. Увеличение ×50;
3.2) биоптат КМ. Светлопольная микроскопия. Окраска пикросириусом красным. Увеличение ×50;
3.3) биоптат ССТ. Поляризационная микроскопия. Окраска пикросириусом красным. Увеличение ×50;
3.4) биоптат КМ. Поляризационная микроскопия. Окраска пикросириусом красным. Увеличение ×50;
3.5) биоптат ССТ. Светлопольная микроскопия. Окраска орсеином. Увеличение ×200;
3.6) биоптат КМ. Светлопольная микроскопия. Окраска орсеином. Увеличение ×200
Fig. 3. The formation of scar tissue in the mesh layer of the mucous membrane:
3.1) biopsy of CTG. Light-field microscopy. Coloring by picrosirius red. Magnification ×50;
3.2) biopsy of CM. Light-field microscopy. Coloring by picrosirius red. Magnification ×50;
3.3) biopsy of CTG. Polarization microscopy. Coloring by picrosirius red. Magnification ×50;
3.4) biopsy of CM. Polarization microscopy. Coloring by picrosirius red. Magnification ×50;
3.5) biopsy of CTG. Light-field microscopy. Coloring with orsein. Magnification ×200;
3.6) biopsy of CM. Light-field microscopy. Coloring with orsein. Magnification ×200
В группе КМ по сравнению с ССТ отмечается более обширная зона рубцовой ткани и чаще встречаются очаги разрыхления и деструкции коллагеновых волокон (рис. 4).
4.1) 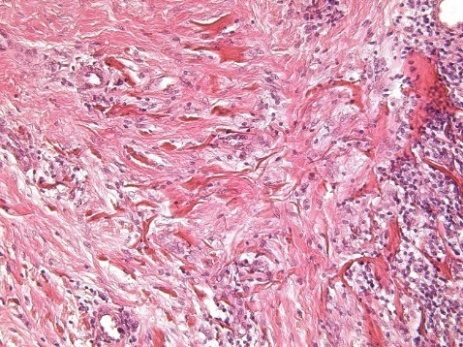 4.2)
4.2) 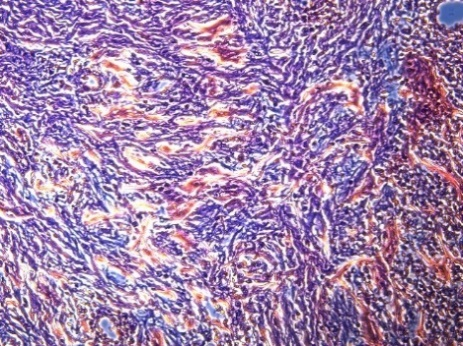
Рис. 4. Очаги разрыхления и деструкции коллагеновых волокон в сетчатом слое слизистой оболочки КМ:
4.1) Светлопольная микроскопия. Окраска гематоксилином-эозином. Увеличение ×200;
4.2) Фазово-контрастная микроскопия. Окраска гематоксилином-эозином. Увеличение ×200. Окраска гематоксилином-эозином
Fig. 4. Foci of loosening and destruction of collagen fibers in the mesh layer of the CM mucosa:
4.1) Light-field microscopy. Staining with hematoxylin-eosin. Magnification ×200;
4.2) Phase contrast microscopy. Staining with hematoxylin-eosin. Magnification ×200. Staining with hematoxylin-eosin
В группе ССТ глубже рубцового слоя видна ткань аутотрансплантата, в которой выявляются достаточно крупные участки резко выраженного склероза, а также сосуды с частично или полностью облитерированным просветом (рис. 5), в некоторых участках определяется прорастание новых сосудов.
5.1) 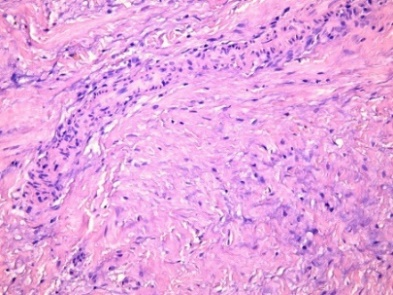 5.2)
5.2) 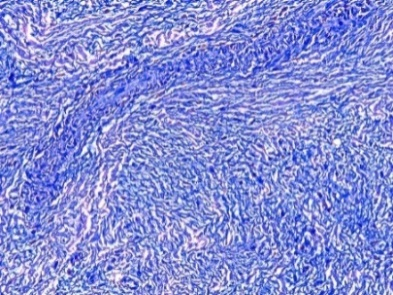 5.3)
5.3) 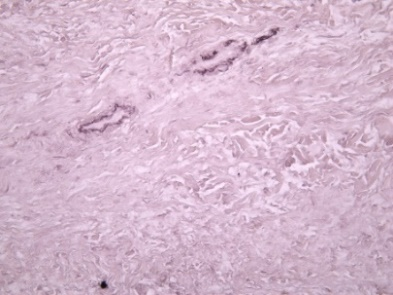
Рис. 5. Дистрофические изменения ткани ССТ после трансплантации:
5.1) Светлопольная микроскопия. Окраска гематоксилином-эозином. Увеличение ×200;
5.2) Фазово-контрастная микроскопия. Окраска гематоксилином-эозином. Увеличение ×200. Окраска гематоксилином-эозином;
5.3) Светлопольная микроскопия. Окраска орсеином. Увеличение ×200
Fig. 5. Dystrophic changes in CTG tissue after transplantation:
5.1) Light-field microscopy. Staining with hematoxylin-eosin. Magnification ×200;
5.2) Phase contrast microscopy. Staining with hematoxylin-eosin. Magnification ×200. Staining with hematoxylin-eosin;
5.3) Light-field microscopy. Coloring with orsein. Magnification ×200
Под рубцовой тканью в группе КМ находится относительно рыхлая волокнистая соединительная ткань ксенотрансплантата, состоящая из двух компонентов: толстых и редких пучков коллагеновых волокон, с расположенной между ними сетью тонких коллагеновых волокон (рис. 6). Наблюдается постепенная резорбция КМ и его замещение собственной соединительной тканью.
При более детальном исследовании были отмечены различия в воспалительной инфильтрации. Так, в группе КМ в сосочковом и сетчатом слоях отмечается умеренная лимфо-макрофагальная инфильтрация, которая в основном прослеживается в участках с деструкцией коллагеновых волокон, а также васкулит и гиперемия сосудов.
В то же время в группе ССТ лимфо-макрофагальная инфильтрация эпителия минимальна. Во всей соединительнотканной основе встречаются незначительные лимфо-макрофагальные инфильтраты и сосуды со слабыми явлениями периваскулита.
6.1) 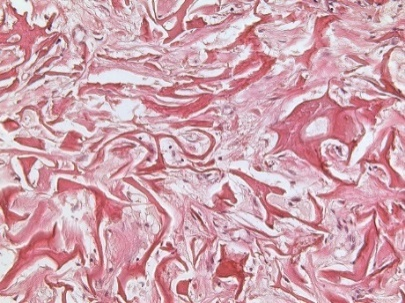 6.2)
6.2) 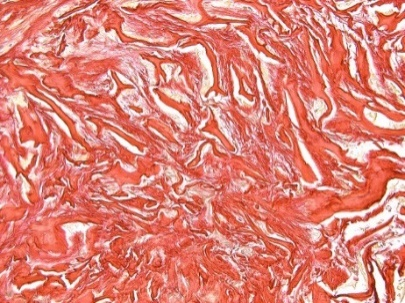 6.3)
6.3) 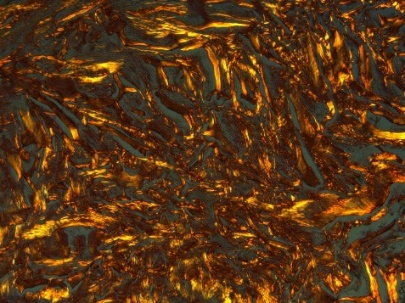
Рис. 6. Дистрофические изменения ткани ССТ после трансплантации.
6.1) Светлопольная микроскопия. Окраска гематоксилином-эозином. Увеличение ×200.
6.2) Фазово-контрастная микроскопия. Окраска гематоксилином-эозином. Увеличение ×200. Окраска гематоксилином-эозином.
6.3) Светлопольная микроскопия. Окраска орсеином. Увеличение ×200
Fig. 6. Dystrophic changes in CTG tissue after transplantation.
6.1) Light-field microscopy. Staining with hematoxylin-eosin. Magnification ×200.
6.2) Phase contrast microscopy. Staining with hematoxylin-eosin. Magnification ×200. Staining with hematoxylin-eosin.
6.3) Light-field microscopy. Coloring with orsein. Magnification ×200
По результатам морфометрического анализа было выявлено, что общая толщина слизистой оболочки сходным образом увеличивается в обеих группах. Среднее значение количества клеток воспаления в эпителиальном слое в группе ССТ было равно 7,1 ± 0,8, при этом в группе КМ – 12,8 ± 1,1 (p = 0,0001), в собственно слизистой оболочке этот показатель в группе ССТ был равен 63,8 ± 4,9, в группе КМ – 82,7 ± 9,0 (p = 0,03). Доля коллагеновых волокон в группе ССТ достигала 88,5 ± 0,9 %, а в группе КМ – 82,5 ± 1,8 % (0,005). По остальным показателям, которые отражены в гистограмме, статистически значимых различий не выявлено (рис. 7).
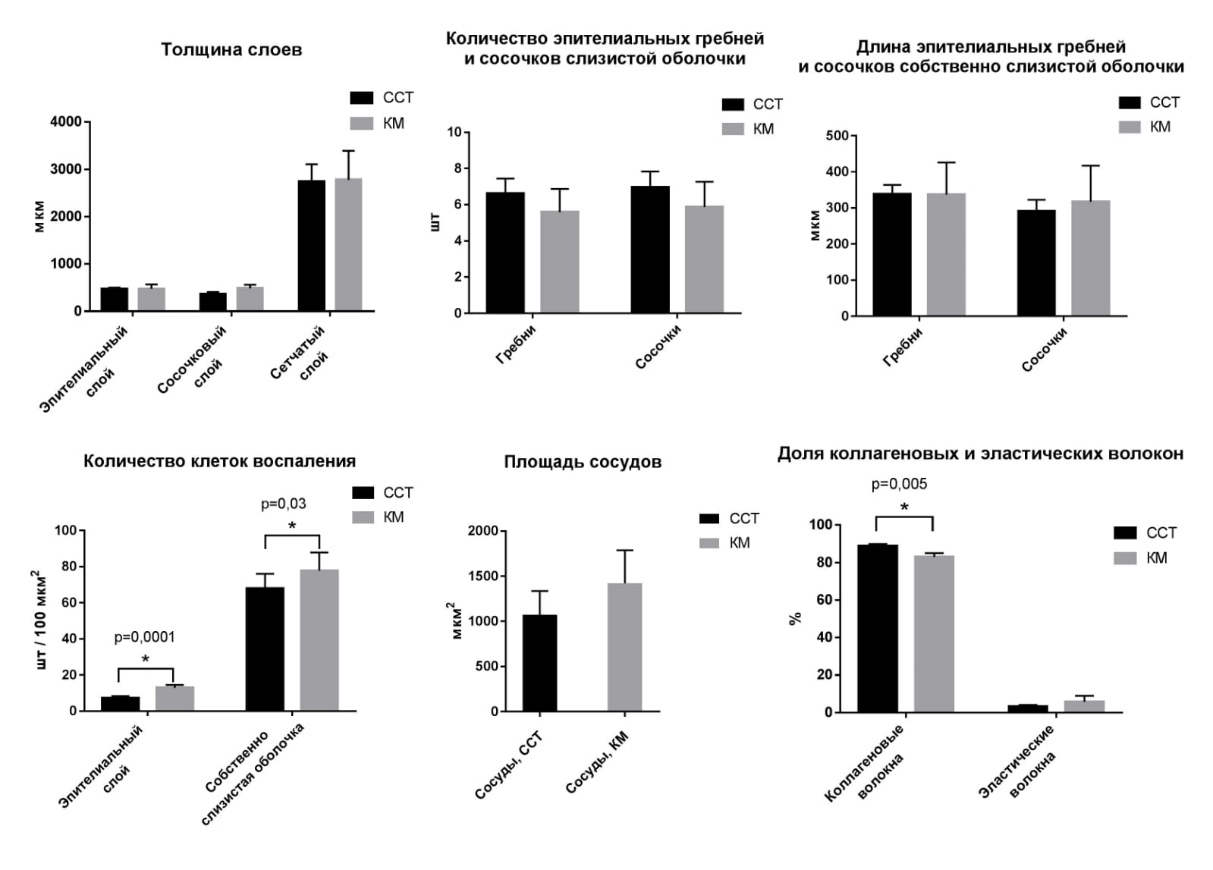
Рис. 7. Средние значения показателей в группах ССТ и КМ: толщина слоев; количество эпителиальных гребней и сосочков слизистой оболочки; длина эпителиальных гребней и сосочков собственно слизистой оболочки; количество клеток воспаления; площадь сосудов; доля коллагеновых и эластических волокон
Fig. 7. Average values of indicators in the CST and CM groups: thickness of layers; number of epithelial ridges and papillae of the mucous membrane; length of epithelial ridges and papillae of the lamina propria; number of inflammatory cells; vascular area; proportion of collagen and elastic fibers
В литературе описаны различные техники аугментации мягких тканей как в области зубов, так и в области дентальных имплантатов. Золотым стандартом по-прежнему считается использование субэпителиального соединительнотканного трансплантата [Thoma et al., 2018; Sanz-Martín et al., 2019; Ashurko et al., 2022a]. В настоящее время наряду с ССТ широко используются его заменители – ксеногенные коллагеновые матриксы [Suárez-López Del Amo et al., 2019; Baldi et al., 2020; Ashurko et al., 2022a]. Применение КМ изучалось в различных клинических ситуациях, в частности при имплантации в эстетически значимых зонах, а также при устранении одиночных или множественных рецессий [Tonetti et al., 2018; Sanz-Martín et al., 2019]. Механизмом действия КМ является стабилизация кровяного сгустка, образование каркаса для дальнейшей адгезии клеток, которые в дальнейшем образуют новую соединительную ткань [Caballé-Serrano et al., 2020; Toledano et al., 2020a].
Существует ограниченное число исследований, в которых проводилась гистологическая и морфометрическая оценка тканей, полученных в результате аугментации тем или иным способом. В нашем исследовании мы использовали коллагеновый матрикс Fibro-Gide (Geistlich Pharma AG, Wolhusen, Switzerland) – объемностабильный рассасывающийся матрикс свиного происхождения с поперечно-сшитой структурой. Коллагеновый матрикс Fibro-Gide был протестирован на экспериментальных моделях, демонстрируя хороший уровень биосовместимости, проникновения фибробластов и сосудистых элементов и без значительной воспалительной реакции [Thoma et al., 2014; Zeltner et al., 2017; Angelis De et al., 2021].
По результатам нашего исследования в обеих группах слизистая оболочка биоптатов была выстлана многослойным плоским эпителием с выраженным акантозом. Собственно слизистая оболочка была отграничена от эпителия базальной мембраной. Под ней располагается сосочковый, а затем сетчатый слой с более плотными и компактно расположенными коллагеновыми волокнами. Не было выявлено статистически значимой разницы по толщине слоев. Все эти данные сопоставимы с раннее полученными результатами гистологического анализа Ашурко и соавт. [Ashurko et al., 2022a; Ashurko et al., 2022b], а также данными зарубежных авторов [Schmitt et al., 2019; Angelis De et al., 2021], хотя данные авторы проводили исследование с использованием классического двухслойного матрикса. Thoma и соавт. проводили исследование с использованием ССТ и КМ с поперечно-сшитой структурой. В группе ССТ они не наблюдали различий между трасплантированной тканью и покрывным лоскутом, васкуляризация наблюдалась во всех образцах с относительно большим количеством мелких кровеносных сосудов [Thoma et al., 2016]. По нашим данным, в группе ССТ глубже рубцового слоя видна ткань с явлениями дистрофии, склероза и наличием сосудов с облитерированным просветом. По-видимому, эта ткань является тканью пересаженного аутотрансплантата, в которой собственные сосуды трансплантата подвергаются облитерации просвета, однако прорастают новые сосуды, благодаря чему некроза не происходит, а есть только небольшие участки дистрофии. Всё это свидетельствует о приживлении аутотрансплантата.
Ранее Lima и соавт. сообщали, что при культивировании фибробластов десны человека на коллагеновом матриксе in vitro они продемонстрировали высокую степень пролиферации и жизнеспособности [Lima et al., 2015]. В нашей работе мы также обнаружили очаги пролиферации фибробластов в сосочковом слое соединительнотканной основы. В работе Hélio и соавт. при исследовании соединительнотканного трансплантата и коллагенового матрикса через 3 месяца после аугментации не было выявлено статистически значимой разницы в количестве фибробластов на единицу площади, также не было отмечено признаков воспаления, а коллагеновый матрикс продемонстрировал полную резорбцию и замену его здоровой соединительной тканью [Hélio et al., 2019]. Song и соавт. проводили исследование на собаках in vivo, в котором сообщается, что коллагеновый матрикс бычьего происхождения способствовал увеличению толщины мягких тканей и показал полное замещение материала через 3 месяца после операции. Также по результатам этого гистологического анализа было отмечено наличие более длинных эпителиальных гребней, что соответствует нашим результатам [Song et al., 2019]. Данные показатели полностью сопоставимы с работой Artzi и соавт., где пациентам проводили увеличение толщины мягких тканей при помощи коллагенового матрикса Fibro-Gide (Geistlich Pharma AG, Wolhusen, Switzerland) [Artzi et al., 2022]. По срокам замещения ксенотрансплантата и наличию признаков воспаления наше исследование не согласуется с вышеописанными результатами. Так, по данным гистологического анализа, в группе КМ все еще протекает резорбция трансплантата и постепенно происходит замещение собственной соединительной тканью через 3 месяца наблюдения. Наблюдается условное увеличение толщины соединительнотканной основы за счет коллагенового матрикса. Однако со временем КМ может полностью резорбироваться и уплотниться из-за формирующегося рубца и, соответственно, тогда толщина мягких тканей десны уменьшится. Стоит отметить, что в отдельных образцах наблюдались крупные очаги воспалительной инфильтрации. При этом в группе КМ по сравнению с ССТ выше воспалительная инфильтрация в эпителиальном слое на 44,5 % и в собственно слизистой оболочке на 22,9 %.
Результаты гистоморфометрического исследования тканей, полученных в результате использования коллагенового матрикса с поперечно-сшитой структурой, свидетельствуют о возможности его применения для формирования мягких тканей в области дентальных имплантатов. При этом коллагеновый матрикс не уступает аутотрансплантам в вопросе увеличения толщины мягких тканей, однако требуется проведение дополнительных исследований для получения более отдаленных результатов его использования.





Список литературы
Ашурко И.П. и др. 2022. Оценка клинической эффективности применения свободного соединительнотканного трансплантата и коллагенового матрикса для увеличения толщины мягких тканей в области дентальных имплантатов. Пародонтология. Т. 27. № 2. С. 117–125. doi.10.33925/1683-3759-2022-27-2-117-125
Тарасенко С.В., Загорский С.В. 2019. Клинические результаты сравнительного анализа современных методов контурной пластики десны при дентальной имплантации // Клиническая стоматология. № 2. С. 46–49. doi.10.37988/1811-153X_2019_2_46
Angelis P. De et al. 2021. Clinical comparison of a xenogeneic collagen matrix versus subepithelial autogenous connective tissue graft for augmentation of soft tissue around implants // Int. J. Oral. Maxillofac. Surg. Т. 50. № 7. С. 956–963. https://doi.org/10.1016/j.ijom.2020.11.014
Artzi Z. et al. 2022. Histologic composition of marginal mucosal tissue augmented by a resorbable volume-stable collagen matrix in soft tissue thickening procedures in humans: a morphometric observational study // Clin. Oral. Investig. Т. 26. № 1. С. 427–435. https://doi.org/10.1007/s00784-021-04016-1
Ashurko I. et al. 2022a. Connective tissue graft versus xenogeneic collagen matrix for soft tissue augmentation at implant sites: a randomized-controlled clinical trial // Clin. Oral. Investig. Т. 26. № 12. С. 7191–7208. https://doi.org/10.1007/s00784-022-04680-x
Ashurko I.P. et al. 2022b. Comparative histomorphometric analysis of peri-implant soft tissue formed after the augmentation with connective tissue graft and collagen matrix // Rossiiskaya stomatologiya. Т. 15. № 2. С. 22. https://doi.org/10.17116/rosstomat20221502122
Avila-Ortiz G. et al. 2020. The peri-implant phenotype // Journal of Periodontology, 91 (3). С. 283–288.
Baldi N. et al. 2020. Xenogeneic dermal matrix versus autologous connective tissue graft versus no graft at abutment connection for improving aesthetics: 6-month outcomes of a randomised controlled trial // Clinical Trials in Dentistry. Т. 02. № 02. С. 49. https://doi.org/10.36130/CTD.03.2020.05
Caballé-Serrano J. et al. 2020. Tissue Integration and Degradation of a Porous Collagen-Based Scaffold Used for Soft Tissue Augmentation // Materials. Т. 13. № 10. С. 2420. https://doi.org/10.3390/ma13102420
Cairo F. et al. 2019. Surgical procedures for soft tissue augmentation at implant sites. A systematic review and meta-analysis of randomized controlled trials // Clin. Implant. Dent. Relat. Res. С. 1262–1270.
Cosyn J. et al. 2021. A multi-centre randomized controlled trial comparing connective tissue graft with collagen matrix to increase soft tissue thickness at the buccal aspect of single implants: 3-month results // J. Clin. Periodontol. Т. 48. № 12. С. 1502–1515. https://doi.org/10.1111/jcpe.13560
Gargallo-Albiol J. et al. 2019. Efficacy of Xenogeneic Collagen Matrix to Augment Peri-implant Soft Tissue Thickness Compared with Autogenous Connective Tissue Graft: A Systematic Review and Meta-Analysis // Int. J. Oral. Maxillofac. Implants. Т. 34. № 5. С. 1059–1069. https://doi.org/10.11607/jomi.7497
Hélio M. et al. 2019. Peri-implant soft tissue augmentation with palate subepitelial connective tissue graft compared to porcine collagen matrix: A randomized controlled clinical study and histomorphometric analysis // ~ 319 ~ International Journal of Applied Dental Sciences. Т. 5. № 3. С. 319–325.
Lee I. K. et al. 2021. The effect of three surgical therapies to increase keratinized mucosa surrounding dental implants with peri-implantitis: A pilot study // Medicina (Lithuania). Т. 57. № 10. https://doi.org/10.3390/medicina57101093
Lima R. S. R. et al. 2015. Evaluation of the Biological Behavior of Mucograft® in Human Gingival Fibroblasts: An In Vitro Study // Braz. Dent. J. Т. 26. № 6. С. 602–606. https://doi.org/10.1590/0103-6440201300238
Puisys A. et al. 2019. Clinical and Histologic Evaluations of Porcine-Derived Collagen Matrix Membrane Used for Vertical Soft Tissue Augmentation: A Case Series. // Int. J. Periodontics Restorative Dent. С. 341–347.
Rojo E. et al. 2018. Soft tissue volume gain around dental implants using autogenous subepithelial connective tissue grafts harvested from the lateral palate or tuberosity area. A randomized controlled clinical study // J. Clin. Periodontol. Т. 45. № 4. С. 495–503. https://doi.org/10.1111/jcpe.12869
Sanz-Martín I. et al. 2019. Soft tissue augmentation at immediate implants using a novel xenogeneic collagen matrix in conjunction with immediate provisional restorations: A prospective case series // Clin. Implant Dent. Relat. Res. Т. 21. № 1. С. 145–153. https://doi.org/10.1111/cid.12696
Schmitt C.M. et al. 2019. Gingiva thickening with a porcine collagen matrix in a preclinical dog model: Histological outcomes // J. Clin. Periodontol. Т. 46. № 12. С. 1273–1281. https://doi.org/10.1111/jcpe.13196
Song Y.W. et al. 2019. Soft tissue substitutes to increase gingival thickness: Histologic and volumetric analyses in dogs // J. Clin. Periodontol. Т. 46. № 1. С. 96–104. https://doi.org/10.1111/jcpe.13034
Suárez-López Del Amo F. et al. 2019. Comparison of two soft tissue substitutes for the treatment of gingival recession defects: an animal histological study // Journal of Applied Oral Science. Т. 27. https://doi.org/10.1590/1678-7757-2018-0584
Testori T. et al. 2018. Implant placement in the esthetic area: criteria for positioning single and multiple implants // Periodontol 2000. С. 176–196.
Thoma D.S. et al. 2014. Efficacy of soft tissue augmentation around dental implants and in partially edentulous areas: a systematic review // J. Clin. Periodontol. Т. 41. С. S77–S91. https://doi.org/10.1111/jcpe.12220
Thoma D.S. et al. 2016. Randomized controlled clinical study evaluating effec- tiveness and safety of a volume-stable collagen matrix compared to autogenous connective tissue grafts for soft tissue augmentation at implant sites // Journal of Clinical Periodontology, 43 (10). С. 874–885.
Toledano M. et al. 2020a. Differential Biodegradation Kinetics of Collagen Membranes for Bone Regeneration // Polymers (Basel). Т. 12. № 6. С. 1290. https://doi.org/10.3390/polym12061290
Toledano M. et al. 2020b. State of the art on biomaterials for soft tissue augmentation in the oral cavity. Part I: Natural polymers-based biomaterials // Polymers (Basel). Т. 12. № 8. https://doi.org/10.3390/POLYM12081850
Tonetti M.S. et al. 2018. Xenogenic collagen matrix or autologous connective tissue graft as adjunct to coronally advanced flaps for coverage of multiple adjacent gingival recession: Randomized trial assessing non-inferiority in root coverage and superiority in oral health-related // J. Clin. Periodontol. Т. 45. № 1. С. 78–88. https://doi.org/10.1111/jcpe.12834
Zeltner M. et al. 2017. Randomized controlled clinical study comparing a volume-stable collagen matrix to autogenous connective tissue grafts for soft tissue augmentation at implant sites: linear volumetric soft tissue changes up to 3 months // J. Clin. Periodontol. Т. 44. № 4. С. 446–453. https://doi.org/10.1111/jcpe.12697
Zuiderveld E.G. et al. 2018. The influence of different soft-tissue grafting procedures at single implant placement on esthetics: A randomized controlled trial // J. Periodontol. Т. 89. № 8. С. 903–914. https://doi.org/10.1002/JPER.18-0061