Анализ уровня свободно циркулирующей ДНК и переносимости физической нагрузки у пациентов с хронической сердечной недостаточностью
Aннотация
Целью данного исследования стало изучение уровня свободно циркулирующей ДНК (сцДНК) в крови у больных хронической сердечной недостаточностью (ХСН) в зависимости от содержания мозгового натрийуретического пропептида (NT-proBNP), функционального класса (ФК) и оценки качества жизни согласно Миннесотскому опроснику (MHFLQ). Было обследовано 90 человек обоего пола, из которых 67 страдали ХСН и 23 являлись практически здоровыми, не предъявляющими каких-либо жалоб на момент исследования. У пациентов отслеживали показатели липидного профиля, глюкозы, креатинина, уровня NT-proBNP в крови, проводили ЭКГ и эхокардиографию (ЭХО-КГ). Для клинической оценки функционального состояния сердечно-сосудистой системы (ССС) у больных проводился тест 6-минутной ходьбы (Т6МХ). Самостоятельная оценка пациентами своего клинико-функционального состояния проводилась путем заполнения Минесотского опросника. Уровень сцДНК определяли по методу Лактионова П.П., Тамкович С.Н., Рыковой Е.Ю., 2005 г. Согласно полученным данным, анализ объективного (по результатам Т6МХ) и субъективного (балл MHFLQ) состояния пациентов с ХСН обнаруживает прямую зависимость между данными показателями, а именно снижение переносимости физической нагрузки сопровождается ухудшением качества жизни. Установлена обратная зависимость уровней сцДНК и NT-proBNP в крови с переносимостью физической нагрузки. Выявлено характерное ухудшение лабораторных показателей у больных ХСН на фоне снижения функциональных возможностей ССС. Исходя из этого, представляется возможным определение уровня сцДНК в крови пациента с ХСН в качестве одного из маркеров степени тяжести состояния. Учитывая высокую актуальность проблемы сердечной недостаточности, поиск новых биомаркеров для оценки прогноза этого заболевания остается важным и требует дальнейшего изучения.
Ключевые слова: свободно циркулирующая ДНК, хроническая сердечная недостаточность, функциональный класс, мозговой натрийуретический пропептид, физическая нагрузка, сердечно-сосудистые заболевания
Хроническая сердечная недостаточность (ХСН) является актуальной медико-социальной проблемой, что обусловлено ее тяжелым течением, частыми госпитализациями, высоким уровнем инвалидизации и смертности [Агеев, 2006; Мареев, 2018]. Распространенность ХСН продолжает увеличиваться с каждым годом, что во многом связано с неадекватной терапией заболеваний, являющихся причинами развития ХСН: артериальной гипертензией (АГ) и ишемической болезнью сердца (ИБС) [De Boer et al., 2018; Tsao et al., 2018].
В настоящее время основной стратегический подход эффективного лечения пациентов с ХСН и соответственно улучшения качества их жизни заключается в выявлении заболевания на ранних стадиях. Для этого проводится поиск новых биомаркеров ХСН [Кожевникова, Беленков, 2021]. Так, в ряде исследований показана значимая роль экспрессии свободно циркулирующей ДНК (сцДНК) при патологии сердечно-сосудистой системы (ССС) [Алиева и др., 2022; Трофимова и др., 2022]. Однако основным лабораторным маркером ХСН остается уровень мозгового натрийуретического пропептида (NT-proBNP) [Агеев и др., 2020$ Mueller et al., 2019].
Важным моментом в определении тактики лечения и прогноза заболевания является клинико-функциональное состояние пациента. Существуют методы самоконтроля состояния, предполагающие заполнение пациентом различных опросников и дающие врачу своевременную информацию о субъективном статусе больного [Бондарчук и др., 2020], а также формы объективного контроля, выполняемые под наблюдением медицинского персонала с целью определения степени функционального нарушения ССС.
Основным методом, используемым в практике для определения переносимости физической нагрузки пациентом с ХСН, является тест 6-минутной ходьбы (Т6МХ) [Toukhsati et al., 2019; Dasari et al., 2020]. Методика проведения данного исследования проста и не требует специальной подготовки и оборудования, что позволяет выполнять его в амбулаторных условиях.
Для самостоятельной оценки качества жизни больных с сердечной недостаточностью наибольшее распространение получил Миннесотский опросник (MHFLQ) [Rector et al., 1987]. Он включает в себя 21 вопрос, наиболее полно охватывающий физическое и эмоциональное состояние пациента, и в настоящее время является условным «золотым стандартом» с доказанной высокой валидностью, чувствительностью и воспроизводимостью в многочисленных исследованиях [Mannheimer et al., 2007].
Таким образом, целью данного исследования стало изучение уровня сцДНК в крови у больных ХСН в зависимости от содержания NT-proBNP, ФК и оценки качества жизни согласно MHFLQ.
Было обследовано 90 человек обоего пола. Из них 67 лиц в возрасте от 54 до 80 лет страдали ХСН и 23 практически здоровых, не предъявляющих каких-либо жалоб на момент исследования, в возрасте от 18 до 45 лет (Контроль).
Критериями включения в исследование являлись: подписанное информированное добровольное согласие пациента на участие в исследовании, возраст от 50 до 80 лет, пациенты с установленным диагнозом ХСН.
Критериями исключения были: злокачественное новообразование вне зависимости от стадии и локализации, включая наличие в анамнезе, ХСН IV ФК по Нью-Йоркской классификации (NYHA), ХСН III стадии по классификации Н.Д. Стражеско и В.Х.Василенко, ожирение 2 и более степени (ИМТ более 35 кг/м2), дефицит массы тела (ИМТ менее 18,5 кг/м2), наличие острого нарушения мозгового кровообращения (ОНМК) или транзиторной ишемической атаки (ТИА) в анамнезе давностью менее 6 месяцев, хроническая болезнь почек (ХБП) С3Б стадии и более, заболевания иммунной системы, любое хроническое заболевание в стадии обострения.
Для клинической оценки функционального состояния ССС у больных проводился тест 6-минутной ходьбы [Toukhsati et al., 2019]. Результатом теста являлось определение функционального класса ХСН в зависимости от пройденной пациентом дистанции (табл. 1).
Таблица 1
Table 1
Интерпретация результатов теста 6-минутной ходьбы
Interpreting 6-Minute Walk Test Results
Функциональный класс ХСН | Дистанция (метры) |
Нет ХСН | >551 |
I | 426-550 |
II | 301-425 |
III | 151-300 |
IV | <150 |
Самостоятельная оценка пациентами своего клинико-функционального состояния проводилась путем заполнения Минесотского опросника [Rector et al., 1987]. Для ответа на каждый вопрос предусмотрены баллы от 0 до 5, соответствующие выраженности нарушений. Максимальный балл – 105 отражает худшее качество жизни (табл. 2).
Таблица 2
Table 2
Миннесотский опросник качества жизни у больных с ХСН (MLHFO)
Minnesota Quality of Life Questionnaire in Patients with CHF (MLHFO)
Мешала ли Вам сердечная недостаточность жить так, как хотелось бы в течение последнего месяца из-за:
Вопрос | Балл |
отеков голеней, стоп? | 0, 1, 2, 3, 4, 5 |
необходимости отдыхать днем? | 0, 1, 2, 3, 4, 5 |
трудности подъема по лестнице? | 0, 1, 2, 3, 4, 5 |
трудности работать по дому? | 0, 1, 2, 3, 4, 5 |
трудности с поездками вне дома? | 0, 1, 2, 3, 4, 5 |
нарушение ночного сна? | 0, 1, 2, 3, 4, 5 |
трудности общения с друзьями? | 0, 1, 2, 3, 4, 5 |
снижения заработка? | 0, 1, 2, 3, 4, 5 |
невозможности заниматься спортом, хобби? | 0, 1, 2, 3, 4, 5 |
снижения сексуальной активности? | 0, 1, 2, 3, 4, 5 |
ограничений в диете? | 0, 1, 2, 3, 4, 5 |
чувства нехватки воздуха? | 0, 1, 2, 3, 4, 5 |
необходимости лежать в больнице? | 0, 1, 2, 3, 4, 5 |
чувства слабости, вялости? | 0, 1, 2, 3, 4, 5 |
необходимости платить? | 0, 1, 2, 3, 4, 5 |
побочного действия лекарств? | 0, 1, 2, 3, 4, 5 |
ощущения себя обузой для родных? | 0, 1, 2, 3, 4, 5 |
чувства потери контроля? | 0, 1, 2, 3, 4, 5 |
чувства беспокойства? | 0, 1, 2, 3, 4, 5 |
чувства депрессии? | 0, 1, 2, 3, 4, 5 |
потери способности концентрировать внимание и проблем памяти? | 0, 1, 2, 3, 4, 5 |
Варианты ответов: 0 - нет; 1 - очень мало; ...5 - очень много
Всем пациентам определялся уровень NT-proBNP в крови методом иммуноферментного анализа с использованием набора реактивов NT-proBNP-ИФА-БЕСТ (Вектор-Бест, Россия).
Определение концентрации ДНК в сыворотке крови проводили по методу П.П. Лактионова, С.Н. Тамкович, Е.Ю. Рыковой:
1) к 500 мкл исследуемой сыворотки добавляли 500 мкл раствора, содержащего 3 мг микшированного мелкодисперсного стекла (ММС) с 40 мМ этилендиаминтетрауксусной кислотой (ЭДТА) в 10 мМ буфере трис HCL, pH =6,4;
2) смесь инкубировали на качалке 5 минут, затем центрифугировали 10 сек при 1000 об/мин. Надосадок удаляли. Осадок стекла дважды промывали буферным раствором, содержащим 4,5 мМ гуанидина тиоцианат (AppliChem) с 20 мМ ЭДТА в 10 мМ трис HCL буфере, pH = 6,4. Стекло отделяли центрифугированием при 1000 об/мин 10 секунд. Надосадок удаляли;
3) осадок стекла дважды промывали 25 % изопропанолом с 100 мМ NaCL в 10 мМ HCL, pH = 8. Стекло отделяли центрифугированием при 1000 об/мин 10 секунд. Надосадок удаляли декантацией;
4) ДНК с ММС выделяли элюированием 1 мл 5мМ NaHCO3, pH = 8 в течение 2 минут, затем центрифугированием при 10 000 об/мин. Надосадок нейтрализовали 0,5 мл 40 мМ буфером трис HCL, pH = 7,1;
5) далее добавляли 75 мкл DAPI (1 мкг в 1 мл в буфере Маклавейна, pH = 6,8), измеряли флуоресценцию на спектрофлуориметре Spekol (длина волны возбуждения 360 нм, волны испускания – 480 нм). Измеряли процент возбуждения. Калибровочная кривая строилась с использованием стандартного раствора фрагментированной ДНК тимуса теленка (Sigma-Albrich) от 20 до 500 мг.
Полученные данные анализировали с помощью программ Microsoft Office Excel (2007) и Statistica SPSS 17. Данные представлены как среднеарифметическое значение и ошибка среднего (М±m). Различия считали статистически значимыми при уровне значимости p < 0,05.
Все пациенты по итогам теста 6-минутной ходьбы были распределены на три функциональных класса (рис. 1).
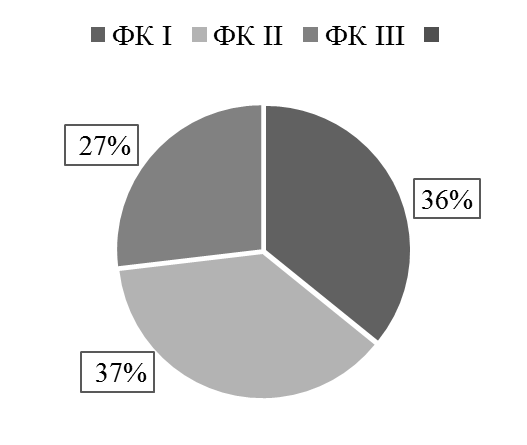
Рис. 1. Распределение больных ХСН по ФК
Fig. 1. Distribution of patients with CHF by FC
Полученные данные свидетельствуют о преобладании пациентов с ФК I и ФК II. ФК III представлен наименьшим числом больных.
По результатам MHFLQ рассчитана оценка качества жизни у больных ХСН в зависимости от функционального класса (табл. 3).
Таблица 3
Table 3
Оценка качества жизни у больных ХСН согласно Миннесотского опросника
Assessment of the quality of life in patients with CHF according to the Minnesota Questionnaire
Функциональный класс | Балл MHFLQ |
I | 22,3 ± 0,3 |
II | 51,5 ± 0,34* |
III | 75,4 ± 0,41* |
Примечание: * – различия статистически значимы по сравнению с группой ФК I при p < 0,05.
Согласно полученным данным, анализ объективного (по результатам Т6МХ) и субъективного (балл MHFLQ) состояния пациентов с ХСН обнаруживает прямую зависимость между данными показателями, а именно снижение переносимости физической нагрузки сопровождается ухудшением качества жизни.
Уровни сцДНК и NT-proBNP у больных ХСН в зависимости от ФК представлены на рис. 2 и 3.
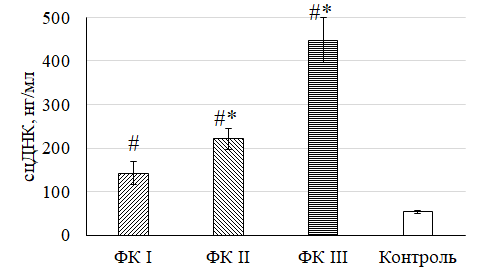
Рис. 2. Уровень сцДНК у больных ХСН в зависимости от ФК
Fig. 2. The level of fcDNA in patients with CHF depending on FC
Примечание: * – различия статистически значимы по сравнению с группой ФК I при p < 0,05; # – различия статистически значимы по сравнению с контрольной группой при p < 0,05.
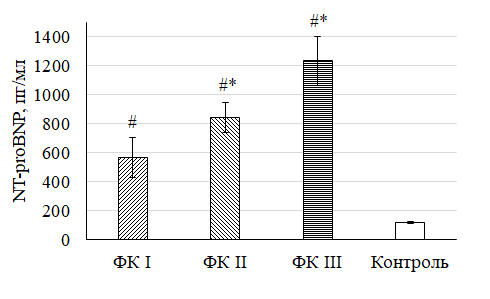
Рис. 3. Уровень NT-proBNP у больных ХСН в зависимости от ФК
Fig. 3. Level of NT-proBNP in patients with CHF depending on FC
Примечание: * – различия статистически значимы по сравнению с группой ФК I при p < 0,05;
# – различия статистически значимы по сравнению с контрольной группой при p < 0,05.
При оценке уровня сцДНК в крови у больных ХСН выявлено, что исследуемый показатель в группе ФК III в 2 раза выше значения в группе ФК II, в 3,2 раза выше значения в группе ФК I и в 8,3 раза выше аналогичного показателя в группе контроля. Это свидетельствует о достоверном повышении уровня сцДНК относительно контрольной группы (p < 0,05). Изменения уровня сцДНК также достоверно значимы во всех группах ФК относительно друг друга (p < 0,05).
Аналогичная оценка проведена для уровня NT-proBNP во всех исследуемых группах. Уровень NT-proBNP в группе ФК III максимальный и превышает уровень в группе ФК II в 1,5 раза, в группе ФК I – в 2 раза.
Полученные результаты позволяют сделать вывод о наличии обратной зависимости между показателем уровня сцДНК и ФК, а именно прогрессирующее снижение функциональных возможностей ССС, выявленное при проведении теста 6-минутной ходьбы, сопровождается увеличением количества сцДНК в крови пациента. Кроме того, аналогичная закономерность присутствует и в случае с уровнем NT-proBNP в крови, то есть наличие более высокого ФК сопровождается одновременным увеличением обоих лабораторных показателей.
Как упоминалось ранее, тест 6-минутной ходьбы – это простой и доступный метод оценки тяжести состояния пациента с ХСН. Пройденная пациентом дистанция – необходимый показатель для динамического наблюдения за функциональным состоянием сердечно-сосудистой системы. В представленной группе пациентов максимальное число больных относится к ФК II. Это согласуется с данными одного из наиболее масштабных исследований по изучению проблемы ХСН в Российской Федерации – ЭПОХА-Госпиталь-ХСН, 2003–2005. При распределении всех госпитализированных пациентов с ХСН по результатам теста
6-минутной ходьбы наибольшее количество составил ФК II (47,4 %).
Основным источником секреции NT-proBNP являются кардиомиоциты преимущественно левого желудочка. Его патофизиологические эффекты направлены на ослабление системной и почечной вазоконстрикции, уменьшение объема внеклеточной жидкости, снижение пред- и постнагрузки на сердце, уменьшение склеротических процессов в ССС и почках [Алиева и др., 2018; Califf, 2018].
Как правило, физическое состояние пациента коррелирует с лабораторными показателями, в частности повышение основного маркера ХСН NT-proBNP сопровождается снижением толерантности к нагрузкам [Михеева и др., 2018]. Причем увеличение уровня NT-proBNP в крови отмечается не только у пациентов с ФК III–IV, но и с ФК I [Karabulut et al., 2005].
В то же время существует отдельная категория пациентов, у которых данная закономерность отсутствует. При наличии высокого уровня лабораторных маркеров ХСН функциональное состояние ССС не страдает в силу приема оптимальной медикаментозной терапии или хороших компенсаторных возможностей организма. В такой ситуации множество исследований показывают необходимость «лабораторно-ориентированного подхода», то есть максимальное снижение значений биомаркеров с целью предотвращения декомпенсаций ХСН и госпитализаций, а не только достижение клинического благополучия [Troughton et al., 2000; Cunningham et al., 2020].
Все больше внимания в настоящее время уделяется поиску новых лабораторных маркеров для диагностики ХСН [Bayés-Genis et al., 2018; Chen et al., 2019]. Ряд работ посвящен изучению уровня сцДНК в крови пациентов с различными сердечно-сосудистыми заболеваниями [Алиева и др., 2022; Трофимова и др., 2022; Devaux, 2020; Polina et al., 2020]. СцДНК представляет собой фрагментированную нуклеиновую кислоту, которая свободно циркулирует в биологических жидкостях: крови, моче, слюне, спинномозговой жидкости [Devaux, 2020]. Известно, что в физиологических условиях ее уровень может увеличиваться при физических нагрузках и у пожилых лиц [Haller et al., 2018; Polina et al., 2020]. Однако большой интерес представляет изучение концентрации сцДНК в крови пациентов с кардиоваскулярной патологией. При заболеваниях сердечно-сосудистой системы основной механизм повышения уровня сцДНК в крови – гибель кардиомиоцитов (апоптоз или некроз) с последующим выходом сцДНК в кровоток, причем возможно дифференцировать тот или иной вид гибели клеток, в зависимости от размера сцДНК [Zemmour et al., 2018]. Так, ДНК, высвобождаемая при запрограммированной гибели клеток, состоит из мелких фрагментов и включает 180–200 пар нуклеотидов (п. н.) [Devaux, 2020; Polina et al., 2020]. В случае некроза обнаруживается высокомолекулярная ДНК, состоящая примерно из 10 000 п. н. [Sherwood, Weimer, 2018]. Имеющиеся на сегодняшний день данные по уровню сцДНК при сердечно-сосудистой патологии немногочисленны и преимущественно отражают ее концентрацию при АГ и ИБС [Трофимова и др., 2022; Xie et al., 2018]. Кроме того, также ограниченно число исследований на предмет взаимосвязи уровня сцДНК и других доказанных маркеров сердечно-сосудистой патологии (тропонины, NT-proBNP, креатинфосфокиназа-МВ) [Xie et al., 2018]. Таким образом, изучение концентрации сцДНК у пациентов с ХСН, а также выявление закономерностей изменения ее уровня и других показателей, в частности, NT-proBNP, является перспективным направлением, основная цель которого – повышение диагностической точности лабораторных методов исследования.
В проведенном исследовании выявлено характерное увеличение исследованных лабораторных показателей у больных ХСН на фоне снижения функциональных возможностей ССС. Было определено среднее значение сцДНК для каждого функционального класса: в ФК I оно составило 141,9 ± 26,3 нг/мл, во ФК II – 221,1 ± 24,8 нг/мл, в ФК III – 447,7 ± 51,7 нг/мл. Кроме того, аналогичный анализ был проведен с уровнем NT-proBNP в каждом ФК. Так, среднее значение в ФК I составило 565,5 ± 138,02 пг/мл, в ФК II – 841,24 ± 103,3 пг/мл, в ФК III – 1233,3 ± 168,9 пг/мл. Полученные данные свидетельствуют об обратной зависимости между клиническими и лабораторными показателями пациента: снижение толерантности к физической нагрузке сопровождается ростом уровня исследуемых биомаркеров. При этом диагностическая и прогностическая роль NT-proBNP у пациентов с ХСН определена давно. Однако в силу отсутствия у данного показателя абсолютной специфичности продолжается поиск новых биомаркеров. Исходя из полученных результатов, представляется возможным определение уровня сцДНК в крови пациента с ХСН в качестве одного из маркеров степени тяжести состояния. Учитывая высокую актуальность проблемы сердечной недостаточности, поиск новых биомаркеров для оценки прогноза этого заболевания остается важным и требует дальнейшего изучения.





Список литературы
Агеев Ф.Т., Фомин И.В., Беленков Ю.Н., Мареев В.Ю., Бадин Ю.М., Галявич А.С. и др. 2006. Распространенность хронической сердечной недостаточности в Европейской части Российской Федерации – данные ЭПОХА–ХСН. Сердечная Недостаточность, 7 (1): 4–7.
Алиева А.М., Теплова Н.В., Кисляков В.А. и др. 2022. Внеклеточная ДНК и сердечно-сосудистые заболевания. Российский медицинский журнал, 5: 26–29.
Алиева А.М., Резник Е.В., Гасанова Э.Т., Жбанов И.В., Никитин И.Г. 2018. Клиническое значение определения биомаркеров крови у больных с хронической сердечной недостаточностью. Архивъ внутренней медицины, 8 (5): 333–345. doi: 10.20514/2226-6704-2018-8-5-333-345
Бондарчук С.В., Ионова Т.И., Один В.И., Поляков А.С., Ковалев А.В. 2020. Принципы и методы исследования качества жизни в медицине: учебное пособие для врачей-специалистов военно-медицинских организаций. СПб, ВМедА, 102.
Кожевникова М.В., Беленков Ю.Н. 2021. Биомаркеры сердечной недостаточности: настоящее и будущее. Кардиология, 61 (5): 4–16.
Мареев В.Ю., Фомин И.В., Агеев Ф.Т., Беграмбекова Ю.Л., Васюк Ю.А., Гарганеева А.А., Гендлин Г.Е., Глезер М.Г., Готье С.В., Довженко Т.В., Кобалава Ж.Д., Козиолова Н.А., Коротеев А.В., Мареев Ю.В., Овчинников А.Г., Перепеч Н.Б., Тарловская Е.И., Чесникова А.И., Шевченко А.О., Арутюнов Г.П., Беленков Ю.Н., Галявич А.С., Гиляревский С.Р., Драпкина О.М., Дупляков Д.В., Лопатин Ю.М., Ситникова М.Ю., Скибицкий В.В., Шляхто Е.В. 2018. Клинические рекомендации ОССН–РКО–РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология, 58 (6S): 8–158. doi: 10.18087/cardio.2475
Михеева О.О., Домогатский С.П., Ефремов Е.Е., Есипов Р.С. 2018. Молекулярные маркеры диагностики сердечной недостаточности. Кардиологический вестник, 13 (4): 62–67.
Трофимова Е.А., Киреева В.В., Усольцев Ю.К., Кирильчик С.В., Лепехова С.А., Апарцин К.А. 2022. Свободно циркулирующая ДНК у больных артериальной гипертензией с высоким сердечно-сосудистым риском. Российский кардиологический журнал, 27 (4): 4709.
Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал 2020, 25 (11): 4083. doi:10.15829/1560-4071-2020-4083
Bayés-Genis A., Lanfear David E., de Ronde Maurice W.J., Lupón J., Leenders J.J., Liu Zhen, Zuithoff Nicolaas P.A., Eijkemans Marinus J.C., Zamora E., De Antonio Marta, Zwinderman A.H., Pinto-Sietsma Sara-Joan, Pinto Yigal M. 2018. Prognostic value of circulating microRNAs on heart failure-related morbidity and mortality in two large diverse cohorts of general heart failure patients. European Journal of Heart Failure, 20 (1): 67–75. doi: 10.1002/ejhf.984
Califf R.M. 2018. Biomarker definitions and their applications. Experimental Biology and Medicine, 243 (3): 213–221. doi:10.1177/1535370217750088
Chen Y.-T., Wong L.L., Liew O.W., Richards M.A. 2019. Heart Failure with Reduced Ejection Fraction (HFrEF) and Preserved Ejection Fraction (HFpEF): The Diagnostic Value of Circulating MicroRNAs. Cells, 8 (12): 1651. doi: 10.3390/cells8121651
Cunningham J.W., Claggett B., O’Meara E., Prescott M., Pfeffer M. et al. 2020. Effect of Sacubitril/Valsartan on Biomarkers of Extracellular Matrix Regulation in Patients With HFpEF. Journal of the American College of Cardiology, 76 (5): 503–514. doi: 10.1016/j.jacc.2020.05.072
De Boer R.A., Nayor M., Christopher R. et al. 2018. Association of cardiovascular biomarkers with incident heart failure with preserved and reduced ejection fraction. JAMA Cardiol, 3 (3): 215–224. doi:10.1001/jamacardio.2017.4987
Dasari T.W., Patel B., Wayangankar S.A. et al. 2020. Prognostic Value of 6-Minute Walk Distance in Patients Undergoing Percutaneous Coronary Intervention: a Veterans Affairs Prospective Study. Tex Heart Inst. J., 47 (1): 10–14. doi: 10.14503/THIJ-17-6471.
Devaux Y. 2020. Cardiomyocyte-Specific Cell-Free DNA as a Heart Failure Biomarker? Can. J. Cardiol., 36 (6): 807–808.
Haller N., Helmig S., Taenny P., Petry J., Schmidt S., Simon P. 2018. Circulating, cell-free DNA as a marker for exercise load in intermittent sports. PLoS ONE, 13 (1).
Karabulut A., Kaplan A., Aslan C., Iltumur K., Toprak G., Toprak N. 2005. The association between NT-proBNP levels, functional capacity and stage in patients with heart failure. Acta Cardiol., 60 (6): 631–638. doi: 10.2143/ac.60.6.2004936
Mannheimer B., Andersson B., Carlsson L., Währborg P. 2007. The validation of a new quality of life questionnaire for patients with congestive heart failure – an extension of the Cardiac Health Profile. Scand. Cardiovasc. J., 41: 235–241. doi: 10.1080/14017430701422454
Mueller C., McDonald K., de Boer R.A., Maisel A., Cleland J., Kozhuharov N., Coatset A. et al. 2019. Heart Failure Association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentrations. European Journal of Heart Failure, 21 (6): 715–731. doi: 10.1002/ejhf.1494
Polina I.A., Ilatovskaya D.V., DeLeon-Pennell K.Y. 2020. Cell free DNA as a diagnostic and prognostic marker for cardiovascular diseases. Clin. Chim. Acta., 503: 145–150. doi: 10.1016/j.cca.2020.01.013
Rector T.S., Kubo, Cohn J.N. 1987. Patients self-assessment of their congestive heart failure. Part 2: content, reliability and validity of a new measure, the Minnesota living with heart failure questionnaire. Heart failure, 10: 198–209.
Sherwood K., Weimer E.T. 2018. Characteristics, properties, and potential applications of circulating cell-free DNA in clinical diagnostics: a focus on transplantation. J. Immunol. Methods, 463: 27–38. doi: 10.1016/j.jim.2018.09.011
Toukhsati S.R., Mathews S., Sheed A., Freijah I., Moncur L., Cropper P., Ha F.J., Hare D.L. 2019. Confirming a beneficial effect of the six-minute walk test on exercise confidence in patients with heart failure. Eur. J. Cardiovasc. Nurs., 1 (7): 165–71. doi: 10.1177/1474515119876784.
Troughton R., Frampton C.M., Yandle T.G., Espiner E.A., Nicholls M.G., Richards A.M. 2000. Treatment of heart failure guided by plasma aminoterminal brain natriuretic peptide (N-BNP) concentrations. Lancet, 355: 1126–1130. doi: 10.1016/s0140-6736(00)02060-2
Tsao C.W., Lyass A., Enserro D., Larson M.G., Ho J.E., Kizer J.R., Gottdiener J.S., Psaty B.M., Vasan R.S. 2018. Temporal trends in the incidence of and mortality associated with heart failure with preserved and reduced ejection fraction. JACC Heart. Fail, 6: 678–685. doi: 10.1016/j.jchf.2018.03.006
Xie J., Yang J., Hu P. 2018. Correlations of Circulating Cell-Free DNA with Clinical Manifestations in Acute Myocardial Infarction. Am. J. Med. Sci., 356 (2): 121–129. doi: 10.1016/j.amjms.2018.04.007
Zemmour H., Planer D., Magenheim J., Moss J., Neiman D., Gilon D. et al. 2018. Non-invasive detection of human cardiomyocyte death using methylation patterns of circulating DNA. Nat Commun., 9 (1): 1443. doi: 10.1038/s41467-018-03961-y