Стабильность зубных имплантатов с немедленной ортопедической нагрузкой в зависимости от типа кости
Aннотация
Рассматриваются параметры, влияющие на первичную стабильность дентальных имплантатов различного диаметра и длины в зависимости от типа кости для установления взаимосвязи между ними и потерей маргинальной кости. Необходимо было определить, как первичная стабильность влияет на приживаемость имплантатов.В исследовании проанализированы данные 600 примеров одномоментной установки имплантатов с немедленной нагрузкой в кость I–III типов. Для каждого имплантата измеряли магнитно-резонансную частоту колебаний (ISQ) многоразового штифта MulTiPeg при помощи бесконтактной техники, определив коэффициент стабильности в день установки, через два и шесть месяцев. Сравнивая данные коэффициента стабильности, измеренные в течение полугода, рассчитывали потерю маргинальной кости, если разница в величинах превышала 10 единиц. Стабильность имплантатов с высоким первичным значением ISQ снизилась в течение первых 2 месяцев заживления. Особенно это характерно для I типа кости. Однако стабильность имплантатов с низкой первичной стабильностью увеличилась в течение первых шести месяцев. Разность в величинах ISQ и крутящего момента при установке коррелировали с потерей маргинальной кости – максимальная потеря наблюдалась при меньших значениях коэффициента стабильности и динамометрического усилия.
Ключевые слова: коэффициент стабильности, первичная стабильность, дентальные имплантаты, немедленная нагрузка
Введение
Стабильность дентального имплантата – это мера качества фиксации имплантата в альвеолярной кости, она считается основным параметром в имплантологии. Было доказано, что стабильность имплантата влияет на процесс остеоинтеграции, характер нагрузки на имплантат и в конечном итоге на успех имплантации [Li et al., 2019]. Стабильность имплантата можно разделить на измеряемую сразу после имплантации (т. е. первичную стабильность) и наблюдаемую после заживления (т. е. вторичную стабильность). Было доказано, что первичная стабильность имплантата является механическим явлением [Sharma et al., 2021]. С другой стороны, вторичная стабильность возникает в результате каскада биологических событий, таких как регенерация и ремоделирование кости на границе кость – имплантат. На нее влияют многие факторы, включая топографию поверхности имплантата, качество кости и поведение пациента [Silva et al., 2021]. Более ранние исследования показали, что в процессе заживления механическая фиксация имплантата в кости ослабевает, а биологическая стабильность имплантата, наоборот, увеличивается [Monje et al., 2019].
Для определения стабильности имплантата в клинической практике было предложено несколько методов. Среди них наиболее точным был признан частотно-резонансный анализ – RFA [Sharma et al., 2022]. Абсолютные значения RFA не полностью зависят от качества остеоинтеграции. Есть три важных фактора, которые могут непосредственно влиять на RFA: жесткость интерфейса имплантат – кость, жесткость самой кости и жесткость компонентов имплантата [Kittur et al., 2021; Chen et al., 2022; Qi et al., 2022]. Следовательно, клинически измеряемую характеристику стабильности имплантата можно сравнивать при наблюдении за каждым отдельным имплантатом, но следует проявлять осторожность при сравнении этих значений между различными имплантатами как у одного и того же пациента, так и между отдельными пациентами.
Предыдущие исследования показали, что стабильность имплантата снижается в первые недели заживления, затем увеличивается [Villar et al., 2021; Lim et al., 2022]. Это связано с биологической реакцией кости на хирургическую травму. Во время начальной фазы ремоделирования кость и некротический материал резорбируются под действием остеокластической активности, что отражается в снижении значения ISQ. За этим процессом следует новая костная аппозиция, инициированная остеобластической активностью, т. е. адаптивное ремоделирование кости вокруг имплантата [Ghosh et al., 2022]. Среди исследователей нет согласия относительно точного времени наибольшего снижения стабильности имплантата после установки, зарегистрированные данные варьируются между третьей и восьмой неделями после установки имплантата [Alalharath et al., 2022]. В некоторых исследованиях не наблюдалось никакого снижения стабильности во время фазы заживления [Eshkol‐Yogev et al., 2019]. Причина этих нестыковок в результатах может быть связана с различиями в конструкции используемых имплантатов, особенно в свойствах их поверхности. Зависимость стабильности имплантата от времени без первоначального снижения наблюдалась при быстром увеличении контакта кости с имплантатом, что характерно для обработанных фтором или щелочью (и, следовательно, потенциально биологически активных) поверхностей [Matos et al., 2022]. Ускоренное образование контакта кости с имплантатом способствует более быстрому увеличению вторичной стабильности. Этот биологический процесс устраняет снижение первичной стабильности и обеспечивает постоянство стабильности во времени (без падения в период заживления) [Al-Tarawneh et al., 2022]. Существует ограниченное количество задокументированных данных о взаимосвязи между первичной и вторичной стабильностью [Лепилин и др., 2018; Noaman et al., 2022].
Цель данного исследования – установить параметры, влияющие на первичную стабильность дентальных имплантатов различного диаметра и длины в зависимости от типа кости, выявить связь между ними и потерей маргинальной кости, определить, как первичная стабильность влияет на их приживаемость.
Объекты и методы исследования
Одномоментная имплантация с немедленной нагрузкой и измерение коэффициента стабильности имплантатов.
Рассматривались одномоментно установленные одиночные или множественные объединенные имплантаты (все имплантаты корейского производителя – Osstem TSIII) с немедленной нагрузкой. Создание шаблона по установке имплантата позволяет снизить риски по осложнениям, связанным с травмой важных анатомических образований, сократить время хирургической манипуляции, повысить точность и перенести планируемое положение имплантата, что исключает нежелательные ошибки при протезировании по сравнению с методом «свободного сверла». В дизайн-программе 3Shape происходит совмещение данных компьютерной томографии и цифрового образа сканирования, что дает возможность определить наклон сверления пилотной фрезой и окончательную позицию имплантата в кости. У пациентов, включенных в исследование, отсутствовали любые патологии. Пациенты с метаболическими заболеваниями костей, нестабильным системным состоянием (например, неконтролируемый диабет или нелеченый гипотиреоз), с отягощённым пародантологическим статусом, а также курильщики были исключены. Все хирургические процедуры проводились под местной анестезией в стерильных условиях. Антибиотики назначались на 5 дней. Все имплантаты были установлены в свежие экстракционные лунки. Крутящий момент установки имплантатов измерялся с помощью динамометрического ключа. Тип кости классифицировался по критериям Lekholm и Zarb на основе субъективной оценки хирурга [Rosas-Díaz et al., 2022]. Временную конструкцию моделируют и изготавливают до операции имплантации методом фотополимерной печати в аппарате Formlab.
Первичная стабильность (ISQ1) каждого имплантата измерялась с помощью прибора Penguin. Два опытных хирурга проводили измерения независимо друг от друга. Датчик закреплялся на уровне имплантата перпендикулярно длинной оси альвеолярной кости. Измерения повторялись до тех пор, пока одно и то же значение не было измерено два раза подряд, и это значение записывалось. После этого устанавливалась временная конструкция с винтовой фиксацией. Пациентам были даны инструкции по гигиене полости рта и назначены регулярные контрольные осмотры.
Оттиск для окончательного протеза был сделан после полученных данных коэффициентов стабильности через 2 и 6 месяцев заживления. Измеренные значения записывались и обозначались как ISQ2 и ISQ6. После подтверждения пассивного прилегания конструкции и коррекции окклюзии была изготовлена окончательная конструкция. Цифровая панорамная рентгенограмма (POINT NIX) была получена сразу после фиксации окончательной конструкции в соответствии с рекомендациями производителя и выполнялась одним и тем же техником.
Измерение потери маргинальной кости
Потеря маргинальной кости определялась на всех имплантатах, на которых абсолютное значение разницы между ISQ1 и ISQ2 превышало 10 единиц. Измерение потери кости проводилось независимо друг от друга двумя хирургами на цифровых панорамных рентгенограммах пациента. Уровень костной ткани измерялся от интерфейса имплантат-абатмент до первого видимого контакта кости с имплантатом. В качестве точки отсчета использовался интерфейс имплантат-абатмент, поскольку имплантаты обычно устанавливались с соединением имплантат-абатмент на уровне альвеолярного гребня (рис. 1).
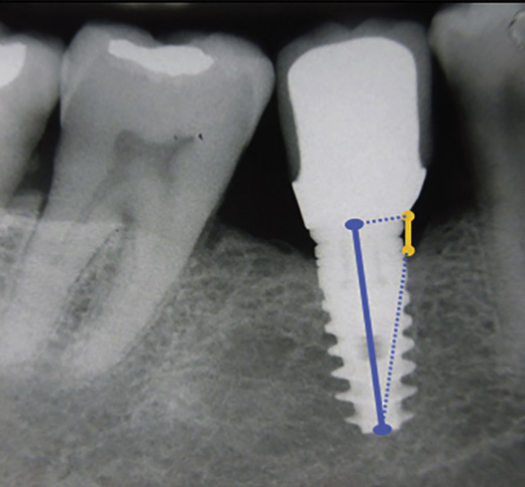
Рис. 1. Способ, используемый для измерения уровня маргинальной кости
Fig. 1. Method used to measure the level of marginal bone
Расстояние между вершинами резьбы (1,0 мм) служило известным стандартом для расчета точной потери костной массы на мезиальной и дистальной сторонах имплантатов. Эти измерения были округлены до ближайших 0,1 мм. С помощью этих данных определялась средняя краевая резорбция кости для каждого имплантата. Однако если рентгенограмма не позволяла точно воспроизвести уровень кости, имплантат исключался из когорты.
Статистический анализ
Разница между первичной стабильностью и стабильностью после 2-месячного заживления обозначалась как ΔISQ1, а между 2 и 6 месяцами – ΔISQ2. Линии линейной регрессии, рассчитанные по зависимости ΔISQ1 и ΔISQ2 от ISQ1, использовались для определения значения коэффициента стабильности сразу после вживления имплантата, при котором ΔISQ достигает нулевого значения. С учетом этого значения пациенты были разделены на две группы: с низкой (ISQ1 < 70) и высокой первичной стабильностью (ISQ1 > 70). Статистический анализ был использован для проверки основной рабочей гипотезы о том, что имплантаты с немедленной нагрузкой и более высокой первичной стабильностью потеряют часть своей стабильности во время заживления, в то время как имплантаты с более низкой первичной стабильностью приобретут стабильность во время заживления.
Кроме того, оценивалась зависимость потери маргинальной кости от ISQ1, от конечного крутящего момента и от ΔISQ1 и ΔISQ2. ISQ1, аналогично конечному крутящему моменту, положительно коррелирует с потерей маргинальной кости, а ΔISQ1 и ΔISQ2 – отрицательно.
Статистический анализ проводился с использованием t-теста Стьюдента, однофакторного дисперсионного анализа и непараметрического коэффициента корреляции Спирмена. Статистическая значимость всех тестов определялась как P < 0.05.
Результаты
В исследовании рассматривались 600 дентальных имплантатов, установленных 250 пациентам (110 мужчин и 140 женщин; средний возраст 44,1 года). Величины коэффициента стабильности имплантатов, установленных в кости трех типов, распределились следующим образом (табл.1).
Таблица 1
Table 1
Распределение имплантатов по группам
Distribution of implants by groups
| ISQ > 70 | ISQ < 70 | ||||||
d=3,5 мм | d=4,5 мм | d=3,5 мм | d=4,5 мм | |||||
l=10мм | l=11,5мм | l=10мм | l=11,5мм | l=10мм | l=11,5мм | l=10мм | l=11,5мм | |
I тип | 110 | 20 | 40 | 15 | 6 | 2 | 5 | 2 |
II тип | 135 | 25 | 40 | 15 | 32 | 10 | 18 | 5 |
III тип | 25 | 6 | 17 | 7 | 28 | 9 | 22 | 6 |
Большинство имплантатов (408 шт. – 68,00 %) имели диаметр 3,5 мм, и только 192 – 4,5 мм (32,00 %). 79,67 % имплантатов имели длину 10 мм (478 шт); 20,33 % (122 шт) – длину 11,5 мм. Остеоинтеграция имплантатов лучше протекала при ISQ > 70, чем при коэффициенте стабильности меньше 70, независимо от их длины. Диаметр имплантата, наоборот, влиял на процесс интеграции – узкие приживались лучше. Независимо от типа кости, при величине ISQ выше 70 все установленные имплантаты прижились успешно.
Что касается типа кости, то 200 (33,34 %) имплантатов были установлены в кость первого типа, 280 (46,67 %) – второго типа, 120 (20,00 %) – третьего типа.
Из общего числа установленных имплантатов девять (ISQ1 от 60 до 71) не остеоинтегрировались у 9 пациентов. Из них 1 имплантат был установлен в кость I типа, 3 – во II тип, 5 – в третий. Коэффициент остеоинтеграции составил 98,5 %.
Средний конечный крутящий момент установки составил 38,3 ± 3,0 Нсм (41 ± 3,0 Нсм для кости первого типа, 37,4 ± 2,5 Нсм для кости второго типа, 34,8 ± 4 Нсм для кости третьего типа). Статистическое сравнение крутящего момента установки имплантата в зависимости от типа кости в месте имплантации показало высокую взаимосвязь (P < 0,001). Значимой корреляции между конечным крутящим моментом и диаметром имплантата обнаружено не было.
На рисунке 2 показано распределение коэффициента стабильности среди исследованных имплантатов (рис. 2).
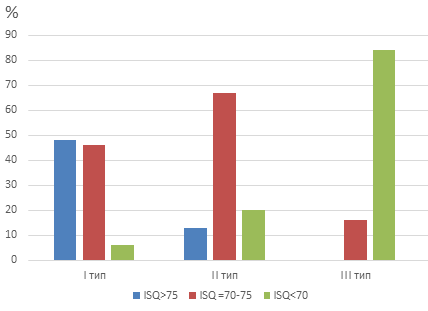
Рис. 2. Распределение (в процентах) величин первичных коэффициентов стабильности имплантатов в зависимости от типа кости
Fig. 2. Distribution (in percent) of the values of the primary stability coefficients of implants depending on the type of bone
Для I типа кости в 94 % случаев значения ISQ1 были выше 70 единиц, для кости II типа эта цифра составила 80 %, а для III типа – всего 16 %. В последнем случае превалировала ISQ1 < 70 (84 %), а случаев с ISQ1 > 75 не было.
Зарегистрированное среднее значение ISQ1 71,0 ± 7,2. Средние значения ISQ1 для каждого типа кости составили 75,2 ± 7,9, 70,3 ± 5,6 и 67,6 ± 7,1 соответственно. Кроме того, статистический анализ опроверг зависимость ISQ1 от длины имплантата: средние значения ISQ1 варьируются в интервале 73,4 ± 5,3 и 72,2 ± 5,0 для имплантатов длиной 10 и 11,5 мм в кости I типа. Такое же незначительное отклонение наблюдалось и для имплантатов в кости II и III типов.
Однако первичная стабильность имплантатов диаметром 4,5 мм была значительно выше, чем у имплантатов диаметром 3,5 мм (ISQ1 74,8 ± 4,7 против 71,0 ± 4,2; P < 0,01). Не было обнаружено значительной корреляции между ISQ1 и конечным крутящим моментом установки (ISQ1 составил 69,0 ± 5,9, 72,3 ± 3,7, 72,1 ± 5,1, 71,9 ± 4,9 и 72,5 ± 5,0 для конечного крутящего момента ≤ 15, 16–25, 26–35, 36–45 и ≥ 45 Нсм соответственно).
По истечении двух и шести месяцев после установки имплантатов были проведены повторные измерения коэффициента стабильности для 300 пациентов, из них 150 имплантатов относились к группе с первичной стабильностью > 70 (только кости I и II типов), а 150 – с коэффициентом стабильности <70 (только кость III типа). В группе с высокой первичной стабильностью наблюдалось незначительное снижение стабильности во время фазы заживления (P <0,001):
– I тип – ISQ1 =77,6 ± 2,6; ISQ2 = 74,1 ± 4,6; ISQ6 = 72,8 ± 3,7;
– II тип – ISQ1 =73,8 ± 3,4; ISQ2 = 71,2 ± 4,3; ISQ6 = 69,5 ± 4,1.
Во второй группе (коcть III типа) с низкой первичной стабильностью наблюдалось увеличение стабильности в период заживления (с ISQ1 = 64,3 ± 4,6 до ISQ2 = 67,1 ± 3,9 до ISQ6 = 70,2 ± 2,8; P <0.001) (рис. 3).
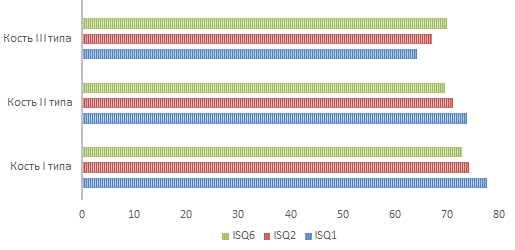
Рис.3. Стабильность имплантатов с течением времени в зависимости от уровня первичной стабильности и типа кости
Fig.3. Stability of implants over time depending on the level of primary stability and bone type
После шести месяцев наблюдения можно констатировать, что величины коэффициента стабильности для всех трех типов кости стали приблизительно одинаковыми.
Потеря маргинальной кости была измерена для 50 имплантатов и составила в среднем 0,9 ± 0,07 мм (диапазон от -1,0 до 2,6 мм). Значения, измеренные на мезиальной стороне имплантата (0,9 ± 0,07 мм; диапазон от -0,9 до 2,9 мм) и на дистальной стороне (0,9 ± 0,07 мм; диапазон от -1,1 до 2,9 мм), существенно не отличались.
Статистически значимая связь между первичной стабильностью и потерей костной массы не была подтверждена (непараметрический коэффициент корреляции Спирмена, R = 0,07). Линейный регрессионный анализ показал, что ΔISQ (т. е. ISQ1 = ISQ2 = ISQ6) достигает нулевого значения при ISQ1, равном 70,1.
Обсуждение
Высокий процент приживаемости имплантатов (98,5 %) подтвердил, что немедленная нагрузка имплантатов в межфораминальной области является жизнеспособной альтернативой классического лечения, основанного на отложенной нагрузке. Первичная стабильность неудачных имплантатов не отличалась значительно от стабильности имплантатов, которые успешно остеоинтегрировались. Поэтому применение частотно-резонансного метода во время установки имплантата не может дать прогноз об отсутствии остеоинтеграции имплантатов, как было описано в [Imme et al., 2021].
В настоящее время тема первичной стабильности является предметом пристального научного интереса. Несколько авторов исследовали взаимосвязь между ISQ1 и другими параметрами, в частности конечным крутящим моментом установки имплантата. Хотя положительная корреляция между ISQ1 и моментом установки изначально может показаться вероятной, авторы не обнаружили значимой взаимосвязи [Balshi et al., 2005]. Результаты настоящего исследования согласуются с вышеупомянутыми исследованиями и не подтверждают единичные случаи противоречивых результатов [Kahraman et al., 2009]. Однако нельзя исключить, что на расхождения в результатах повлияла конструкция имплантата или качество локальной кости. Как было подтверждено и в настоящем исследовании, на первичную стабильность в основном влияет диаметр имплантата, а не его длина [Suzuki et al., 2013; Miri et al., 2017]. В данном исследовании была продемонстрирована высокозначимая связь между конечным крутящим моментом и типом кости. Однако статистической связи между конечным крутящим моментом установки и диаметром имплантата обнаружено не было.
Несколько авторов изучали влияние первичной стабильности на вторичную стабильность во время заживления. Например, авторы предположили, что общее увеличение стабильности во время заживления является распространённым явлением, что представляется спорным [Suzuki et al., 2013]. Несколько групп авторов указали, что изменения в стабильности во время заживления в основном зависят от исходного уровня стабильности имплантата. В работе [Miri et al., 2017] обнаружили, что имплантаты с ISQ1 < 60 увеличили стабильность, в то время как имплантаты с ISQ1 от 60 до 69 снизили стабильность через 8 недель. К концу 12-й недели имплантаты вернулись к исходным значениям стабильности. Имплантаты со значениями ISQ1 > 69 демонстрировали снижение стабильности в течение первых 4 недель, после чего сохраняли стабильность.
В исследовании [West et al., 2007] авторы использовали имплантаты того же типа и разделили их на две группы (ISQ1 < 56 и ISQ1 > 56). В течение первых 16 недель имплантаты из первой группы постоянно поддерживали более низкий ISQ по сравнению с имплантатами из второй группы. После этого различия были статистически незначимы. Стабильность обеих групп оставалась на уровне ISQ, равном 61.
Установлено, что имплантаты с высокой первичной стабильностью теряют часть своей стабильности во время заживления, тогда как имплантаты с низкой первичной стабильностью имеют тенденцию к увеличению своей стабильности [Rues et al., 2021]. Результаты настоящего исследования подтверждают эту теорию. Значительное увеличение стабильности было зарегистрировано для имплантатов с низкой первичной стабильностью (ISQ1 < 68), в то время как имплантаты с высокой первичной стабильностью (ISQ1 > 72) потеряли часть своей стабильности с течением времени. Это подтверждает основную рабочую гипотезу данного исследования. Можно также предположить, что в клинической практике оптимальным является достижение первичной стабильности, соответствующей окончательному значению стабильности остеоинтегрированного имплантата (т. е. ISQ1 = ISQ2 = ISQ6; ΔISQ = 0). В данном исследовании это значение ISQ1 было определено с помощью линейного регрессионного анализа как равное 70,1. Это гипотетическое значение, вероятно, не является общепринятым, а скорее всего, характерно для конкретной системы имплантатов, хирургического протокола или типа кости.
Внутриротовая стандартизированная рентгенограмма часто используется для точного измерения объема потери маргинальной кости. Однако неблагоприятные анатомические условия часто не позволяют использовать этот метод рентгенографии в межфораминальной области нижней челюсти, особенно у пациентов с атрофированной беззубой дугой [Şahin et al., 2002]. Поэтому в аналогичных исследованиях других авторов в качестве альтернативы использовалась панорамная рентгенография. В настоящем исследовании заслуживающий внимания факт увеличения костной массы часто встречался через 6 месяцев после установки имплантата. Подобные результаты были получены и в других исследованиях [Ravidà et al., 2019]. Объяснение можно найти в шейке имплантата, которая имеет миниатюрную резьбу и химически модифицированную поверхность с признаками биоактивности. Также может играть роль функциональная стимуляция кости путем немедленной нагрузки.
Потеря маргинальной кости измерялась сразу после фиксации окончательного протеза, через 6 месяцев после установки имплантата. Потеря костной массы может быть вызвана несколькими факторами, например, хирургической травмой, неадекватным прилеганием временного протеза или перегрузкой имплантатов. Подробный анализ выходит за рамки данного исследования. Выявленное значение 0,9 ± 0,7 мм является приемлемым [Ravidà et al., 2019]. В данном исследовании не было обнаружено взаимосвязи между первичной стабильностью и потерей маргинальной кости.
Однако были подтверждены корреляции между конечным крутящим моментом и потерей костной массы, а также между ΔISQ1, ΔISQ2 и потерей костной массы. Принимая во внимание суть этих результатов и учитывая тот факт, что конечный крутящий момент установки не коррелировал с первичной стабильностью, можно сделать вывод, что следует избегать использования чрезвычайно высокого крутящего момента. С другой стороны, необходимо подчеркнуть, что регрессионный анализ показал слабую зависимость между переменными величинами. Поэтому можно сделать вывод, что на эти взаимосвязи влияют дополнительные факторы, которые не были изучены в ходе анализа.
Выводы
Установлено, что первичная стабильность имплантата зависела от типа кости и его диаметра, но не длины. Не было значимой связи между первичной стабильностью и конечным крутящим моментом установки. Имплантаты с низкой первичной стабильностью, установленные в кость III типа, показали значительное увеличение величины ISQ, в то время как у имплантатов с высокой первичной стабильностью в кости I и II типов наблюдалось снижение стабильности с течением времени. На основе линейного регрессионного анализа изменение коэффициента стабильности имплантата достигает нулевого значения при коэффициенте первичной стабильности имплантата, равном 70,1.
Обнаружена статистически незначительная взаимосвязь между первичной стабильностью и потерей маргинальной кости. Была подтверждена положительная корреляция между конечным крутящим моментом установки и потерей маргинальной кости.





Список литературы
Лепилин А.В., Шалина М.Ю., Савельева С.С., Мухина Н.М., Ноздрачев В.Г. 2018. Прогнозирование возможности немедленной нагрузки на дентальные импланты с помощью частотно-резонансного анализа. Клиническая стоматология. 2 (86): 50–53.
Alalharath A.M.S., Alyami A.H.H., Al Dowis M.H.H., Alsagoor I.M.H., Sagoor D.H.M., Alnaseib Y.S.A., Alyami M.H.S. Effect of Dental Implant Stability on the Periodontium: A Prospective Study. Annals of Clinical and Analytical Medicine. 2022; 10 (1): 494–498.
Al-Tarawneh S.K., Thalji G., Cooper L.F. (2022). Macrogeometric Differentiation of Dental Implant Primary Stability: An In Vitro Study. The International Journal of Oral & Maxillofacial Implants. 2022; 37 (6): 1110–1118.. doi: 10.11607/jomi.9656
Balshi S.F., Allen F.D., Wolfinger G.J., Balshi T.J. (2005) A resonance frequency analysis assessment of maxillary and mandibular immediately loaded implants. International Journal of Oral & Maxillofacial Implants. 2005; 20: 584–594 .
Chen S., Rittel D., Shemtov-Yona K. Probing the sensitivity of the resonant frequency analysis to the dental implant-bone condition: A numerical study. Journal of the Mechanical Behavior of Biomedical Materials. 2022; 128; 105128. doi: 10.1016/j.jmbbm.2022.105128
Eshkol‐Yogev I., Tandlich M., Shapira L. Effect of implant neck design on primary and secondary implant stability in the posterior maxilla: A prospective randomized controlled study. Clinical Oral Implants Research. 2019; 30 (12): 1220–1228. doi: 10.1111/clr.13535.
Ghosh R., Chanda S., Chakraborty D. (2022). Application of finite element analysis to tissue differentiation and bone remodelling approaches and their use in design optimization of orthopaedic implants: A review. International Journal for Numerical Methods in Biomedical Engineering. 2022; 38 (10): e3637. doi: 10.1002/cnm.3637
Immel K. Numerical modeling of the adhesive contact at the bone-implant interface (Doctoral dissertation, Paris Est). 2021.
Kahraman S., Bal B.T., Asar N.V., Turkyilmaz I., Tözüm T.F. Clinical study on the insertion torque and wireless resonance frequency analysis in the assessment of torque capacity and stability of self‐tapping dental implants. Journal of Oral Rehabilitation. 2009; 36 (10): 755–761. doi.org/10.1111/j.1365-2842.2009.01990.x
Kittur N., Oak R., Dekate D., Jadhav S., Dhatrak P. Dental implant stability and its measurements to improve osseointegration at the bone-implant interface: A review. Materials Today: Proceedings. 2021; 43: 1064–1070. doi: 10.1016/j.matpr.2020.08.243
Li J., Jansen J.A., Walboomers X.F., van den Beucken J.J. Mechanical aspects of dental implants and osseointegration: A narrative review. Journal of the mechanical behavior of biomedical materials. 2020; 103: 103574. https://doi.org/10.1016/j.jmbbm.2019.103574
Lim H.K., Lee S.J., Jeong Y., Lee J.S., Ryu, J.J., Shim J.S., Song I.S. Clinical Validation of Dental Implant Stability by Newly Designed Damping Capacity Assessment Device during the Healing Period. Medicina. 2022; 58 (11): 1570. doi: 10.3390/medicina58111570
Matos F.G., Santana L.C.L., Cominotte M.A., da Silva F.S., Vaz L.G., de Oliveira D.P., Cirelli J.A. Strontium-loaded titanium-15molybdenum surface improves physicochemical and biological properties in vitro. Biomedical Physics & Engineering Express. 2022; 8 (4): 045007. doi: 10.1088/2057-1976/ac71cf
Miri R., Shirzadeh A., Kermani H., Khajavi A. Relationship and changes of primary and secondary stability in dental implants: A review. International Journal of Contemporary Dental & Medical Reviews. 2017; 2017: 1–6. doi: 10.15713/ins.ijcdmr
Monje A., Ravida A., Wang H.L., Helms J.A., Brunski J.B. Relationship Between Primary/Mechanical and Secondary/Biological Implant Stability. International Journal of Oral & Maxillofacial Implants. 2019; 34: 7–23. doi: 10.11607/jomi.19suppl.g1
Noaman A.T., Bede S.Y. (2022). The Effect of Bone Density Measured by Cone Beam Computed Tomography and Implant Dimensions on the Stability of Dental Implants. Journal of Craniofacial Surgery. 2022; 33 (6): e553-e557. doi: 10.1097/SCS.0000000000008429
Qi J., Miyashita M., Ogawa T., Naito H., Sasaki K. Resonance frequency analysis for evaluation of the connecting condition between fixed prostheses and their abutment teeth: An in vitro and finite element analysis study. The Journal of Prosthetic Dentistry. 2022. doi: 10.1016/j.prosdent.2022.03.005
Ravidà A., Barootchi S., Askar H., Del Amo F.S.L., Tavelli L., Wang H.L. Long-Term Effectiveness of Extra-Short (≤ 6 mm) Dental Implants: A Systematic Review. International Journal of Oral & Maxillofacial Implants. 2019; 34 (1): 68–84. doi: 10.11607/jomi.6893
Rosas-Díaz J.C., Córdova-Limaylla N.E., Palomino-Zorrilla J.J., Guerrero M.E., Carreteros R., Cervantes-Ganoza L.A., Cayo-Rojas C.F. Repeatability and reproducibility of a modified Lekholm and Zarb bone quality classification based on cone beam computed tomography. 2022. doi: 10.4103/jispcd.JISPCD_291_21
Rues S., Schmitter M., Kappel S., Sonntag R., Kretzer J.P., Nadorf J. Effect of bone quality and quantity on the primary stability of dental implants in a simulated bicortical placement. Clinical oral investigations. 2021; 25: 1265–1272. doi: 10.1007/s00784-020-03432-z
Şahin S., Cehreli M.C., Yalçın E. The influence of functional forces on the biomechanics of implant-supported prostheses–a review. Journal of dentistry. 2002; 30 (7–8); 271–282. doi: 10.1016/s0300-5712(02)00065-9
Sharma M.N., Ahmed N., Ganapathy D.M., Pandurangan K.K., Maiti S. Awareness on resonance frequency analysis in dental implantology among dental practitioners and dental students. Journal of Advanced Pharmaceutical Technology & Research. 2022; 13 (5): 233–237. doi: 10.4103/japtr.japtr_326_22
Sharma N., Nagpal A., Kundal A., Singla A., Jindal V. Axis of success: Primary and secondary stability of implant. Indian Journal of Dental Sciences. 2021; 13 (2): 141–145. doi: 10.4103/IJDS.IJDS_118_20
Silva G.A.F., Faot F., da Rosa Possebon A.P., da Silva W.J., Cury A.A.D.B. Effect of macrogeometry and bone type on insertion torque, primary stability, surface topography damage and titanium release of dental implants during surgical insertion into artificial bone. Journal of the Mechanical Behavior of Biomedical Materials. 2021; 119: 104515. doi: 10.1016/j.jmbbm.2021.104515
Suzuki S., Kobayashi H., Ogawa T. Implant stability change and osseointegration speed of immediately loaded photo functionalized implants. Implant dentistry. 2013; 22 (5): 481–490. doi: 10.1097/ID.0b013e31829deb62
Villar C.C., Huynh‐Ba G., Mills M.P., Cochran D.L. Wound healing around dental implants. Endodontic Topics. 2021; 25 (1), 44–62. https://doi.org/10.1111/etp.12018
Weinstein R., Agliardi E., Fabbro M.D., Romeo D., Francetti L. Immediate rehabilitation of the extremely atrophic mandible with fixed full‐prosthesis supported by four implants. Clinical implant dentistry and related research. 2012; 14 (3): 434-441. doi: 10.1111/j.1708-8208.2009.00265.x
West J.D., Oates T.W. Identification of stability changes for immediately placed dental implants. International Journal of Oral & Maxillofacial Implants. 2007; 22 (4): 623–630.