Результаты биохимического исследования слюны у лиц пожилого возраста, использующих паровые коктейли
Aннотация
В настоящее время употребление паровых коктейлей при табакокурении становится очень популярно. Многие переходят на электронные сигареты, паровые коктейли (кальян), так как считают, что они не наносят вред организму. Цель работы – исследование биохимического состава слюны у лиц, использующих паровые коктейли при табакокурении. Было проведено анкетирование 60 пациентов с различным стажем табакокурения. В целях исследования было три группы: 1 группа – стаж курения менее пяти лет, 2 группа – стаж курения более пяти лет, контрольная группа – не курящие. Для биохимического исследования слюны, а конкретно роданидов слюны, необходимо добавить к слюне хлорное железо. После этого образуется комплектное соединение, которое содержит роданид и железо. В результате выполненного исследования было обследовано 60 пациентов. В первой группе (стаж курения менее пяти лет) – 20 пациентов, во второй группе (стаж курения более пяти лет) – 20 пациентов, в контрольной группе (не курящие) – 20 пациентов. В ходе исследования выявлено, что в 1 и 2 группе количество роданидов значительно увеличивается. Результаты проведенного исследования показывают, что у лиц, использующих паровые коктейли при табакокурении, количество роданидов в слюне значительно выше, чем у некурящих. После проведения профилактических мероприятий наблюдалось снижение количества роданидов как в первой, так и во второй группах.
Введение
Использование паровых коктейлей при табакурении становится все более популярно. По данным Всемирной Организации Здравоохранения (ВОЗ), в дыме кальяна содержится такое же количество углекислого газа, дегтя и тяжелых металлов, что и в обычных сигаретах [Колбасников и др., 2019; Emelina et al., 2018; Bhatnagar et al., 2021].
Табак является причиной воспалений полости рта и многих заболеваний полости рта. Кариес зубов является одним из наиболее распространенных заболеваний полости рта. Связь между курением табака и кариесом зубов стала важной темой недавних исследований. Систематический обзор и метаанализ были проведены для оценки связи между курением табака и кариесом зубов [Elovicova et al., 2019; Jiang et al., 2019].
Табачный дым наносит также физические повреждения, так как повышает температуру во рту и обжигает ткани. Больные часто жалуются на неприятный запах изо рта, неприятный вкус или ксеростомию. Стоматология играет огромную роль в профилактике, раннем выявлении поражений и, наконец, в мотивации отказа от курения [Khemiss et al., 2016].
Табак содержит вещества, которые вызывают зависимость. Лица, употребляющие обычные сигареты, и лица, употребляющие паровые коктейли (кальян), курят для насыщения никотинового голода. Однако лицам, использующим паровые коктейли, для этого нужно больше времени – от 30 минут и больше [Bykova et al., 2018; Mironov et al., 2020].
Проявление влияния курения на слизистую рта – хронический стоматит и хейлит курильщиков. Этим заболеваниям характерна отечность, однако в этом случае она отсутствует [Кубанов и др., 2018; Sevbitov et al., 2018].
Установлено, что кандидоз полости рта и курение табака с помощью паровых коктейлей взаимосвязаны [Зубкова и др., 2018; Balaji et al., 2008]. Интенсивность курения способствует развитию острого кандидоза, а также увеличивает рост грибковой флоры, это было доказано экспериментально и клинически [Емелина и др., 2021; Kim et al., 2016].
Цель работы: исследование биохимического состава слюны у лиц, использующих паровые коктейли при табакокурении.
Объекты и методы исследования
Было проведено анкетирование 60 пациентов с различным стажем табакокурения. В целях исследования было три группы: 1 группа – стаж курения менее пяти лет, 2 группа – стаж курения более пяти лет, контрольная группа – некурящие.
Для биохимического исследования слюны, а конкретно роданидов слюны, необходимо добавить к слюне хлорное железо. После этого образуется комплектное соединение, которое содержит роданид и железо. Внешне роданиды слюны можно обнаружить по появлению красной окраски, которая как раз и образуется после того, как к слюне добавить хлорное железо. В норме роданидов в слюне 0,5–1,2 ммоль/л. Роданиды осуществляют антибактериальную функцию. Также роданиды осуществляют функцию защиты. Принято считать, что слюна концентрирует роданиды по причине того, что роданидов, которые содержатся в слюне, находится больше, чем в других биологических жидкостях [Тимошин и др., 2018; Lamont et al., 2018].
С целью того чтобы найти роданиды в слюне, необходимо лабораторное исследование: к слюне нужно добавить 2 % раствор соляной кислоты и 0,01 % раствор хлорного железа, в результате этого появляется окрашивание красного цвета [Еловикова и др., 2019; Lodi et al., 2021].
Статистический анализ проводился с использованием программы StatTech v. 3.1.3 (разработчик – ООО «Статтех», Россия).
Количественные показатели воспринимались на предмет соответствия нормальному распределению при помощи критерия Шапиро.
Если нормальное распределение отсутствовало, то количественные данные разъяснялись при помощи медианы (Me) и нижнего и верхнего квартилей (Q1 – Q3).
Направление и теснота корреляционной связи между двумя количественными показателями рассматривались при помощи коэффициента ранговой корреляции Спирмена (при распределении показателей, отличном от нормального).
Прогностическая модель, которая охарактеризовала зависимость количественной переменной от факторов, создавалась при помощи метода линейной регрессии.
Результаты и их обсуждение
В результате выполненного исследования было обследовано 60 пациентов. В первой группе (стаж курения менее пяти лет) – 20 пациентов, во второй группе (стаж курения более пяти лет) – 20 пациентов, в контрольной группе (некурящие) – 20 пациентов.
В ходе исследования выявлено, что в контрольной группе количество роданидов устойчиво, тогда как в первой и второй группе значительно увеличено. При сравнении групп выявлено, что в первой группе количество роданидов увеличено в пять раз, во второй группе – в 10,1 раза.
В исследуемых группах выявлены следующие показатели роданидов. В контрольной группе – 0,31±0,09 ммоль/л, в первой группе – 1,54±0,42 ммоль/л, во второй группе – 2,92±0,9 ммоль/л (табл. 1). Различия статистически значимы при сравнении данных 1, 2 и контрольной групп между собой (р < 0,05).
Таблица 1
Table 1
Результаты биохимического исследования слюны (p ˂ 0,05)
The results of a biochemical study of saliva (p ˂ 0,05)
Роданиды слюны | Группа | Показатели, ммоль/л | Норма |
Контрольная группа | 0,51 |
0,5–1,2 | |
1 группа | 1,54* | ||
2 группа | 2,92** |
Примечание: * – различия статистически значимы при сравнении данных контрольной группы и 1 группы между собой (р < 0,05), ** – различия статистически значимы при сравнении данных всех трех групп между собой (р < 0,05).
Клинический случай.
Пациент М., 61 год, проходил стоматологическое обследование. Жалобы на жжение языка, боли в области языка, сухость во рту, чувство шероховатости, стянутости, неприятный запах изо рта, кровоточивость десен при приеме жесткой пищи. Впервые данные ощущения почувствовала более года назад.
Сопутствующие заболевания: гипертоническая болезнь II степени.
Анамнез: стаж курения паровых коктейлей более пяти лет (примерно 18 лет).
Объективно при осмотре:
Конфигурация лица не изменена, цвет кожных покровов в норме, кожа без патологических образований. Лимфатические узлы: нижнечелюстные, подбородочные, затылочные, шейные не пальпируются. Пальпация височно-нижнечелюстного сустава безболезненная. Слизистая преддверия полости рта бледно-розового цвета, протоки слюнных желез без патологии. Прикрепление уздечек губ, языка в норме. Глубина преддверия полости рта в пределах нормы. Язык бледно-розового цвета, размер в пределах нормы, нитевидные и грибовидные сосочки увеличены. Прикус ортогнатический.
Зубная формула (табл. 2).
Таблица 2
Table 2
Зубная формула
Dental formula
О | П | К | К | П |
| П | П | П | П | П | П | П | К | К | О |
18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
48 | 47 | 46 | 45 | 44 | 43 | 42 | 41 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 |
О | К | И | К | П |
|
|
|
|
|
| К | К | И | К | О |
На зубах визуализируется зубной налет. На зубах 3.1, 3.2, 3.3, 3.4, 4.1, 4.2, 4.3, 4.4 наддесневой зубной камень.
Определение роданидов в слюне – 2,75 ммоль/л, при норме 0,5–1,2 ммоль/л.
Диагноз: К05.30 Хронический пародонтит. Генерализованный.
К14.6 Глоссалгия
План лечения:
- Профессиональная гигиена полости рта.
- Санация полости рта.
- Консультирование по мотивации к отказу от курения.
- Консультация пародонтолога.
- Консультация у гастроэнтеролога.
Рекомендации:
- Ополаскиватель для полости рта, в составе которого содержится ксилит, 2 раза в день после еды.
- Увлажнитель для полости рта, в составе которого содержится ксилит, 3 раза в день.
- Зубная паста R.O.C.S. «Кофе и табак»
- Уменьшить время курения парового коктейля.
- Повторный прием через месяц.
После применения данного лечения наблюдалось улучшение показателей биохимического исследования роданидов (табл. 3).
Таблица 3
Table 3
Взаимосвязь стажа курения и роданидов слюны до лечения
Relationship between smoking experience and saliva thiocyanates before treatment
Показатель | Характеристика корреляционной связи | ||
ρ | Теснота связи по шкале Чеддока | p | |
Стаж курения – роданиды слюны до лечения | 0,963 | Весьма высокая | < 0,001* |
При проведении анализа взаимосвязи роданидов слюны, а также стажа курения была определена значительной тесноты взаимосвязь.
Наблюдаемая зависимость роданидов слюны до лечения от стажа курения описывается уравнением парной линейной регрессии:
YРоданиды слюны до лечения = 0,673 × XСтаж курения + 0,908
При увеличении стажа курения на 1 следует ожидать увеличение роданидов слюны до лечения на 0,673 ммоль/л. Полученная модель объясняет 95,2 % наблюдаемой дисперсии роданидов слюны до лечения (рис. 1).
 Рис. 1. Зависимость роданидов слюны до лечения от стажа курения
Рис. 1. Зависимость роданидов слюны до лечения от стажа курения
Fig. 1. Dependence of salivary thiocyanates before treatment on the length of smoking
Был проведен корреляционный анализ взаимосвязи стажа курения и роданидов слюны после лечения (табл. 4).
Таблица 4
Table 4
Взаимосвязь стажа курения и роданидов слюны после лечения
Relationship between smoking experience and saliva thiocyanates after treatment
Показатель | Характеристика корреляционной связи | ||
ρ | Теснота связи по шкале Чеддока | p | |
Стаж курения – роданиды слюны через 6 месяцев после лечения | 0,879 | Высокая | < 0,001* |
Уже после лечения определена значительной тесноты взаимосвязь между присутствием роданидов слюны и стажем курения.
Зависимость роданидов слюны после лечения от стажа курения, которая рассматривалась, представляется следующим уравнением парной линейной регрессии:
YРоданиды слюны через 6 месяцев после лечения = 0,246 × XСтаж курения + 1,252
Когда стаж курения более продолжительный, уровень роданидов слюны становится выше после лечения на 0,246 ммоль/л. Полученная модель объясняет 63,2 % наблюдаемой дисперсии роданидов слюны после лечения (рис. 2).
 Рис 2. Зависимость роданидов слюны после лечения от стажа курения
Рис 2. Зависимость роданидов слюны после лечения от стажа курения
Fig. 2. Dependence of salivary thiocyanate after treatment on the length of smoking
Нами был проведен корреляционный анализ взаимосвязи стажа курения и роданидов слюны через 12 месяцев после лечения (табл. 5).
Таблица 5
Table 5
Взаимосвязь стажа курения и роданидов слюны через 12 месяцев после лечения
Relationship between smoking experience and saliva thiocyanates 12 months after treatment
Показатель | Характеристика корреляционной связи | ||
ρ | Теснота связи по шкале Чеддока | p | |
Стаж курения – роданиды слюны через 12 месяцев после лечения | 0,928 | Весьма высокая | < 0,001* |
При проведении анализа взаимосвязи роданидов слюны через 12 месяцев, а также стажа курения была определена значительной тесноты взаимосвязь.
Зависимость роданидов слюны через 12 месяцев, а также от стажа курения, которая рассматривалась, представляется следующим уравнением парной линейной регрессии:
YРоданиды слюны через 12 месяцев после лечения = 0,176 × XСтаж курения + 0,789
Когда стаж курения более продолжительный, уровень роданидов слюны становится выше через 12 месяцев после лечения на 0,176 ммоль/л. Полученная модель объясняет 84,4 % наблюдаемой дисперсии роданидов слюны через 12 месяцев после лечения (рис. 3).
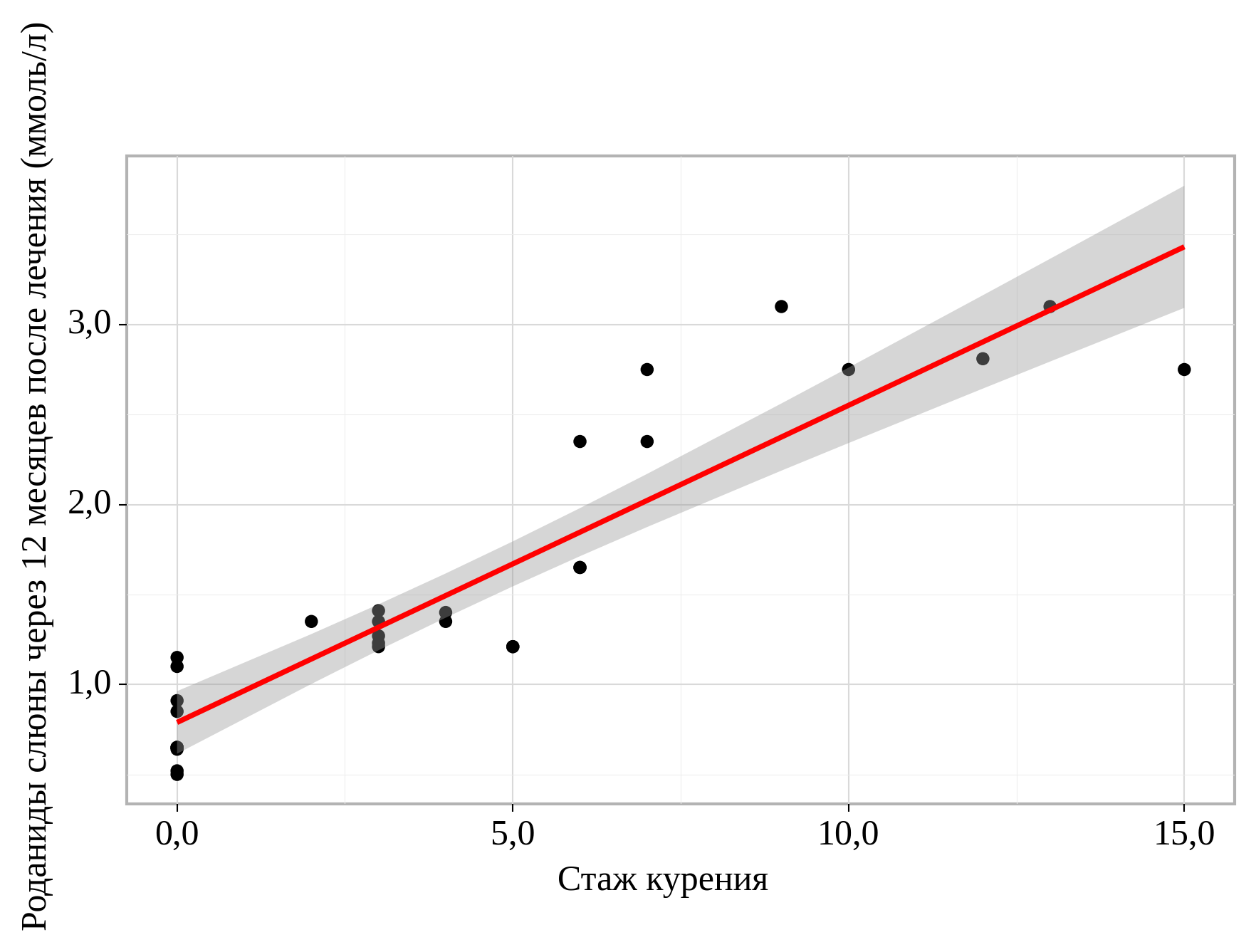 Рис. 3. Зависимость роданидов слюны через 12 месяцев после лечения от стажа курения
Рис. 3. Зависимость роданидов слюны через 12 месяцев после лечения от стажа курения
Fig. 3. Dependence of salivary thiocyanates 12 months after treatment on smoking experience
Обсуждение
Данное биохимическое исследование показало, что количество роданидов в слюне стабильно в контрольной группе.
В первой группе количество роданидов (1,54 ммоль/л) увеличено в три раза в сравнении с контрольной группой (0,51 ммоль/л), где количество роданидов является нормой. А во второй группе количество роданидов увеличено в 6 раз. Однако после проведения профилактических мероприятий и плана лечения показатели роданидов пришли в норму.
Также после проведения всех пунктов плана лечения можно отметить, что гигиена полости рта исследуемых пациентов улучшилась. Пациенты отметили, что спустя примерно 10 дней после того как они начали следовать нашим рекомендациям, они заметили улучшения состояния полости рта. Также они отметили, что, после того как стали происходить улучшения, стали стараться употреблять паровые коктейли гораздо меньше и реже.
В нормальном состоянии роданиды выполняют антибактериальную функцию, а также функцию защиты. Они активируют пероксидазы, которые участвуют в метаболизме перекисных соединений. Во всяком случае, когда количество роданидов становится больше, защитная и антибактериальная функция ослабевают [Тимошин и др., 2018; Gupta et al., 2018; Chaffee, 2019].
Данные свидетельствуют о том, что употребление паровых коктейлей не безвредно. А также, очевидно, что существует эффективность уменьшения времени курения.
Также можно сказать о том, что измерение содержания роданидов в слюне может оказаться полезным для раннего выявления заболеваний пародонта.
Заключение
Результаты проведенного исследования показывают, что у лиц, использующих паровые коктейли более пяти лет, количество роданидов (2,92 ммоль/л) выше, чем у лиц, которые используют паровые коктейли менее пяти лет (1,54 ммоль/л). В общем итоге у лиц, использующих паровые коктейли при табакокурении, количество роданидов в слюне значительно выше, чем у некурящих. Это обусловлено избыточным поступлением в организм синильной кислоты в составе табачного дыма.
Данное исследование показало, что количество роданидов в первой и во второй группах больше, чем в контрольной. После того как были выполнены мероприятия по профилактике, наблюдалось снижение количества роданидов как в первой группе (0,52±0,04 ммоль/л), так и во второй (1,03±0,19 ммоль/л).





Список литературы
Еловикова Т.М., Молвинских В.С., Костина Е.Ю., Белинская Е.В., Строкина Е.С. 2019. Стоматологический статус курящих пациентов. В сборнике: Материалы Международного конгресса «Стоматология Большого Урала», 88–89.
Емелина Е.С., Дорофеев А.Е., Емелина Г.В., Ершов К.А., Кузнецов И.И. 2021. Влияние табакокурения при помощи парового коктейля на полость РТА. Актуальные проблемы медицины, 44 (2): 200–208. doi: 10.52575/2687-0940-2021-44-2-200-208
Зубкова А.А., Бароян М.А. 2018. Стоматологический статус современной студенческой молодежи на примере студентов стоматологического факультета. Международный журнал прикладных и фундаментальных исследований, 9: 35–39.
Колбасников С.В., Кононова А.Г., Белова Н.О., Нилова О.В., Авакова В.Э., Кузнецов А.Г. 2019. Алгоритм ведения курящего пациента врачом первичного звена здравоохранения. Верхневолжский медицинский журнал. 18 (2): 45–51.
Кубанов И.М., Курбанов А.А., Хапчаев К.Б. 2018. Влияние курения на состояние тканей полости рта, распространенность курения среди студентов СГМУ. Бюллетень медицинских интернет-конференций.
Тимошин А.В., Севбитов А.В., Ергешева Е.В., Васильев Ю.Л. 2018. Опыт лечения воспалительных заболеваний тканей пародонта препаратами на основе коллагена и дигестазы. Медицинский алфавит, 1–2 (339): 6–10.
Bhatnagar D.M. 2021. Oral Health: A Gateway to Overall Health. Contemp Clin Dent. Jul-Sep; 12 (3): 211–212. doi: 10.4103/ccd.ccd_597_21.
Bykova N.I., Ovsyannikova A.A., Sepiashvili R.I., Arutyunov A.V., Lapina N.V., Sirak S.V. 2018. Immunohistochemical analysis in the endothelium state of the periodontium vessels both in normal and inflamed condition. Allergy, asthma, copd, immunophysiology & immunorehabilitology: innovative technologies bologna, 329–337.
Chaffee B.W. 2019. Electronic Cigarettes: Trends, Health Effects and Advising Patients Amid Uncertainty. J. Calif. Dent. Assoc., 47 (2): 85–92.
Elovicova T., Karaseva V., Molvinskikh V., Skurihina Ya., Koshchev A. 2019. Modeling of the express diagnostic method of the negative influence of smoking as a managed process in the practice of a dentist. Actual Problems in Dentistry, 15 (4): 44–49. doi.org/10.18481/2077-7566-2019-15-4-44-49
Emelina G.V., Suvorova M.N., Gerashchenko S.M., Gerasimova T.V., Emelina E.S. 2018. Comparative analysis of dental morbidity as a basis of people’s demand for dental services. Journal of Pharmaceutical Sciences and Research, 10 (4): 798–799.
Gupta S., Maharjan A., Dhami B., Amgain P., Katwal S., Adhikari B., Shukla A. 2018. Status of Tobacco Smoking and Diabetes with Periodontal Disease. JNMA J. Nepal. Med. Assoc., 56 (213): 818–824. doi: 10.31729/jnma.3610.
Jiang X., Jiang X., Wang Y., Huang R. 2019. Correlation between tobacco smoking and dental caries: A systematic review and meta-analysis. Tob. Induc. Dis., 19 (17): 34. doi: 10.18332/tid/106117.
Khemiss M., Ben Khelifa M., Ben Rejeb M., Ben Saad H. 2016. Periodontal bone height of exclusive narghile smokers compared with exclusive cigarette smokers. Libyan J. Med., 30 (11): 31689. doi: 10.3402/ljm.v11.31689.
Kim K.H., Kabir E., Jahan S.A. 2016. Waterpipe tobacco smoking and its human health impacts. J. Hazard Mater, 5 (317): 229–236. doi: 10.1016/j.jhazmat.2016.05.075.
Lamont T. Worthington H.V, Clarkson J.E, Beirne P.V. 2018. Routine scale and polish for periodontal health in adults. Cochrane Database Syst. Rev., 27; 12 (12): CD004625. doi: 10.1002/14651858.
Lodi G., Tarozzi M., Baruzzi E., Costa D., Franchini R., D’amore F., Carrassi A., Lombardi N. 2021. Epidemiology and risk factors. Dental Cadmos, 89 (1): 1–18. doi: 10.1080/00016350903054980.
Mironov, S., Emelina, E., Troitskii, V., Yablokova, N., Kuznetsov, I. 2020. The impact of smoking, including hookah, on the human body / Journal of Global Pharma Technology, 12 (1): 211–217.
Sevbitov A.V., Enina Y.I., Dorofeev A.E., Mironov S.N., Brago A.S. 2018. Experience in the application of hybrid ceramic restorations in the cervical region. Asian Journal of Pharmaceutics, 12 (3): 1106–1109.
Balaji S.M. 2008. Tobacco smoking and surgical healing of oral tissues: a review. Indian J. Dent. Res., 19 (4): 344–348. doi: 10.4103/0970-9290.44540.