Гистохимические аспекты при поражении слизистой оболочки полости рта и слюнных желез у пациентов с ОРВИ
Aннотация
Острые респираторные вирусные инфекции передаются воздушно-капельным путем, представляют из себя группу острозаразных заболеваний вирусной этиологии, характеризующиеся общими признаками: повышение температуры тела, общей слабостью, недомоганием. Врач-стоматолог обязан определить начальные стадии заболеваний и предупредить изменения со стороны органов и тканей полости рта при помощи профилактических методов, а также с помощью дополнительных исследований, одним из которых является гистохимический метод. Понятие «гистохимический метод» включает в себя специфические приемы, предназначенные для обнаружения различных химических веществ и продуктов их метаболизма в материале «щипковых» биопсий с помощью дифференциального окрашивания. Данное исследование проводится методом светооптической микроскопии. В работе приведены результаты анализа Т-клеточного звена иммунной системы. При помощи гистохимического метода выявлена способность гликогена и гистамина участвовать в воспалительных процессах. Представлена информация о местном иммунитете у детей с острым герпетическим стоматитом и рецидивирующим герпетическим стоматитом. Выявлено, что при PAS-реакции в цитоплазме околоушной железы при патологии обнаруживаются полисахариды, наблюдается интенсивное окрашивание цитоплазмы клеток подчелюстной железы. Гистохимический метод является перспективным направлением, так как позволяет наиболее точно интерпретировать получаемые результаты.
Ключевые слова: гистохимический метод, острая респираторная вирусная инфекция, иммуногистохимическое исследование, слюнные железы
Актуальность
В последние годы в мире количество заболевших острой респираторной вирусной инфекцией (ОРВИ) варьируется от 27 до 33 млн человек [Maldonado et al., 2022]. Необходимо принимать во внимание незарегистрированные случаи заболевания ввиду того, что чаще всего люди несвоевременно обращаются за медицинской помощью, за счет чего заболеваемость во много раз превышает полученные данные. В среднем каждый из нас болеет ОРВИ 2–4 раза в год. Следует учитывать повышенную заболеваемость у детей, показатель которой выше в 3–4 раза [Орлов и др., 2022; Maldonado et al., 2022].
ОРВИ являются группой острозаразных заболеваний вирусной этиологии, передающихся воздушно-капельным путем, характеризуются общими признаками: повышение температуры тела, общей слабостью, недомоганием. При этом в полости рта могут наблюдаться отечность, покраснение в области мягкого неба, рыхлость и зернистость слизистых полости рта, налет на языке. При длительном, тяжелом течении заболевания возможно возникновение гингивита, стоматита, проявление хронических заболеваний, таких как герпес, пародонтит и другие. [Гонтарев и др., 2022; Azzi et al., 2020; Singhal, 2020]. Ввиду этого профилактика и лечение ОРВИ являются основной целью современного здравоохранения во всем мире.
Препараты, показанные при лечении ОРВИ, могут являться повреждающим фактором слизистой оболочки полости рта (СОПР). Чаще врач в борьбе с заболеванием назначает такие препараты, как антибиотики, иммуномодуляторы, антисептические средства и т. д. Бесспорно, они замечательно справляются, но, как известно, синтетические препараты обладают рядом отрицательных эффектов, оказывающих губительное влияние на микрофлору, которая поддерживает естественный иммунитет полости рта [Arshad et al., 2020; Zhu et al., 2022]. Поскольку заболевание очень распространено и его лечение связано с применением синтетических препаратов, важное значение имеет раннее обнаружение и лечение постинфекционных заболеваний в полости рта.
Воспалительные явления в ротовой полости возникают вследствие ОРВИ, что вызывает длительную и выраженную бактериемию, значительно понижая иммунитет полости рта, а также в целом иммунную систему. Данная ситуация может спровоцировать появление пародонтита разных степеней тяжести. Для оценки эффективности проведенного лечения возможно использование цитологических и бактериоскопических исследований [Кобзева и др., 2019].
Врач-стоматолог обязан определить начальные стадии заболеваний и предупредить изменения со стороны органов и тканей полости рта при помощи профилактических методов, а также с помощью дополнительных исследований, одним из которых является гистохимический метод [Zhu et al., 2022]. Учитывая актуальность данного вопроса, в настоящей работе проведен анализ научных исследований, опубликованных за последние 10 лет в журналах, входящих в базы данных Scopus, WebofScience, а также РИНЦ.
Цель исследования – обратить внимание на значимость ранней диагностики и лечения поражений полости рта у пациентов, переболевших ОРВИ, а также обосновать целесообразность применения гистохимических методов при диагностике поражения СОПР и слюнных желез таких пациентов.
Понятие «гистохимический метод» включает в себя специфические приемы, предназначенные для обнаружения различных химических веществ и продуктов их метаболизма в материале «щипковых» биопсий с помощью дифференциального окрашивания. Данное исследование проводится методом светооптической микроскопии, в ходе которого используется криостатическая аппаратура (рис. 1), и включает в себя следующие операции: подготовка материала и его фиксация, исследование микропрепаратов с последующей оценкой полученных результатов.
Рис. 1. Криостат
Fig.1. Cryostat
При гистохимическом методе используют экспериментальный, трупный, хирургический, биопсийный материалы, а также мазки, соскобы, отпечатки, культуры тканей. При помощи охлаждения до –70 °C достигается необратимое ингибирование и скорое прекращение метаболических процессов, приводящее к аутолизу тканей. Обеспечение «барьерной функции» эпителия десны происходит за счет лизина, градиентов содержания рибонуклеиновой кислоты (РНК), гистидина, нейтральных гликопротеинов свободного и связанного катионного белка, аргинина, белка [Лепёхина Л., Лепёхина О., 2016, Лепёхина Л., Лепёхина О., 2018].
По утверждению ряда авторов [Гонтарев и др., 2017], иммуногистохимические исследования имеют важное значение на данный момент времени. В работе проведен анализ Т-клеточного звена иммунной системы больных хроническим пародонтитом, в результате которого было выявлено наличие клеток с фенотипом CD, что значительно больше, чем у здоровых доноров. Анализ показал увеличение содержания в крови лимфоцитов, что является подтверждением функциональной недостаточности антигенирезентирующих клеток.
Несущественное увеличение количества Т-лимфоцитов – с 1,3 ± 0,1 % до 2,1 ± 0,3 %, В-лимфоцитов – с 1,1 ± 0,1 % до 2,4 ± 0,1 %, макрофагов – с 2,4 ± 0,3 % до 3,7 ± 0,4 % было обнаружено при глубоком кариесе в сочетании с пародонтитом легкой степени. При поверхностном кариесе в сочетании с пародонтитом лёгкой степени с помощью иммуногистохимического метода проводилось изучение лимфоцитов и макрофагов в пульпе зуба, которое показало возрастание иммунокомпетентных клеток пульпы зуба: Т-лимфоцитов – с 1,3 ± 0,1 % до 1,8 ± 0,2 %, В-лимфоцитов – с 1,1 ± 0,1 % до 1,2 ± 0,1 %, макрофагов –
с 2,4 ± 0,3 % до 2,8 ± 0,2 %.
При помощи моноклональных антител (МКАТ) к CD3, CD20, CD68 в ходе изучения иммунокомпетентных клеток в пульпе зуба при остром очаговом пульпите в сочетании с пародонтитом авторами был обнаружен резкий подъём содержания: Т-лимфоцитов –
с 1,3 ± 0,1 % до 6,3 ± 0,5 % (р < 0,05), В-лимфоцитов – с 1,1 ± 0,1 % до 7,6 ± 0,6 %
(р < 0,01), макрофагов – с 2,4 ± 0,3 % до 12,3 ± 1,6 % (р < 0,01).
Был изучен местный иммунитет у детей с острым герпетическим стоматитом (ОГС). Установлено, что по сравнению со здоровыми детьми количество Т суперссоров-цитостатических клеток (CD8+) было в значительной степени выше как у больных ОГС, так и у больных с рецидивирующим стоматитом (РГС). У детей как с ОГС, так и с РГС выявлено низкое соотношение субпопуляций CD4+/CD8+. Автор указывает на тот факт, что показатели значимы только у больных с тяжелой формой ОГС (< 0,05). Серьезных различий в показателе между группами детей с ОГС и РГС не обнаружено (р > 0,1) [Гонтарев и др., 2017].
Согласно некоторым данным [Московский и др., 2007], показано повышенное содержание гистамина при патологии в тканях, повышенный уровень норадреналина и адреналина по сравнению с нормой. В тучных клетках и кровеносных сосудах было отмечено увеличение содержания гистамина, в гранулярных люминесцирующих клетках – катехоламинов и серотонина.
Значимые результаты были получены при изучении хронического генерализованного пародонтита легкой степени тяжести. При проведении цитологического исследования клеточного состава десневой жидкости было определено наличие воспалительного поражения тканей пародонтального комплекса, увеличенное количество полиморфно-ядерных нейтрофилов, появление моноцитов, лимфоцитов, снижение количества макрофагов, что демонстрирует понижение уровня неспецифической иммунной защиты. В мазках появляются незрелые эпителиоциты с ядерно цитоплазматическим соотношением – 1:2; 1:1; 2:1. Незрелые эпителиоциты являются маркером нарушения целостности эпителиальной выстилки пародонтального кармана, свидетельствуют о присутствии грануляций и изъязвлений [Кобзева и др., 2019].
Имеется достоверное утверждение, что гликоген способен участвовать в процессах воспаления эпителия полости рта, а именно накапливаться в эпителии мягкого неба, СО щек, дна полости рта. Авторы отмечают его накопление в тех участках слизистой, где эпителий не ороговевает. При воспалительных реакциях во время заболевания ОРВИ (рис. 2, 3) удается наблюдать данную закономерность, следовательно, процессы ороговения нарушаются и отмечается увеличение содержания гликогена.
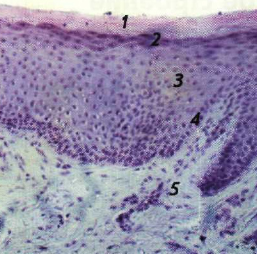
Рис. 2. Ороговевающий многослойный плоский эпителий. Х90.
1 – роговой слой; 2 – зернистый; 3 –шиповатый; 4 – базальный; 5– собственная пластинка слизистой оболочки
Fig. 2. Keratinizing stratified squamous epithelium. X90.
1 – stratum corneum; 2 – granular; 3 – prickly; 4 – basal; 5 – own plate of the mucous membrane
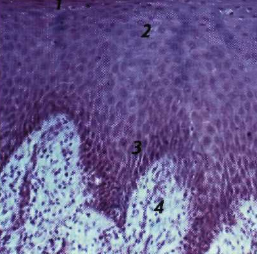
Рис. 3. Неороговевающий многослойный плоский эпителий. Х90.
1 – слой плоских клеток; 2 – шиповатый; 3 – базальный; 4 – собственная пластинка слизистой оболочки
Fig. 3. Nonkeratinized stratified squamous epithelium. X90.
1 – layer of flat cells; 2 – prickly; 3 – basal; 4 – own plate of a mucous membrane
В клетках шиповатого слоя наиболее высока активность лактатдегидрогеназы (ЛДГ) – фермента, связанного с гликолизом.
В ходе исследования получена информация о гликозаминогликанах, обладающих защитной функцией. Токсины бактерий и вирусов воздействуют таким образом, что происходит увеличение количества нуклеиновых кислот, указывая при этом на высокий уровень обменных процессов, являющийся основой высокой регенеративной способности и митотической активности клеток. При воспалительных реакциях происходит деполимеризация гиалуроновой кислоты, что увеличивает проницаемость соединительной ткани сосудов.
Установлено, что вирус гриппа в эпителиальных клетках вызывает желтовато-зеленое свечение (рис. 4) [Луцкая, Зиновенко, 2014].

Рис.4. Вирус гриппа в эпителиальных клетках
Fig.4. Influenza virus in epithelial cells
Некоторые исследователи [Brandini et al., 2021; Tsuchiya, 2021; Drozdzik A., Drozdzik M., 2022] предполагают, что эпителий слюнных желез является основными входными воротами для инфекции. Иммуногистохимический анализ выявил экспрессию как ACE2, так и TMPRSS2 в губной железе в слизистых и серозных ацинусах. Наблюдалась более сильная экспрессия TMPRSS2 в серозных ацинусах, чем в слизистых ацинусах. ACE2 был найден в поперечнополосатых протоках, в отличие от TMPRSS2. По полученным авторами данным можно судить о слизистой оболочке полости рта и отверстиях протоков слюнных желез, а также о малых слюнных железах как об основном месте прикрепления вирусов [Pascolo et al., 2020; Shamsoddin, 2020; Song et al., 2020; Sawa et al., 2021]. При помощи методов выявлена локализация белков ACE2 и TMPRSS2 в цитоплазме и цитомембране серозных ацинарных клеток и эпителиальных клеток протоков околоушных и подчелюстных желез, цитоплазме и цитомембране серозных ацинарных клеток в смешанных ацинусах подъязычных желез. Воспалительные процессы явились причиной снижения уровней содержания ACE2 и TMPRSS2 в вышеуказанных локализациях белков. [Zhu et al., 2022]. Различные паттерны протеаз могут указывать на тканеспецифические ворота инфекции [Huang et al., 2021]. Эндосомальные протеазы CTSB и CTSL демонстрировали широкие паттерны экспрессии по всему эпителию [Zhu et al., 2022; Sungnak et al., 2020; Zhong et al., 2020].
На примере заболевания SARS-CoV-2 можно посмотреть взаимодействие вируса со слюнными железами. Показано, что спайковые белки SARS-CoV-2 способны связываться в гомогенатах слюнных желез с клетками околоушной, подчелюстной и подъязычной желез человека [Zhu et al., 2022]. Малые и большие железы способны к репликации вируса подобно СОПР.
Проведенные исследования [Huang et al., 2021] показывают обнаружение при вскрытии в инфицированных ациносах и протоках малых слюнных железах репликации SARS-CoV-2.
Об инфицировании подчелюстных желез SARS-CoV-2 было сообщено и авторами [Shchurink et al., 2020] и [Matuck et al., 2021]. При помощи электронно-микроскопического анализа было проведено изучение посмертных биопсий, в ходе которых обнаружили РНК SARS-CoV-2 в 60 % образцов подчелюстной и околоушной желез в виде сферических вирусных частиц размером 70–100 нм [Matuck et al., 2021; Drozdzik A., Drozdzik M. 2022].
По данным [Maldonado et al., 2022], подчелюстные железы показали значительные ультразвуковые отклонения в паренхиме относительно околоушных желез. В соответствии с низким потоком слюны и ксеростомией у пациентов наблюдались изменения в нескольких маркерах ацинарной и протоковой функции. Полученные авторами данные позволяют предположить, что инфекция может вызывать ксеростомию.
Получены сведения [Harley et al., 2011] о преобладании CD8+-клеток над CD4+-клетками. Это, в свою очередь, означает индукцию основного цитотоксического клеточно-опосредованного иммунного ответа, который, вероятно, соответствует вирусной этиологии.
В своем исследовании авторы [Сирак и др., 2018] выявили, что по истечении десяти суток (рис. 5, 6) при PAS-реакции, в цитоплазме околоушной железы при патологии обнаруживаются полисахариды, наблюдается интенсивное окрашивание цитоплазмы клеток подчелюстной железы. В белковых же клетках во время PAS-peакции происходило окрашивание гранул в апикальной части. Также авторы подчеркивают тот факт, что маркером воспаления является присутствие сиаловых кислот в слизистых клетках подчелюстной и подъязычной желез и в секреторных клетках околоушной железы. Из этого можно сделать вывод об одинаковой частоте обнаружения белковых веществ как в слизистых, так и в белковых клетках.

Рис. 5. Микропрепараты секреторных клеток околоушной железы на 10-е (а) и 30-е (б) сутки после формирования модели экспериментального пародонтита: а – интенсивно окрашенные гранулы (1) различной величины в цитоплазме апикальной части клеток (2); б – ослабление интенсивности PAS-реакции гранул после обработки срезов мягким кислотным гидролизом и жестким метилированием. ИГХ-реакция (иммуногистохимическая-реакция) на полисахариды по Spicer и Lillie
Fig. 5. Micropreparations of secretory cells of the parotid gland on the 10th (a) and 30th (b) days after the formation of the model of experimental periodontitis: a – intensely stained granules (1) of various sizes in the cytoplasm of the apical part of the cells (2); (b) – weakening of the intensity of the PAS-reaction of granules after treatment of sections with mild acid hydrolysis and severe methylation. IHC-reaction (immunohistochemical-reaction) for polysaccharides according to Spicer and Lillie
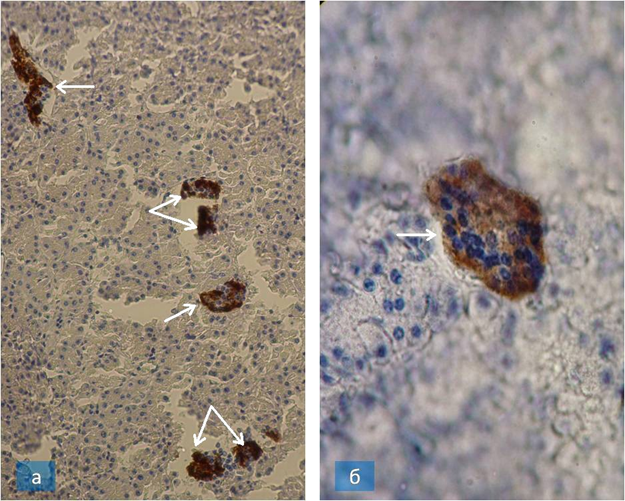
Рис. 6. Микропрепараты смешанных концевых отделов подъязычной железы на 10-е (а) и 60-е (б) сутки после формирования модели экспериментального пародонтита: а – хондроитин-сульфат В (отмечен стрелками в слизистых клетках при низком рН (1,21); б – остаточная PAS-реакция в слизистой клетке (отмечена стрелкой). ИГХ-реакция метахромазии с азуром. Продукт реакции коричневого цвета. Ок. 10, об. 20 (а), ок. 20, об. 40 (б)
Fig. 6. Micropreparations of mixed terminal sections of the sublingual gland on the 10th (a) and 60th (b) days after the formation of the model of experimental periodontitis: a – chondroitin sulfate B (marked by arrows in mucous cells at low pH (1.21); b – residual PAS reaction in the mucosal cell (marked with an arrow) IHC reaction of metachromasia with azure Brown reaction product Approx 10 v 20 (a) Approx 20 v40 (b)
Заключение
Гистохимический метод является перспективным направлением, так как позволяет наиболее точно интерпретировать получаемые результаты. Использование в стоматологии данного метода помогло решить многие вопросы, касающиеся оценки слизистой оболочки полости рта, которые укладываются в существующие представления о компьютерной классификации объектов медико-биологического исследования.
ОРВИ – заболевание, с которым встречается каждый человек в своей жизни. Чтобы уберечься от постинфекционных осложнений, важно тщательно следить за гигиеной полости рта и проводить профилактические мероприятия у стоматолога. Ведь как говорил «отец медицины» Гиппократ: «Любую болезнь легче предупредить, чем вылечить».





Список литературы
Гонтарев С.Н., Гонтарева И.С., Никишаева А.В. 2017. Иммуногистохимическое исследование при диагностике пародонтита. Стоматология славянских государств: сборник трудов Х Международной научно-практической конференции, посвящённой 25-летию ЗАО «ОЭЗ «ВладМиВа». (10): 114–116.
Гонтарев С.Н., Гонтарева И.С., Фурда Н.И., Пунько Д.С. 2022. Фитопроцедуры при гингивите на фоне ОРВИ. Сборник трудов ХV Международной научно-практической конференции, посвященной 30-летию компании «ВладМиВа». (15): 60–63.
Кобзева Г.Б., Гонтарев С.Н., Ясин Мустафа. 2019. Показатели цитологического и бактериоскопического исследования в оценке состояния пародонтальных тканей в процессе ведения пациентов с диагнозом: хронический генерализованный пародонтит легкой степени тяжести. Вестник новых медицинских технологий. 26 (4): 62–65. doi:10.24411/1609-2163-2019-16567
Лепёхина Л.И., Лепёхина О.А. 2016. Роль некоторых биополимеров в реализации барьерной функции десны. Международный журнал экспериментального образования. 10 (2): 231.
Лепёхина Л.И., Лепёхина О.А. 2018. Методики клинической гистохимии в клинике терапевтической стоматологии с использованием вероятностно-статистических оценок полученных данных. Молодой ученый. 18 (204): 126–128.
Луцкая И.К., Зиновенко О.Г. 2014. Состояния слизистой оболочки полости рта при острых инфекционных заболеваниях. Педиатрия. Consilium Medicum. (2): 21–25.
Московский А.В., Любовцева Л.А. 2007. Гистохимическое исследование пульпы зуба в онтогенезе и при развитии сочетанной патологии органов полости рта. Вестник Чувашского университета. (2): 82–89.
Орлов А.С., Халимова А.А., Угольников В.В. 2022. Анализ уровня и динамики цен на российском рынке лекарственных препаратов, используемых для профилактики и лечения ОРВИ и гриппа. Медико-фармацевтический журнал Пульс. 24 (7): 57–64. doi:10.26787/nydha-2686-6838-2022-24-7-57-64
Сирак А.Г., Щетинин Е.В., Сирак С.В., Диденко Н.Н., Апчел В.Я., Попов В.И. 2018. Иммуногистохимические особенности больших слюнных желез крыс при экспериментальном пародонтите. Медицинский вестник Северного Кавказа. 13 (2): 410–414. doi: 10.14300/mnnc.2018.13064
Arshad Ali S., Baloch M., Ahmed N., Arshad Ali A., Iqbal A. 2020. The outbreak of coronavirus disease 2019. (COVID-19)-an emerging global health threat. Journal of Infection and Public Health. 13 (4): 644–646. doi: 10.1016/j.jiph.2020.02.033
Azzi L., Carcano G., Gianfagna F., Grossi P., Gasperina D.D., Genoni A., Fasano M., Sessa F., Tettamanti L., Carinci F., Maurino V., Rossi A., Tagliabue A., Baj A. 2020. Saliva is a reliable tool to detect SARS-CoV-2. Journal of Infection, 81 (1): e45–e50. doi: 10.1016/j.jinf.2020.04.005
Brandini D.A., Takamiya A.S., Thakkar P., Schaller S., Rahat R., Naqvi A.R. 2021. COVID-19 and oral diseases: Crosstalk, synergy or association? Rev. Med. Virol. 31 (6): e2226. doi: 10.1002/rmv.2226
Drozdzik A., Drozdzik M. 2022. Oral Pathology in COVID-19 and SARS-CoV-2 Infection–Molecular Aspects. Int. J. Mol. Sci. 23 (3): 1431. doi: 10.3390/ijms23031431
Harley R., Gruffydd-Jones T.J, Day M.J. 2011. Immunohistochemical characterization of oral mucosal lesions in cats with chronic gingivostomatitis. J. Comp. Pathol. 144 (4): 239–250. doi:10.1016/j.jcpa.2010.09.173.
Huang N., Pérez P., Kato T., Mikami Y., Okuda K., Gilmore R.C., Conde C.D., Gasmi B., Stein S., Beach M., Pelayo E., Maldonado J.O., Lafont B.A., Jang S.I., Nasir N., Padilla R.J., Murrah V.A., Maile R., Lovell W., Wallet S.M., Bowman N.M., Meinig S.L., Wolfgang M.C., Choudhury S.N., Novotny M., Aevermann B.D., Scheuermann R.H., Cannon G., Anderson C.W., Lee R.E., Marchesan J.T., Bush M., Freire M., Kimple A.J., Herr D.L., Rabin J., Grazioli A., Das S., French B.N., Pranzatelli T., Chiorini J.A., Kleiner D.E., Pittaluga S., Hewitt S.M., Burbelo P.D., Chertow D.; Frank K., Lee J., Boucher R.C., Teichmann S.A., Warner B.M., Byrd K.M. 2021. SARS-CoV-2 infection of the oral cavity and saliva. Nat. Med. 27 (5): 892–903. doi:10.1038/s41591-021-01296-8.
Maldonado J.O., Beach M.E., Wang Y., Perez P., Yin H., Pelayo E., Fowler S., Alevizos I., Grisius M., Baer A.N., Walitt B., De Giorgi V., Alter H.J., Warner B.M., Chiorini J.A. 2022. HCV Infection Alters Salivary Gland Histology and Saliva Composition. J. Dent. Res. 101 (5): 534–541. doi:10.1177/00220345211049395
Matuck B.F., Dolhnikoff M., Duarte-Neto A.N., Maia G., Gomes S.C., Sendyk D.I., Zarpellon A., de Andrade N.P., Monteiro R.A., Pinho J.R.R., Gomes-Gouvêa M.S., Souza S.C., Kanamura C., Mauad T., Saldiva P.H.N., Braz-Silva P.H., Caldini E.G., da Silva L.F.F. 2021. Salivary glands are a target for SARS-CoV-2: a source for salivacon tamination. J. Pathol. 254 (3): 239–243. doi: 10.1002/path.5679
Pascolo L., Zupin L., Melato M., Tricarico P.M., Crovella S. 2020. TMPRSS2 and ACE2 coexpression in SARS-CoV-2 salivary glands infection. Journal of Dental Research. 99 (10): 1120–1121. doi: 10.1177/0022034520933589
Sawa Y., Ibaragi S., Okui T., Yamashita J., Ikebe T., Harada H. 2021. Expression of SARS-CoV-2 entry factors in human oral tissue. J. Anat. 238 (6): 1341–1354. doi:10.1111/joa.13391
Shamsoddin E. 2020. Saliva: a diagnostic option and a transmission route for 2019-nCoV. Evidence-Based Dentistry. 21 (2): 68–70. doi: 10.1038/s41432-020-0104-8
Shchurink B., Roos E., Radonik T., Barbe E., Bowman C.S.C., de Boer H.H., de Bry G.J., Bulle E.B., Aronika E.M. Florkin S.,Fronczek J., Heunks L.M.A., de Jong M.D., Guo L., du Long R., Lutter R., Molenaar P.C.G., Neefjes-Borst E.A., Niessen H.W.M., van Noesel C.J.M., Roelofs J.J.T.H., Snijder E.J., Soer E.C., Verheij J., Vlaar A.P.J., Vos W., van der Wel N.N., van der Wal A.C., van der Valk P., Bugiani M. 2020. Viral presence and immunopathology in patients with lethal COVID-19: a prospective autopsy cohort study. The Lancet Microbe. 1 (7): 290–299. doi:10.1016/S2666-5247(20)30144-0.
Singhal T. 2020. A review of coronavirus disease-2019 (COVID-19). Indian Journal of Pediatrics. 87 (4): 281–286. doi: 10.1007/s12098-020-03263-6
Song, J., Li Y., Huang X., Chen Z., Li Y., Liu, C. Chen Z., Duan X. 2020. Systematic analysis of ACE2 and TMPRSS2 expression in salivary glands reveals underlying transmission mechanism caused by SARS-CoV-2. Journal of Medical Virology. 92 (11): 2556–2566. doi: 10.1002/jmv.26045
Sungnak W., Huang N., Bécavin C., Berg M., Queen R., Litvinukova M., Talavera-López C., Maatz H., Reichart D., Sampaziotis F. et al. 2020. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat. Med. 26 (5): 681–687. doi: 10.1038/s41591-020-0868-6
Tsuchiya H. 2021. Characterization and pathogenic speculation of xerostomia associated with COVID-19: A narrative review. Dent. J. 9 (11): 130. doi: 10.3390/dj9110130
Zhong M., Lin B., Pathak J.L., Gao H., Young A.J., Wang X., Liu C.H., Wu K., Liu M., Chen J. et al. 2020. ACE2 and furin expressions in oral epithelial cells possibly facilitate COVID-19 infection via respiratory and fecal-oral routes. Front. Med. 7: 580796. doi:10.3389/fmed.2020.580796. 30
Zhu F., Zhong Y., Ji H., Ge R., Guo L., Song H., Wu H., Jiao P., Li S., Wang C., Du H. 2022. ACE2 and TMPRSS2 in human saliva can adsorb to the oral mucosal epithelium. J. Anat. 240 (2): 398–409. doi: 10.1111/joa.13560