Влияние интерлейкина-21 на состояние внутриклеточных сигнальных механизмов в лейкоцитах у реконвалесцентов внебольничной пневмонии
Aннотация
Представлены результаты исследования возможных механизмов влияния интерлейкина-21 на функциональное состояние клеток крови и продукцию ими цитокинов у лиц, перенесших пневмонию. Цель: исследование влияния интерлейкина-21 на состояние сигнальных механизмов, в частности митоген-активируемого / стресс-активируемого сигнальных путей, уровень белков теплового шока и гистонов в мононуклеарных лейкоцитах периферической крови у реконвалесцентов внебольничной пневмонии, а также продукции интерлейкинов и факторов роста. Обследовано 40 пациентов мужского пола от 18 до 43 лет с внебольничной пневмонией на 13–15 сутки заболевания. Результаты. У лиц, перенесших пневмонию, уровень интерлейкина-21 связан с состоянием митоген-активируемого / стресс-активируемого сигнальных путей, а также сигнального пути, ассоциированного с янус-киназами и сигнальными трансдукторами и активаторами транскрипции, определяя цитокиновый профиль и особенности постклинической фазы заболевания у таких больных.
Ключевые слова: интерлейкин-21, пневмония, цитокины, факторы роста, иммунореабилитация, внутриклеточные сигнальные пути, факторы транскрипции, воспаление
Введение
В процессах восстановления иммунологического гомеостаза после перенесенной острой инфекции большое значение имеет достижение нормализации функциональной активности клеток врожденного и адаптивного иммунного ответа. Учитывая важную роль цитокинов в регуляции как адаптивных, так и врожденных механизмов иммунитета, нарушение их продукции может сопровождаться разнообразными патологическими проявлениями, в частности иммунодефицитом, хронизацией воспалительного процесса, развитием синдрома системной воспалительной реакции и т. п. проявлениям, приводящим к затяжному и хроническому течению заболеваний, возникновению повторных инфекций и суперинфекций, а также септических состояний [Логаткина и др., 2017; Симбирцев, 2018; Бязрова и др., 2020].
В системе цитокинов особое место отводится интерлейкину-21 (ИЛ-21), обладающему способностью модулировать как гуморальный иммунный ответ за счет стимуляции дифференцировки В-лимфоцитов и фолликулярных Т-хелперов, так и клеточный ответ, за счет регуляции активности NK и CD8+ лимфоцитов [Симбирцев, 2018; Long et al., 2019]. Большинство биологических эффектов ИЛ-21 реализуется посредством активации в соответствующих клетках JAK/STAT-сигнального пути, в частности фосфорилирования протеинкиназ JAK1, JAK3 и сигнальных трансдукторов и активаторов транскрипции STAT1, STAT3 [Spolski et al., 2019; Liu et al., 2020].
Вместе с тем в настоящее время биологическое действие ИЛ-21 исследовано недостаточно полно, в частности не в полной мере изучены молекулярные механизмы формирования биологических эффектов цитокина с участием митоген-активируемого / стресс-активируемого (MAPK/SAPK) сигнального пути, а также его влияние на состояние неспецифической резистентности и продукцию других цитокинов, в частности ИЛ-4, ИЛ-13, ИЛ-15, ИЛ-18 и факторов роста.
Целью данного исследования явилось изучение влияния ИЛ-21 на состояние внутриклеточных сигнальных механизмов, белков теплового шока и гистонов в мононуклеарных лейкоцитах периферической крови у реконвалесцентов внебольничной бактериальной пневмонии, а также продукции ими интерлейкинов, их растворимых рецепторов.
Материалы и методы
Изучены результаты обследования 40 пациентов обоего пола от 18 до 43 лет (средний возраст – 33±5,5 лет), поступивших в клинику с внебольничной пневмонией. В соответствии с целью исследования, в ядерно-цитоплазматических лизатах МНК, выделенных из венозной крови, методом иммуноферментного анализа (ИФА) на 13–15 сутки заболевания оценивали концентрацию (нг/мл) белка теплового шока-60 (БТШ60), белка теплового шока-70 (БТШ70), субъединиц р50 и р65 фактора транскрипции NF-κB. Кроме того, исследовали уровень фосфорилирования (в условных единицах на нг протеина – ед/нг) по тирозину в положении 1007⁄1008 рецепторной протеинкиназы JAK2, по тирозину в положении 694 – фактора STAT5А, по тирозину в положении 641 – фактора STAT6, по тирозину в положении 705 – фактора STAT3, по серину в положении 32 – фактора IκBα, по серину в положении 10 – гистона Н3, по серину в положении 32 – БТШ27, по серину в положении 133 – фактора транскрипции CREB [Зилов и др., 2019; Терехов и др., 2019].
В клеточных супернатантах определяли концентрацию ИЛ-2, -4, -12, -13, -15, -17, -18, -19, -21, -23, хемокинов MCP-1 и MIP3α, факторов роста bFGF, VEGF-A, VEGF-C, концентрацию растворимой формы рецепторов к ИЛ-2 (RIL2), ИЛ-4 (RIL4), растворимой формы рецептора 1 типа к VEGF (VEGF-RI), матриксной металлопротеиназы-1 (ММП1). Также определяли уровень растворимой формы рецептора DcR3, лиганда рецептора лимфотоксина β (LIGHT), ФНО-подобного слабого индуктора апоптоза (TWEAK), ФНО-зависимого лиганда, индуцирующего апоптоз (TRAIL).
Статистический анализ проводили с использованием программы Statistica 13.0 (StatSoft, США). Исследуемые показатели представляли в виде среднего значения, медианы (Ме), 25 и 75 процентилей выборки. Значимость межгрупповых различий оценивали с помощью U-критерия Манна – Уитни. Взаимосвязи изучаемых факторов оценивали методом иерархического кластерного анализа с использованием правила Варда с целью объединения исследованных факторов в кластеры в метрике 1 – коэффициент корреляции Пирсона.
Результаты
Анализ содержания в сыворотке ИЛ-21 показал, что у реконвалесцентов ВП его средний уровень составил 2,0 нг/мл. Значение 1 и 4 квартиля, а также медианы выборки составили 1,08, 3,1 и 1,87 нг/мл, соответственно. С учетом полученных данных были сформированы две подгруппы с условно низким (подгруппа 1) и высоким (подгруппа 2) уровнем ИЛ-21. В первую группу были включены образцы с концентрацией ИЛ-21 ниже медианных значений (1,87 нг/мл и менее), во вторую – образцы с уровнем ИЛ-21, равным либо превышавшим медианную концентрацию (1,87 нг/мл и более). Результаты исследования представлены в таблице 1.
Таким образом, повышение продукции ИЛ-21 ассоциируется с увеличением продукции bFGF на 143,4 % (р = 0,0001), ИЛ-15 на 130,0 % (р = 0,0001), ИЛ-19 на 125,1 % (р = 0,0001), ИЛ-4 на 74,2 % (р = 0,013), ИЛ-13 на 65,8 % (р = 0,017), ИЛ-18 на 64,9 % (р = 0,017), ИЛ-23 на 58,5 % (р = 0,019), ИЛ-12 на 55,5 % (р = 0,023), ИЛ-2 на 27,8 % (р = 0,046), ИЛ-17 на 15,4 % (р = 0,053), МСР1 на 15,3 % (р = 0,1). Кроме того, в подгруппе с высоким уровнем ИЛ-21 отмечалось повышение уровня RIL4 на 62,4 (р = 0,018), RIL2 на 39,4 % (р = 0,032), а также VEGF-RI на 7,9 % (р = 0,18). На этом фоне отмечалось снижение продукции MIP3α на 9,6 % (р = 0,12), VEGF-A на 10,4 % (р = 0,06), VEGF-C на 22,2 % (р = 0,043).
Таблица 1
Table 1
Уровень исследованных показателей в подгруппах
The level of the investigated cytokines
Цитокин, нг/мл | Подгруппа 1 | Подгруппа 2 | ||
х | Ме (25; 75 %) | х | Ме (25; 75 %) | |
ИЛ-2 | 1,2 | 1,0 (0,9; 1,3) | 1,54 | 1,5 (1,4; 1,6) |
RIL2 | 1,24 | 1,1 (0,8; 1,8) | 1,73 | 1,7 (1,6; 2,2) |
ИЛ-4 | 1,39 | 1,5 (0,8; 1,7) | 2,43 | 2,3 (1,9; 3,2) |
RIL4 | 1,0 | 0,8 (0,7; 1,0) | 1,63 | 1,4 (0,8; 2,1) |
ИЛ-12 | 1,34 | 0,8 (0,7; 1,5) | 2,08 | 2,5 (1,3; 2,8) |
ИЛ-13 | 1,45 | 1,0 (0,9; 2,8) | 2,41 | 2,5 (1,9; 2,8) |
ИЛ-15 | 0,98 | 0,9 (0,8; 0,9) | 2,26 | 1,8 (1,4; 3,4) |
ИЛ-17А | 1,74 | 1,5 (1,4; 1,9) | 2,01 | 1,5 (1,1; 3,1) |
ИЛ-18 | 1,11 | 0,8 (0,7; 1,0) | 1,83 | 2,1 (1,4; 2,4) |
ИЛ-19 | 1,02 | 0,9 (0,8; 1,0) | 2,29 | 2,2 (1,9; 2,5) |
ИЛ-23 | 1,08 | 0,9 (0,8; 1,1) | 1,71 | 1,6 (0,9; 2,1) |
MCP1 | 2,37 | 2,2 (2,2; 2,7) | 2,73 | 2,8 (2,5; 3,0) |
MIP3α | 2,76 | 2,7 (2,6; 2,8) | 2,49 | 2,3 (2,2; 2,8) |
bFGF | 0,92 | 0,9 (0,8; 2,8) | 2,24 | 2,3 (2,1; 2,8) |
VEGF-A | 1,17 | 1,1 (1,0; 1,5) | 1,05 | 1,2 (0,7; 1,4) |
VEGF-C | 1,0 | 1,0 (0,9; 1,2) | 0,77 | 0,7 (0,5; 1,1) |
VEGF-RI | 1,2 | 1,0 (0,9; 1,0) | 1,3 | 1,2 (1,1; 1,4) |
ИЛ-21 | 0,91 | 0,8 (0,7; 1,0) | 2,89 | 2,8 (2,7; 3,1) |
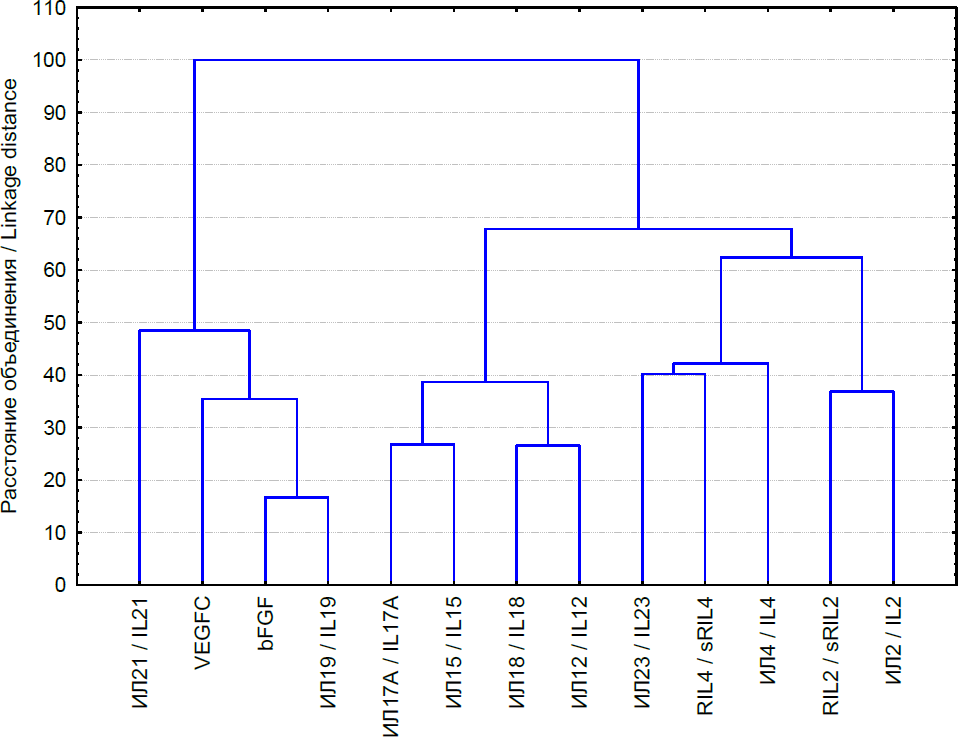
Рис. 1. Результаты кластерного анализа взаимосвязи исследованных цитокинов
Fig. 1. Results of cluster analysis of the relationship of the studied cytokines
Проведенный анализ потенциальных взаимосвязей между исследованными молекулами позволил выделить 2 кластера. В первый кластер могут быть включены ИЛ-21, ИЛ-19, bFGF и VEGF-C. При этом в данном кластере, в соответствии с величиной дистанции между исследуемыми факторами, наиболее тесные связи имеют место между ИЛ-19 и bFGF, что может определяться важной ролью ИЛ-19 в стимуляции экспрессии гена bFGF. При этом взаимосвязи между факторами роста (VEGF и bFGF) и ИЛ-19, очевидно, определяются его способностью контролировать экспрессию генов, отвечающих за ангиогенез [Симбирцев, 2018; Liu et al., 2019; Fujimoto et al., 2021]. Второй кластер, в который входят оставшиеся медиаторы, регулирующие активность Т-хелперов и В-лимфоцитов, может быть разделен на два подмножества. В первое подмножество второго кластера входят ИЛ-17А, ИЛ-15, ИЛ-18, ИЛ-12, т. е. цитокины, регулирующие в первую очередь клеточно-опосредованный иммунный ответ, во второе – ИЛ-23, ИЛ-2, ИЛ-4, RIL2, RIL4 – регулирующие преимущественно дифференцировку Т-хелперов и формирование гуморального иммунного ответа. Таким образом, результаты кластерного анализа позволяют говорить о взаимосвязи продукции ИЛ-21 с продукцией факторов, определяющих репарацию и регенерацию тканей (исследуемые факторы роста, ИЛ-19), а также регуляторов адаптивного иммунного ответа.
Уровень исследованных регуляторов межклеточных взаимодействий и сигнальных путей представлен в таблице 2.
Таблица 2
Table 2
Уровень исследованных факторов в зависимости от продукции ИЛ-21
The level of the investigated factors
Фактор | Подгруппа 1 | Подгруппа 2 | ||
х | Ме (25; 75 %) | х | Ме (25; 75 %) | |
H3, ед/нг | 2,79 | 2,5 (2,4; 2,7) | 1,64 | 1,5 (1,1; 2,1) |
БТШ27, ед/нг | 0,13 | 0,1 (0,05; 0,1) | 0,15 | 0,1 (0,1; 0,2) |
БТШ60, нг/мл | 271,9 | 247,4 (223,3; 284,5) | 321,0 | 328,7 (247,9; 374,9) |
БТШ70, нг/мл | 145,4 | 145,5 (145,4; 149,0) | 126,9 | 126,8 (119,1; 132,3) |
TRAIL, нг/мл | 0,84 | 0,8 (0,8; 1,1) | 0,91 | 0,9 (0,7; 1,1) |
TWEAK, нг/мл | 13,0 | 13,5 (10,3; 13,6) | 16,5 | 17,4 (14,9; 17,5) |
LIGHT, нг/мл | 15,4 | 14,8 (14,7; 17,3) | 15,9 | 17,8 (12,0; 20,1) |
DcR3, нг/мл | 0,93 | 0,9 (0,9; 1,0) | 1,07 | 1,0 (1,0; 1,2) |
JAK2, ед/нг | 0,71 | 0,7 (0,6; 0,9) | 0,53 | 0,4 (0,4; 0,7) |
STAT3, ед/нг | 1,01 | 1,1 (0,8; 1,2) | 0,6 | 0,5 (0,2; 1,0) |
STAT5A, ед/нг | 0,76 | 0,8 (0,7; 0,8) | 0,68 | 0,7 (0,5; 0,7) |
STAT6, ед/нг | 2,01 | 2,3 (1,7; 2,3) | 1,27 | 1,1 (1,1; 1,7) |
p50, нг/мл | 1,32 | 1,4 (1,2; 1,4) | 1,65 | 1,9 (1,1; 2,0) |
p65, нг/мл | 1,24 | 1,1 (1,1; 1,9) | 1,44 | 1,3 (1,2; 1,9) |
IkBα, ед/нг | 0,41 | 0,4 (0,3; 0,5) | 0,44 | 0,5 (0,3; 0,6) |
CREB, ед/нг | 1,01 | 1,1 (0,9; 1,1) | 1,29 | 1,14 (1,1; 1,8) |
ММП1, нг/мл | 0,99 | 1,0 (0,8; 1,3) | 0,73 | 0,6 (0,6; 0,9) |
Проведенный анализ свидетельствует о том, что повышение продукции ИЛ-21 ассоциировано с повышением содержания в МНК фактора р50 на 25,0 % р = 0,039), р65 на 15,6 % (р = 0,05), концентрации БТШ60 на 18,1 % (р = 0,05). Также было выявлено повышение уровня фосфорилирования БТШ27 на 15,2 % (р = 0,051), CREB на 27,6 % (р = 0,041), IkBα на 6,2 % (р = 0,06). На фоне повышения концентрации ИЛ-21 отмечалось повышение уровня TWEAK на 27,4 % (р = 0,041), DcR3 на 15,1 % (р = 0,045), TRAIL на 7,3 % (р = 0,06), LIGHT на 3,2 % (р = 0,1). В свою очередь, повышение уровня ИЛ-21 ассоциировалось с дефосфорилированием гистона Н3 на 41,1 % (р = 0,032), STAT3 на 40,8 % (р = 0,033), STAT6 на 36,6 % (р = 0,032), STAT5A на 10,8 % (р = 0,1), JAK2 на 25,3 % (р = 0,037). В МНК наблюдалось снижение уровня БТШ70 на 12,7 % (р = 0,055), продукции ММП1 на 26,3 % (р = 0,042).
На рисунке 2 представлены результаты кластерного анализа взаимосвязи продукции ИЛ-21 и исследованных регуляторов внутриклеточных процессов.
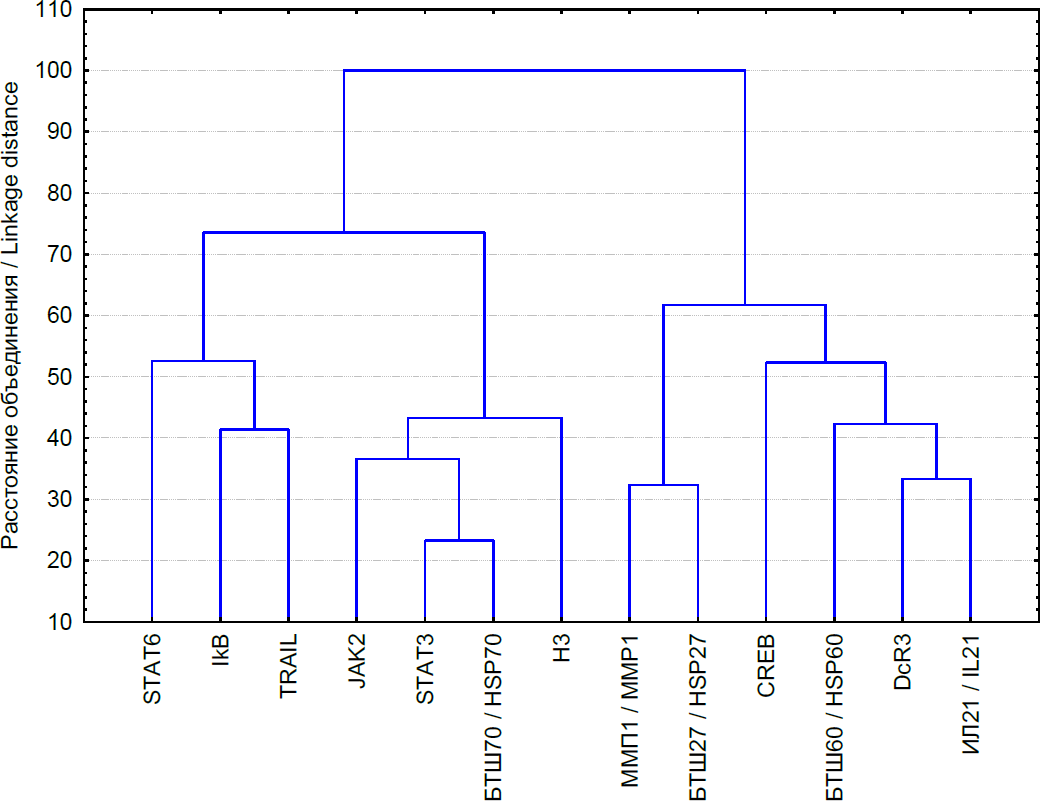
Рис. 2. Результаты кластерного анализа исследованных факторов
Fig. 2. Results of cluster analysis of the investigated factors
Проведенный анализ позволил выделить два крупных кластера, включающих в себя наиболее тесно связанные факторы. В первый кластер, образованный с участием ИЛ-21, включены DcR3, CREB, БТШ60 и БТШ27 и ММП1. Таким образом, у реконвалесцентов ВП в физиологических условиях биологические эффекты ИЛ-21 могут формироваться за счет активации MAPK/SAPK-сигнального пути, в частности фактора транскрипции CREB. При этом контроль со стороны ИЛ-21 экспрессии DcR3, которая зависит от состояния MAPK/SAPK-сигнального пути, определяет влияние цитокина на пролиферацию и апоптоз МНК. Повышение уровня БТШ60 и БТШ27, также находящихся в связи с продукцией ИЛ-21, в целом определяет цитопротективные эффекты ИЛ-21 у реконвалесцентов ВП.
Второй кластер может быть разделен на два подмножества. В первое входит JAK2, STAT3, БТШ70 и гистон H3, во второе – STAT6, IkBα и TRAIL. Первое подмножество изучаемых факторов второго кластера, имеющее связь с первым кластером, включает комплекс молекул, проявляющих преимущественно антипролиферативные эффекты в отношении клеток-мишеней ИЛ-21. Второе подмножество данного кластера объединяет регуляторы воспаления и апоптоза, также находящиеся под контролем ИЛ-21 [Симбирцев, 2018; Hsieh et al., 2017; Ghobadi et al., 2020; Wang et al., 2020; Pan et al., 2021].
Таким образом, в диапазоне физиологических концентраций ИЛ-21 может оказывать значимое стимулирующее влияние на продукцию ИЛ-15, ИЛ-19 и bFGF, в минимальной степени влияя на уровень ИЛ-2, ИЛ-17A и МСР-1, угнетая при этом продукцию MIP3α. При этом отрицательное влияние цитокина на фосфорилирование отдельных компонентов JAK/STAT-сигнального пути определяет снижение чувствительности клеток к соответствующим цитокинам, способствуя тем самым ограничению провоспалительной реактивности иммунокомпетентных клеток у реконвалесцентов пневмонии.
Обсуждение
Выявленное в исследовании уменьшение фосфорилирования факторов JAK2 и STAT3 на фоне повышения продукции ИЛ-21 может определяться его стимулирующим влиянием на экспрессию генов супрессоров цитокиновой сигнализации (SOCS-белков) и фосфатаз двойной специфичности, таких как РР2СА и РТР1В [Strengell et al., 2006]. На этом фоне снижение уровня фосфорилирования гистона Н3, содержания в МНК БТШ70, продукции ММП1 и VEGF также может являться следствием негативной регуляции JAK/STAT-сигнального пути, в частности дефосфорилирования фактора STAT3 за счет активации петли отрицательной обратной связи [Xu et al., 2018; Yoshida et al., 2019]. При этом снижение активности сигнального пути JAK2/STAT3, установленное в настоящем исследовании, ассоциирующееся с уменьшением продукции MIP3α и ММП1, в сочетании с повышением уровня ИЛ-19, FGFβ и БТШ60 может лежать в основе модулирующего влияния ИЛ-21 в отношении иммунной защиты слизистых оболочек и эпителиальных барьеров [Симбирцев, 2018; Vallières et al., 2019].
Ассоциация повышенного уровня ИЛ-21 и DcR3, являющегося важным отрицательным регулятором воспаления, способствующим ограничению процессов апоптоза, а также хемотаксиса лимфоцитов, позволяет говорить о том, что отдельные функции ИЛ-21, в частности ослабление аутоиммунных реакций и противовоспалительное действие, опосредуются повышенной экспрессией молекул-членов семейства фактора некроза опухоли [Hsieh et al., 2017; Ghobadi et al., 2020; Pan et al., 2021]. Также можно отметить, что стимуляция фосфорилирования БТШ27, наблюдающаяся при повышенной продукции ИЛ-21, определяет протективные противовоспалительные эффекты ИЛ-21 в отношении кислород-зависимого повреждения клеток, что, в свою очередь, связано с его способностью угнетать экспрессию таких молекул, как ICAM-1 и VCAM-1, матриксных металлопротеиназ, а также ограничивать активность каспазы-3 и тормозить процессы апоптоза [Lee et al., 2008]. Стимулируя фосфорилирование БТШ27, ИЛ-21 может оказывать протективное действие при развитии ишемического повреждения тканей, предупреждая нарушение проницаемости гистогематических барьеров [Shimada et al., 2018]. Вместе с тем усиление фосфорилирования БТШ27, ассоциированное с повышением уровня ИЛ-21, может также играть вспомогательную роль в регуляции биологической активности цитокина за счет модуляции сигнального пути JAK/STAT [Kim et al., 2018; Yoshida et al., 2019].
Таким образом, оказывая влияние на продукцию цитокинов, регулирующих функциональную активность T-хелперов 1, 2 и 17 типов, В-лимфоцитов, а также NK-клеток и цитотоксических лимфоцитов, ИЛ-21 способствует поддержанию сопряженности адаптивных и врожденных механизмов иммунного ответа, включая процессы гуморального и клеточно-опосредованного иммунного ответа. Указанное обстоятельство определяет биологическую значимость ИЛ-21 в фазу реконвалесценции ВП, включая поддержание противоинфекционной резистентности, в том числе посредством активации факторов транскрипции CREB и STAT3/6, а также за счет эпигенетических механизмов, связанных с модификацией структуры гистонов [Voevodin et al., 2017; Spolski et al., 2019; Vallières et al., 2019]. Учитывая взаимосвязи между ИЛ-21 и фактором транскрипции CREB, ИЛ-21 можно рассматривать в качестве терапевтической мишени при различных иммунопатологических процессах, сопровождающихся нарушением взаимодействия между Т- и В-лимфоцитами, а также клетками адаптивного и врожденного иммунного ответа, в регуляции которых важную роль играет фактор CREB. При этом коррекция продукции ИЛ-21 может быть достигнута как медикаментозными, так и не медикаментозными стимулами. В последнем случае одним из стимуляторов продукции ИЛ-21 может являться низкоинтенсивное излучение частотой 1 ГГц, способствующее повышению продукции ИЛ-21, активации факторов транскрипции NF-κB и CREB, снижению фосфорилирования STAT3 и STAT6, приводя к усилению фагоцитоза, повышению продукции эндогенных антимикробных пептидов и противоинфекционной защиты, стимуляции пролиферации фибробластов, ускорению заживления ран [Терехов и др., 2017; Терехов и др., 2019, Thöni et al., 2021].





Список литературы
Бязрова М.Г., Астахова Е.А., Спиридонова А.Б., Васильева Ю.В. 2020. Стимуляция В-лимфоцитов человека in vitro с помощью ИЛ-21/CD40L и их характеристика. Иммунология. 41 (6): 501–510.
Зилов В.Г., Хадарцев А.А., Терехов И.В., Бондарь С.С. 2017. Взаимосвязь содержания в мононуклеарных лейкоцитах цельной крови в постклиническую фазу внебольничной пневмонии циклинов, циклин-зависимых киназ и их ингибиторов под влиянием микроволн частотой 1 ГГц. Бюллетень экспериментальной биологии и медицины. 163 (5): 578–581.
Логаткина А.В. Никифоров В.С., Бондарь С.С. 2017. Воспалительные цитокины и сигнальные системы мононуклеарных клеток периферической крови при ишемической болезни сердца. Клиническая медицина. 95 (3): 238–244.
Симбирцев А.С. 2018. Цитокины в патогенезе и лечении заболеваний человека. СПб, ООО «Издательство Фолиант». 512 с.
Терехов И.В., Никифоров В.С., Бондарь С.С. 2017. Изменение содержания компонентов IL/TOLL- сигнального пути и NF-kB в мононуклеарных клеток цельной крови под влиянием низкоинтенсивного электромагнитного излучения частотой 1 ГГц. Гены и клетки. 12 (2): 90–96.
Терехов И.В., Никифоров В.С., Бондарь С.С. 2019. Состояние RIG-I- и NF-KB-сигнальных путей в мононуклеарных клетках цельной крови практически здоровых лиц и реконвалесцентов пневмонии, подвергнутых митогенной стимуляции. Гены и клетки. 14 (3): 131–136.
Ghobadi H., Hosseini N., Aslani M.R. 2020. Correlations Between Serum Decoy Receptor 3 and Airflow Limitation and Quality of Life in Male Patients with Stable Stage and Acute Exacerbation of COPD. Lung. 198 (3): 515–523.
Spolski R., West E.E., Li P., Veenbergen S. 2019. IL-21/type I interferon interplay regulates neutrophildependent innate immune responses to Staphylococcus aureus. Elife. 8:e45501.
Long D., Chen Y., Wu H., Zhao M., Lu Q. 2019. Clinical significance and immunobiology of IL-21 in autoimmunity. J. Autoimmun. 99: 1–14.
Lee J.W., Kwak H.J., Lee J.J. 2008. HSP27 regulates cell adhesion and invasion via modulation of focal adhesion kinase and MMP-2 expression. Eur. J. Cell. Biol. 87 (6): 377–387.
Hsieh S.L., Lin W.W. 2017. Decoy receptor 3: an endogenous immunomodulator in cancer growth and inflammatory reactions. J. Biomed. Sci. 24 (1): 39.
Liu Z., Guo S., Dong Q. 2020. Nobiletin suppresses IL-21/IL-21 receptor-mediated inflammatory response in MH7A fibroblast-like synoviocytes (FLS): An implication in rheumatoid arthritis. Eur. J. Pharmacol. 875: 172939.
Wang M., Xie Z., Xu J., Feng Z. 2020. TWEAK/Fn14 axis in respiratory diseases. Clin Chim Acta. 509: 139–148.
Pan Y.G., Huang M.T., Sekar P., Huang D.Y. 2021. Decoy Receptor 3 Inhibits Monosodium Urate-Induced NLRP3 Inflammasome Activation via Reduction of Reactive Oxygen Species Production and Lysosomal Rupture. Front Immunol. 12: 638676.
Shimada Y., Shimura H., Tanaka R. 2018. Phosphorylated recombinant HSP27 protects the brain and attenuates blood-brain barrier disruption following stroke in mice receiving intravenous tissueplasminogen activator. PLoS One. 13 (5): e0198039.
Strengell M., Lehtonen A., Matikainen S., Julkunen I. 2006. IL-21 enhances SOCS gene expression and inhibits LPS-induced cytokine production in human monocyte-derived dendritic cells. J. Leukoc. Biol. 79 (6): 1279–1285.
Fujimoto Y., Kuramoto N., Yoneyama M., Azuma Y.T. 2021. Interleukin-19 as an Immunoregulatory Cytokine. Curr. Mol. Pharmacol. 14 (2): 191–199.
Thöni V., Oliva R., Mauracher D., Egg M. 2021. Therapeutic Nuclear Magnetic Resonance affects the core clock mechanism and associated Hypoxia-inducible factor-1. Chronobiol Int. 38 (8): 1120–1134.
Kim J.Y., An Y.M., Yoo B.R., Kim J.M. 2018. HSP27 inhibitor attenuates radiation-induced pulmonary inflammation. Sci. Rep. 8 (1): 4189.
Vallières F., Durocher I., Girard D. 2019. Biological activities of interleukin (IL)-21 in human monocytes and macrophages. Cell. Immunol. 337: 62–70.
Voevodin A.A., Khadartsev A.A., Bondar S.S., Terekhov I.V. 2017. The State of Intracellular Molecular Regulators during the Reconvalescence of Community-Acquired Pneumonia under the Influence of Microwaves at 1 GHz. Integr Med Int. 4: 171–180.
Xu N.W., Chen Y., Liu W. 2018. Inhibition of JAK2/STAT3 Signaling Pathway Suppresses Proliferation of Burkitt's Lymphoma Raji Cells via Cell Cycle Progression, Apoptosis, and Oxidative Stress by Modulating HSP70. Med. Sci. Monit. 24: 6255–6263.
Yoshida S., Yamamoto M., Aoki H., Fukuda H. 2019. STAT3 Activation Correlates with Adventitial Neutrophil Infiltration in Human Aortic Dissection. Ann. Vasc. Dis. 12 (2): 187–193.